巨大胃间质瘤合并甲型血友病围手术期治疗方法探讨
2012-09-11董永红张宏毅
戴 鹏,董永红,徐 钧,张宏毅
(1.山西省人民医院普外科,山西太原030012;2.古县人民医院,山西 临汾042400)
巨大胃间质瘤合并甲型血友病围手术期治疗方法探讨
戴 鹏1,董永红1,徐 钧1,张宏毅2
(1.山西省人民医院普外科,山西太原030012;2.古县人民医院,山西 临汾042400)
目的 探讨巨大胃间质瘤合并甲型血友病围手术期的治疗方法。方法 胃间质瘤合并甲型血友病患者采用补充凝血因子Ⅷ(FⅧ)为主的替代疗法,辅以冷沉淀及新鲜冰冻血浆(FFP),最大程度降低出血风险。选择恰当手术方式,配合术后内科治疗。结果 围手术期未出现任何出血并发症,FⅧ水平达到要求标准。肿瘤切除完整、干净,术后免疫组化证实为胃间质瘤。结论 采用FⅧ、冷沉淀、FFP纠正内源性凝血障碍的方法是合理有效的,但时间、剂量、方式必须严格限制。以手术为主、化疗为辅的巨大胃间质瘤综合治疗疗效较好。
甲型血友病;凝血因子Ⅷ;胃间质瘤;替代疗法;围手术期
巨大胃间质瘤合并甲型血友病患者临床上罕见,其手术方式、术后处理及手术相关并发症的防治等也是临床治疗的难点,作者结合所治1例巨大胃间质瘤合并甲型血友病患者的临床资料,对该类患者的诊治进行分析,现报道如下。
1 资料与方法
1.1 病史资料 患者,男性,25岁,体质量 62 kg,4 a前因饮酒后出现上消化道出血导致失血性休克,住院期间检测凝血因子Ⅷ(FⅧ)减少,诊断为甲型血友病。6 d前进食后出现腹痛,无呕血、黑便,CT检查发现腹腔巨大肿物,遂就诊。查体:中上腹可及明显包块,约10 cm×10 cm大小,边界不清,活动度差。PT:13.8 s,APTT:39.1 s,TT:14.2 s,FⅧ 5%。彩超、胃镜、CT 均提示腹腔巨大软组织占位性病变,胃腔明显受压、变窄,对后方胰腺有挤压,但尚有分界。诊断结果:腹腔巨大肿物、甲型血友病。
1.2 围手术期处理及手术方法 采用补充FⅧ为主的替代疗法,辅以冷沉淀及新鲜冰冻血浆(FFP)。所有给药方式均为静脉滴注,术前1天及术晨分别给予FⅧ2 000 IU,FⅧ、冷沉淀、FFP所需剂量见表1。

表1 围手术期的替代疗法剂量
手术方法采用全胃切除+部分横结肠切除,食管空肠Roux-Y吻合,周围肿大淋巴结切除。
2 结果
2.1 围手术期主要凝血指标 见表2。
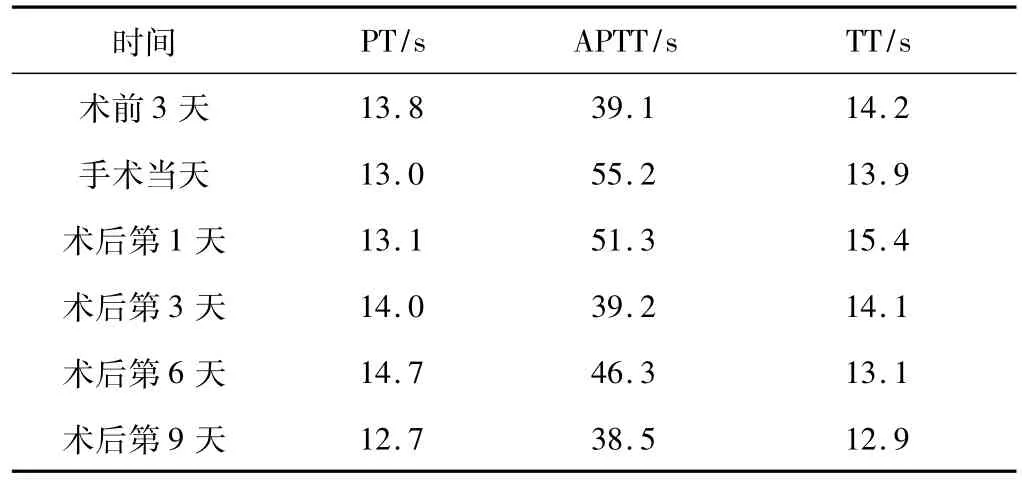
表2 患者围手术期主要凝血化验指标
2.2 术后病理 肿物16.8 cm×8 cm×6 cm,胃壁肌层大片凝血,周围见肉芽、纤维组织包绕,含铁血黄素沉着。免疫组化:CD117(+),平滑肌肌动蛋白SMA(-),结蛋白 Desmin(-),CD34(+),酸性蛋白 S100(+)。诊断:胃间质瘤,周围淋巴结反应性增生。
3 讨论
3.1 甲型血友病诊断及凝血因子替代疗法 甲型血友病是一种X染色体隐性遗传病,主要是由于FⅧ缺乏或功能异常导致内源性凝血机制障碍,其占所有血友病患者的79.8%[1]。血友病的严重程度和FⅧ水平相关,当FⅧ水平低于正常值的2%时会有严重出血,2% ~5%中度出血,5% ~30%出血较轻微。本例患者术前FⅧ水平为5%,为中度出血,围手术期干预至关重要。在临床检验中,甲型血友病患者APTT延长,而PT正常,但APTT延长不能鉴别甲型血友病和乙型血友病(主要为FⅨ缺乏)。此外,由vWF因子缺乏导致的血管性血友病(vWD)和获得性血友病(AH)需与甲型血友病鉴别(表3)。
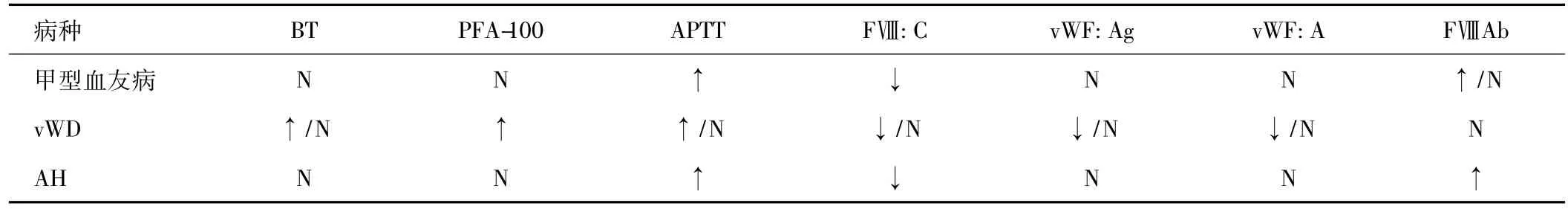
表3 甲型血友病的鉴别诊断实验
目前,替代治疗是惟一能有效治疗甲型血友病患者出血的方法[2]。对于长期输注FⅧ的血友病患者,80%体内会产生FⅧ抑制物。也有患者术前检查FⅧ抑制物阴性,在术后第1次出现抑制物的报道,而这在没有大量FⅧ储备或其他准备措施的情况下是危险的。FⅧ抑制物会干扰有效的替代治疗,但幸运的是一旦患者停用FⅧ,许多人的FⅧ抑制物会自然消退[3]。此患者仅在4 a前输注过少量FⅧ,现体内FⅧ抑制物产生可能性较低,加之平素体质较好,术后无明显出血并发症,替代治疗收到了良好的效果。
3.2 以替代疗法为主的围手术期处理 在无FⅧ抑制物时,每输注1 u·kg-1体质量的FⅧ可使体内FⅧ水平提高2%,FⅧ在体内半衰期约8~12 h,需要每8~12 h输注1次[4]。计算公式:每次所需FⅧ制品的单位(u)=患者体质量(kg)×(欲达FⅧ止血水平-实测患者FⅧ水平)×0.5。对于本例患者,行全胃+部分横结肠切除术,手术创伤较大,根据中华血友病论坛专家共识及相关文献[5],制定围手术期使用剂量及方法,因FⅧ计算所需剂量非整数当量,临床操作中实用性不强,作者在治疗过程中辅以冷沉淀及FFP,200 mL FFP制备的为1个包装单位(含80~100 IU),容积20~30 mL,其中含FⅧ≥80 IU、纤维蛋白原≥200 mg、纤维蛋白>60 mg以及其他各种免疫球蛋白[6]。FFP含有全血中所有凝血因子,200 mL血袋中含FⅧ 200 IU、纤维蛋白原 400 mg、通常 10~15 mL·kg-1可使血浆凝血因子活性增加30%。由于多数凝血因子活性提高25%~30%即可达到止血作用,故FFP输注剂量不宜过大,首次量为10 mL·kg-1,维持量减半[7]。在治疗过程中,正氮平衡状态下,FFP配合白蛋白可显著提高血浆胶体渗透压及总蛋白含量,防止吻合口瘘。结果证明,围手术期检测FⅧ符合规定水平,APTT缓慢下降,未出现出血并发症,收到了满意的效果。
3.3 胃间质瘤免疫表型及良恶性判断 胃肠间质瘤是一种间叶源性肿瘤,主要发于胃(60% ~70%)、小肠(20% ~30%)、结直肠(5%)等器官。Hirota等[8]发现,C-kit基因以酪氨酸激酶(CD117)形式表达,外显子11发生突变,与干细胞因子结合后,细胞增殖、分化功能丧失,最终导致肿瘤。胃间质瘤细胞形态多为梭形细胞型(70%)和上皮样细胞型(20%),混合型最少(10%)。免疫组织化学对于GST鉴别诊断至关重要[9],绝大多数胃间质瘤中kit蛋白产物(CD117)和跨膜糖蛋白(CD34)呈阳性表达。进一步研究发现,免疫表型结蛋白(Desimin)多为阴性,平滑肌肌动蛋白(SMA)阴性或灶性阳性,S-100蛋白常为阴性或局部弱阳性,电子显微镜发现不显示典型的肌性和神经性的特点。临床上,胃间质瘤主要与平滑肌瘤相鉴别(表4)。
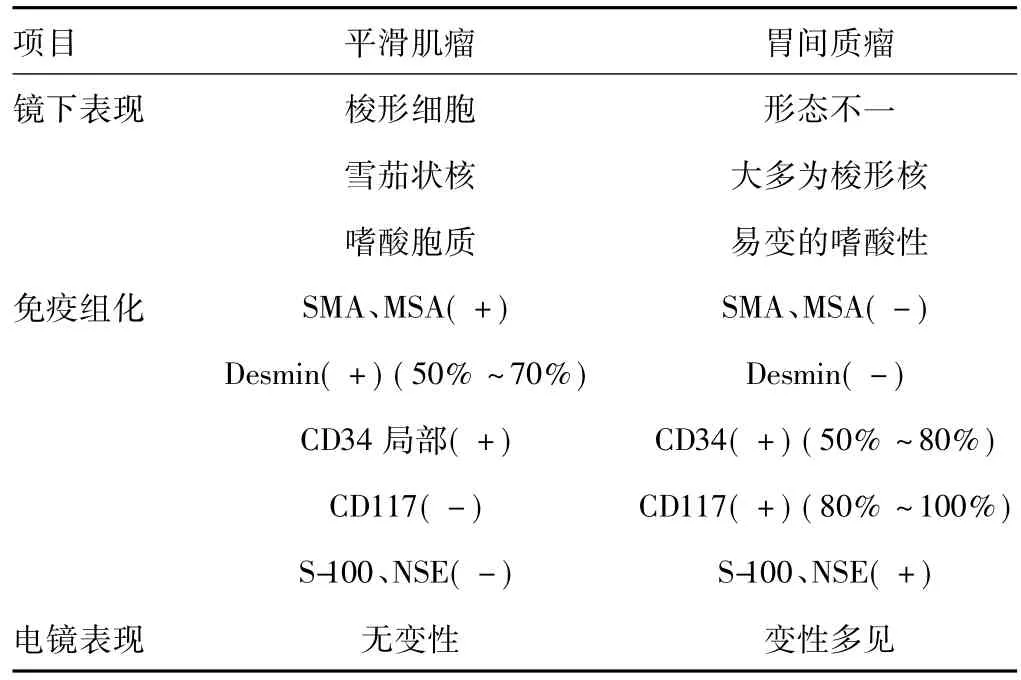
表4 胃间质瘤与平滑肌瘤形态学比较
胃间质瘤恶性风险评估主要依据肿瘤大小和核分裂相,美国国立卫生院2002年公布评估标准[10],良性:T≤2 cm,核分裂相≤5个/50 HPF;交界性:T>2 cm而≤5 cm,核分裂相≤5个/50 HPF;恶性:T>5 cm,核分裂相>5个/50 HPF。掌握评估标准对于手术方法、手术范围的选择,术后治疗方法的确定和患者预后的判断都是十分重要的。
3.4 手术方式的选择与内科辅助治疗 对于肿瘤 <5 cm、肿瘤局限或破溃可能性不大的患者,建议首选胃镜定位腹腔镜胃间质瘤切除或楔形切除术,可获得满意的效果。而 >5 cm的中高风险度的胃间质瘤,胃大部切除及全胃切除应用广泛,但必须保持切缘大于肿瘤2 cm,局部淋巴结肿大应一并切除,但不推荐常规淋巴结区域清扫[11]。本例患者肿瘤>16 cm,且与部分横结肠及胰腺粘连,行全胃切除+部分横结肠切除+周围肿大淋巴结切除术,手术方法选择正确,病理免疫组化CD117(+)、CD34(+),证实为胃间质瘤,由于其有较高复发机率,术后必须辅以相关内科治疗。
甲璜酸伊马替尼是酪氨酸激酶抑制剂,能够靶向阻断C-kit介导的下游信号转导,抑制肿瘤生长。研究表明,伊马替尼400 mg·d-1,对所有大小的肿瘤均能有效提高无复发生存率,较大的肿瘤(>10 cm)更为明显,但未观察到总体生存率的提高[12]。伊马替尼起效一般在用药后4~6个月,一般在连续用药2 a后停药,对于肿瘤复发可加大剂量至600 mg·d-1或改为二线用药舒尼替尼,该药作用于多靶点,65%伊马替尼耐药患者可因此获益。
巨大胃间质瘤合并甲型血友病的病例,在临床上是较少见的。在围手术期替代疗法的应用中,正确及恰当使用FⅧ、冷沉淀、FFP等血液制品,是保证手术顺利进行和降低并发症的关键。本文仅对此方面进行初步探讨。手术辅以酪氨酸激酶抑制药物,可最大程度提高疗效及改善预后。
[1]Roberts HR,Hoffman M,Beutler E,et al.Williams Hematology[M].6 th ed.New York:McGraw Hill Companies,2001:1639 -1657.
[2]Pruthi RK,Mathew P,Valentino LA,et al.Haemostatic efficacy and safety of bolus and continuous infusion of recombinant factor VIIa are comparable in haemophilia patients with inhibitors undergoing major surgery.Results from an open-label,randomized,multicenter trial[J].Thromb Haemost,2007 ,98(4):726 - 732.
[3]Morfini M,Haya S,Tagariello G,et al.European study on orthopaedic status of haemophilia patients with inhibitors[J].Haemophilia,2007,13(5):606 -612.
[4]Ghosh K,Ji jina F,Sh et ty S,et al.First time development of inhibitor in haemophilia patients during the postoperative period[J].Haemophilia,2002,8(6):776 -780.
[5]丁秋兰,王学峰,王鸿利,等.血友病诊断和治疗的专家共识[J].临床血液学杂志,2010,23(1):49-53.
[6]John PG,John F,John NL,et al.Wintrobes Clinical Hematology[M].11 th ed.Philadelphia:Lippincott Williams & Wilkins,2004:1620-1658.
[7]Thankachen R,George B,Shukla V,et al.Aortic and mitral valve replacement in a patient with hemophilia B[J].Asian Cardiovasc Thorac Ann,2007,15(6):526 -527.
[8]Hirota S,Isozaki K,Moriyama Y,et al.Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors[J].Science,1998,279(5350):577 -580.
[9]Liegl B,Hornick JL,Lazar AJ.Contemporary pathology of gastrointestinal stromal tumors[J].Hematol Oncol Clin North Am,2009,23(1):49-68.
[10]Miettinen M,Lasota J.Gastrointestinal stromal tumors:review on morphology,molecular pathology,prognosis,and differential diagnosis[J].Arch Pathol Lab Med,2006,130(10):1466 -1478.
[11]Stamatakos M,Douzinas E,Stefanaki C,et al.Gastrointestinal stromal tumor[J].World J Surg Oncol,2009,7:61.
[12]Dematteo RP,Ballman KV,Antonescu CR,et al.Adjuvant imatinib mesylate after resection of localised,primary gastrointestinal stromal tumour:a randomised,double-blind,placebo-controlled trial[J].Lancet,2009,373(9669):1097 -1104.
The Treatment Method of Huge Gastric Stromal Tumor with Hemophilia A During Peri-operative Period
Dai Peng1,Dong Yonghong1,Xu Jun1,Zhang Hongyi2
(1.Department of General Surgery,Shanxi Provincial People’s Hospital,Taiyuan 030012,China;2.Guxian People’s Hospital,Linfen 042400,China)
Objective To investigate the treatment method of huge gastric stromal tumor with hemophilia A during peroperative period.Methods The patient with huge gastric stromal tumor and hemophilia A received the substitutive therapy dominated by supplying blood coagulation factorⅧ(FⅧ),in addition with cryoprecipitation and fresh frozen plasma(FFP),and the risk of bleeding was decreased maximally.The appropriate operative method andmedical therapy were used according to the tumor.Results No bleeding complications occurred during peroperative period,the level of FⅧ was up to the standard requirement.Tumor resection was complete and clear,immunohistochemistry after operation confirmed gastric stromal tumor.Conclusion The method of supplying FⅧ,cryoprecipitation and FFP to correct endogenous coagulation disorders is reasonable and effective,but the timing,dose,injection way must be restricted strictly.The comprehensive therapy dominated by operation and adjuvant chemotherapy is effective for huge gastric stromal tumor.
hemophilia A;blood coagulation factorⅧ;gastric stromal tumor;substitutive therapy;peroperative period
R735.2;R544.1
A
1673-5412(2012)04-0316-04
2011-03-15)
戴鹏(1980-),男,硕士,主治医师,主要从事肝胆胃肠外科工作。E-mail:rainnyfall@sina.com
徐钧(1967-),男,博士,教授,主任医师,主要从事肝脏外科及微创外科研究。E-mail:junxuty@163.com
