超/亚临界CO2中邻甲酚羧基化合成邻甲基水杨酸
2012-09-09徐明仙俞景译林春绵
张 平,徐明仙,俞景译,林春绵
(1浙江工业大学生物与环境工程学院,浙江 杭州 310014;2杭州职业技术学院临江学院,浙江 杭州 310018)
超/亚临界CO2中邻甲酚羧基化合成邻甲基水杨酸
张 平1,徐明仙2,俞景译1,林春绵1
(1浙江工业大学生物与环境工程学院,浙江 杭州 310014;2杭州职业技术学院临江学院,浙江 杭州 310018)
在超/亚临界CO2中合成邻甲基水杨酸,对探索其绿色合成和CO2的资源化利用有重要意义。本实验以邻甲酚为原料,考察了无水K2CO3、无水Na2CO3等催化剂的活性,选取催化效果最好的无水K2CO3在超/亚临界CO2中一步法直接催化合成邻甲基水杨酸。在反应时间1~6 h、催化剂相对投加量nK2CO3/nO-Cresol为0.05~1.25、反应温度130~270 ℃、反应压力4~14 MPa的条件下对邻甲酚在超/亚临界CO2中的羧基化反应进行了研究。结果表明:邻甲酚的转化率与产物收率随反应时间的延长均出现先增加的趋势,不同的是转化率最后趋于稳定,产物收率则略有减少;邻甲酚的转化率与产物收率随催化剂相对投加量的增加先快速增加然后趋缓,随反应温度、反应压力的增加先增加后减少。较佳的实验条件为:反应时间 3 h、催化剂相对投加量0.5、反应温度190 ℃、反应压力8 MPa,此时,邻甲酚转化率可达19.7%,邻甲基水杨酸收率可达17.5%。此外,提出了超/亚临界CO2中邻甲酚羧基化反应可能存在的机理。
超/亚临界CO2;邻甲酚;邻甲基水杨酸;一步法合成;无水K2CO3
由于化石燃料的大量使用,CO2气体排放量急剧增加,导致了全球气候变暖,并威胁了人类的生存。但是由于CO2无毒、不燃、价格低廉,在有机合成领域又有着广泛的应用[1-2],因此,将温室气体CO2应用在有机合成中无疑具有重大的意义,也为工业上以CO2为原料合成邻甲基水杨酸提供了一种新思路。
邻甲基水杨酸(3-Methylsalicylic acid)又名3-甲基-2-羟基苯甲酸,是一种重要的染料和医药中间体,广泛应用于染料和医药工业。邻甲基水杨酸的合成方法有Kolbe-Schmitt法、草酰氯法、苯乙酮法、Mannich reaction法等[3-4],其中以Kolbe-Schmitt法(又称酚酸合成法)应用最为广泛。这是由有机酚类化合物与 CO2发生亲电取代而在芳环上引入羧基的一种方法,具体可分为两步,即碱金属酚盐的制备与羧基化。Kolbe-Schmitt法又可分为气固相合成法与溶剂合成法。据文献所述[5-7],气固相合成法的产物收率可达80%,溶剂合成法的产物收率可达88%。
伴随着绿色化学理念的提出与深入,邻甲基水杨酸的合成被提出了更高的要求。因此,环保新型的邻甲基水杨酸合成方法值得探索。在绿色环保领域,超/亚临界流体因具有良好的溶解能力和传递性能,在萃取分离[8]、超/亚临界水氧化[9-10]、化学反应[11]、材料制备[12]等领域都得到了广泛的重视。而超/亚临界化学反应也因具有反应速度快、产物易于分离等特点备受学者们的青睐。目前,CO2作为介质被广泛应用于超/亚临界有机合成反应,在反应中,其既可作为反应物,又可作反应溶剂[13]。
鉴于超/亚临界CO2流体独特的优势,将其应用在邻甲基水杨酸的现有合成中,有着非常大的吸引力。另一方面,简化现有的Kolbe-Schmitt合成法,实现一步法直接合成,又是对现有方法的改进。基于以上两点,在超/亚临界CO2中进行邻甲基水杨酸的直接合成研究值得人们关注。目前,此课题研究尚未见报道。而其它酚酸在超/亚临界CO2中的直接合成研究也不多见,且主要是针对水杨酸,如Iijima、徐明仙和胡斯翰等[14-17]探讨了在超临界CO2中苯酚直接羧基化反应合成水杨酸的实验研究。本实验以邻甲酚为原料,选用合适的催化剂,在超/亚临界CO2中采用一步法直接合成邻甲基水杨酸,为CO2的资源化利用和酚酸类有机物的绿色合成开展有益的实验探索。
1 实验部分
1.1 实验材料
本实验所用的材料:邻甲酚为化学纯(98.0%);邻甲基水杨酸为分析纯(99.0%);CO2为干冰级(99.5%);甲醇为色谱纯(99.8%);无水 K2CO3为分析纯(99.0%);NaOH为分析纯(96.0%);H3PO4为分析纯(85.0%)。
1.2 实验装置
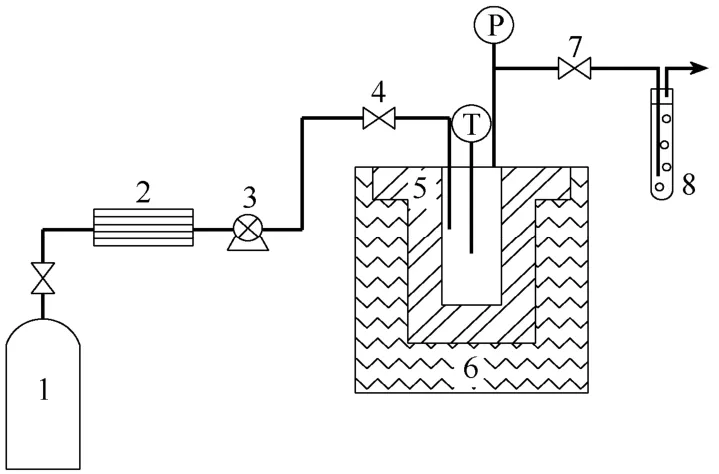
图1 实验装置图
本实验装置如图1所示。检验装置气密性后,首先在高压反应釜(FYXL-0.5型,容积50 mL,设计压力33 MPa,设计温度773 K,大连通产高压釜容器制造有限公司)内加入一定量的邻甲酚与催化剂,密封后通入一定量的CO2置换反应釜内空气,重复置换4次,然后加热至实验要求的温度。温度由接触调压器(TDGC2J-2型,上海人民企业有限公司)和数控电热套(TM-500型,温度控制范围273~723 K,偏差为±1 ℃)控制,并由数显指示仪(XMT型,PID控制,精度1.0级,久盛智能仪表厂)显示。待温度稳定后,通过微型柱塞泵(J-W-2型,杭州之江科学仪器厂)打入CO2至设定的反应压力值,并开始计时。随着反应的进行,压力略有下降,启动柱塞泵,补充CO2以维持压力稳定。系统压力由精密压力表指示(量程为0~40 MPa,精度为0.4级,上海自动化仪表股份有限公司)。反应一定时间后,将反应釜快速冷却,打开截止阀 7放气,并用去离子水吸收。最后打开反应釜,用加入了一定量NaOH的去离子水,将釜内固相产物以邻甲基水杨酸钠(易溶于水)的形式洗出(邻甲基水杨酸微溶于水,不易洗出),洗出液与气相吸收液合并定量后分析。
1.3 分析方法
本实验采用 JASCO LC-2000高效液相色谱仪(JASCO LC-2000,日本分光株式会社)对反应后产物进行定量分析。色谱仪配备循环泵、UV-2075可调紫外波长检测器、U6K手动进样器。实验分析条件如下:色谱柱为NovapakC18W柱(250 mm×6 mm),柱温为室温,流动相为甲醇与水(V甲醇∶V水=75∶25),以磷酸调节pH值至3.21,流量为0.6 mL/min,检测波长为230 nm。
邻甲酚转化率计算方法如式(1)。

邻甲基水杨酸收率计算方法如式(2)。

式中,X为邻甲酚的转化率;n1为邻甲酚投加量;n2为反应后邻甲酚剩余量;Y为产物的收率;n3为反应后邻甲基水杨酸产生量。
2 结果与讨论
2.1 催化剂的选择
一般认为,在用Kolbe-Schmitt法合成酚酸的工业化过程中,若有水存在,会阻碍反应的进行[3,17]。另外,Iijima等[14-15]认为含结晶水的AlBr3在催化苯酚直接合成水杨酸的过程中效果较差[14]。因此,本实验选取无水 K2CO3、无水 Na2CO3等催化剂,考察其对超/亚临界CO2中邻甲酚羧基化反应的影响,结果见表1。
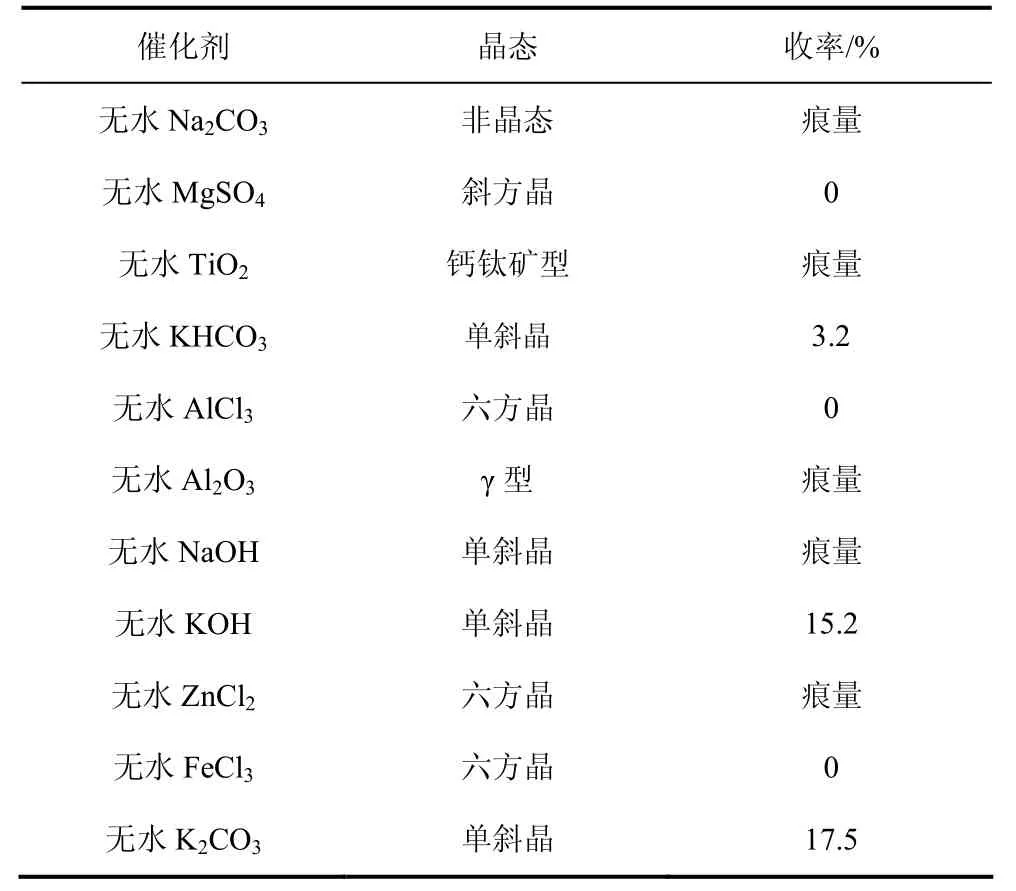
表1 不同催化剂对邻甲酚羧基化反应的影响
Iijima与胡斯翰等[15,17]曾发现以 CaCO3、BaCO3、MgCO3为代表的碱土金属化合物对苯酚直接羧基化反应的催化效果较差。本实验在碱土金属化合物中选取了MgSO4作催化剂,考察其对邻甲酚羧基化反应的催化效果,结果发现,MgSO4毫无催化活性。Li等[18]曾在研究中证实 TiO2对苯酚直接羧基化反应有较好的催化效果(未明确晶态),但在本实验中,TiO2对邻甲酚羧基化反应的催化效果较差。在相关文献中,Iijima等[14]也曾表示Lewis酸,如 AlCl3、CuCl2、ZnCl2、FeCl3等,对苯酚直接羧基化反应的催化效果尚可(未明确晶态),但在本实验中,选用的 Lewis酸,包括 AlCl3、γ-Al2O3、ZnCl2、FeCl3,对邻甲酚羧基化反应的催化效果并不理想。另外,胡斯翰[17]曾提出各种碱与碱金属碳酸盐对苯酚直接羧基化反应的催化效果不同,其中,NaOH、Na2CO3与KOH对反应的催化效果较差,而KHCO3与 K2CO3则具有较好的催化效果(未明确晶态)。他认为在苯酚直接羧基化过程中,KHCO3在加热的条件下会分解成K2CO3、CO2与H2O,H2O的存在阻碍了苯酚羧基化反应的进行,致使 KHCO3比K2CO3的催化效果差;碱与CO2反应生成碳酸盐与水,不利于羧基化反应的进行。根据本实验结果,发现NaOH与Na2CO3对邻甲酚羧基化反应的催化效果较差,KHCO3与 K2CO3对反应的催化效果较好,这与先前胡斯翰[17]的实验研究一致;值得一提的是,本实验中KOH表现出了仅次于K2CO3的催化效果,这与胡斯翰[17]的研究有所不同。根据表1,本实验催化效果最好的是无水K2CO3。
2.2 催化剂相对投加量的影响
在190 ℃、8 MPa、3 h、无水K2CO3作催化剂的条件下,考察无水K2CO3的相对投加量(与邻甲酚投加量的摩尔比)对邻甲酚羧基化反应的影响,结果见图2。
由图2可知,当催化剂相对投加量低于0.5时,邻甲酚转化率与邻甲基水杨酸收率随催化剂相对投加量的增加迅速增加;在催化剂相对投加量为 0.5时,邻甲酚转化率与邻甲基水杨酸收率分别达到较大值19.7%、17.5%;随后继续增加催化剂相对投加量,邻甲酚转化率与邻甲基水杨酸收率增加缓慢;在催化剂相对投加量为1.25时,邻甲酚转化率与邻甲基水杨酸收率分别达到21.0%、18.6%。在此实验条件下,0.5是较合适的催化剂相对投加量。
2.3 反应时间的影响
在190 ℃、8 MPa、无水K2CO3作催化剂且相对投加量为0.5的条件下,考察反应时间对实验的影响,见图3。
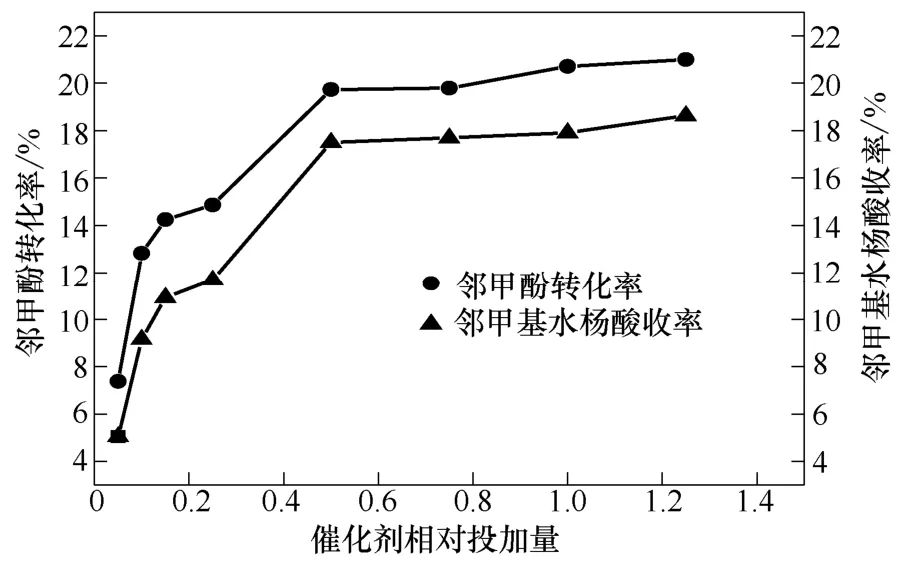
图2 催化剂相对投加量对实验的影响
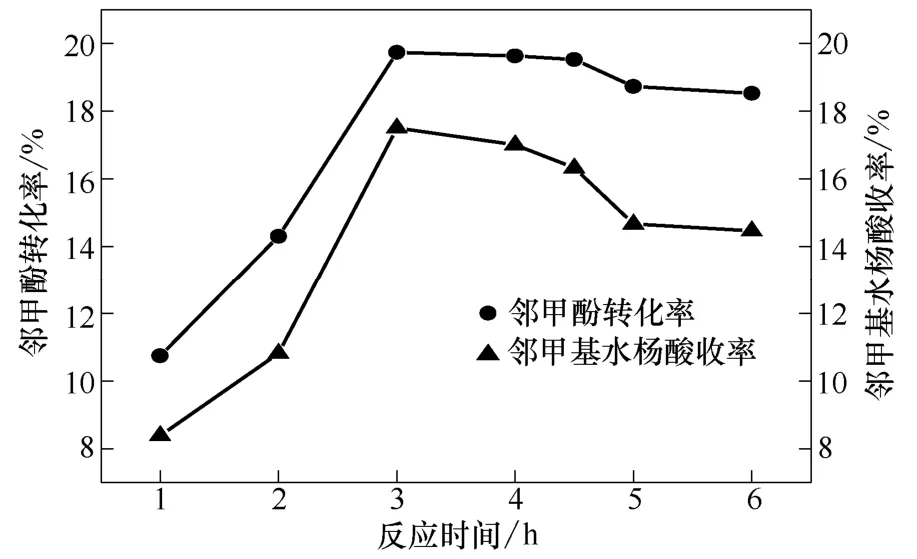
图3 反应时间对实验的影响
由图3可知,当反应时间低于3 h时,邻甲酚转化率与邻甲基水杨酸收率随反应时间延长迅速增加;当反应时间为3 h时,邻甲酚转化率与邻甲基水杨酸收率分别达最大值19.7%、17.5%;随着反应时间的进一步延长,邻甲酚转化率和产物的收率基本趋于稳定且有所下降。上述规律与谭明臣和徐明仙等[4-16]曾发现的反应时间对邻甲酚钠与苯酚羧基化反应的影响规律一致。在反应过程中可能是由于釜内产物间发生了缩聚反应,发现有少量的树脂产物生成,这使得邻甲基水杨酸的收率呈略有下降的趋势。但反应后期邻甲酚转化率也有所降低,尚不能给出合理的解释,有待进一步研究。在此实验条件下,3 h是较合适的反应时间。
2.4 反应温度的影响
在8 MPa、3 h、无水K2CO3作催化剂且相对投加量为0.5的条件下,考察温度对实验的影响,见图4。
实验结果表明在温度 130~190 ℃范围内,随着温度的升高,邻甲酚的转化率与邻甲基水杨酸的收率迅速增加;在反应温度为190 ℃处,邻甲酚的转化率与邻甲基水杨酸的收率分别达到了最大值;随着温度的进一步升高,邻甲酚的转化率与邻甲基水杨酸的收率反而下降。反应是热力学平衡控制的可逆反应[19],温度较低时,反应速率较慢;温度较高时(200 ℃以上),邻位酚酸受热易发生脱羧反应[20],又会使正反应生成的邻甲基水杨酸重新脱掉羧基生成邻甲酚,这也进一步证明了邻甲酚的羧基化反应是可逆反应。上述实验规律与Iijima和徐明仙等[14,16]曾提出的反应温度对苯酚直接羧基化反应的影响规律一致。在此实验条件下,190 ℃是较合适的反应温度。
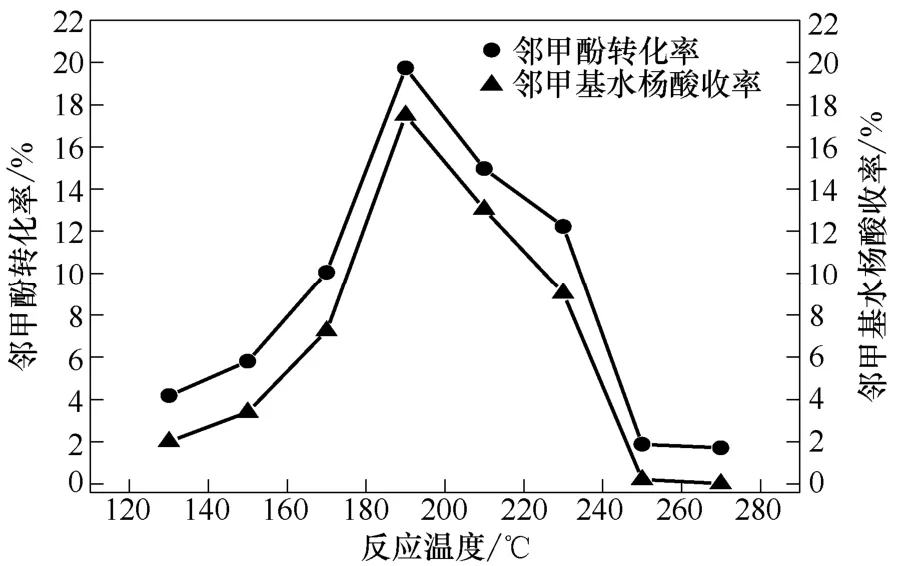
图4 反应温度对实验的影响
2.5 反应压力的影响
在190 ℃、3 h、无水K2CO3作催化剂且相对投加量为0.5的条件下,考察压力对实验的影响,结果见图5。
当压力在4~8 MPa范围内,随着压力的增加,邻甲酚的转化率与邻甲基水杨酸的收率迅速增加。尤其在8 MPa处,邻甲酚的转化率与邻甲基水杨酸的收率分别达最大值;随后,当压力继续增加时,邻甲酚的转化率与收率反而逐渐下降。反应压力较低时,CO2的密度较低,同时邻甲酚在CO2中的溶解度也不高,对反应不利;随着反应压力的提高,CO2密度也随之增大,阻碍了催化剂与邻甲酚的相互接触,亦不利于反应的进行。这可能是导致出现图5中结果的原因之一,但对其影响如此之大的其它原因有待进一步的研究。上述实验规律与 Iijima和徐明仙等[15-16]曾表述的反应压力对苯酚直接羧基化反应的影响规律一致。
2.6 反应机理的探讨
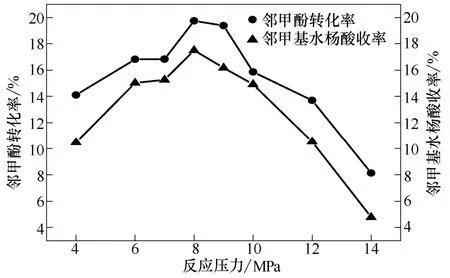
图5 反应压力对实验的影响
Iijima和胡斯翰等[15,17]曾研究过以K2CO3为催化剂在超临界CO2中直接催化苯酚合成水杨酸的反应机理。结合本实验结果的分析,超/亚临界 CO2中邻甲酚直接羧基化反应可能存在如下机理。当反应开始时,通过邻甲酚氧原子与Lewis酸中心在固体催化剂表面发生相互作用,邻甲酚吸附到催化剂上。通过相互作用,使得邻甲酚上羟基的H原子转移,在固体催化剂表面上形成不饱和的O2-中心位,产生邻甲基苯氧阴离子。邻甲基苯氧阴离子基团的形成和H+的释放同时发生。
进而,不饱和的催化剂表面氧原子提供一个电荷给CO2的碳原子,同时CO2的氧原子提供一个电荷给邻甲基苯氧基团的阳离子。同时,吸附的CO2非常不稳定,阳离子附近的强酸会取代阳离子附近的碱位而吸附CO2分子中的氧原子。
邻近CO2碳原子的邻甲基苯氧碳原子,能将邻甲基苯氧基团转移到CO2碳原子上,同时在阳离子和CO2的一个氧原子之间形成键。最后,释放的氢原子重新传递给羧基就形成了邻甲基水杨酸。邻甲酚羧基化反应可能存在的机理见图6。
3 结 论
通过探讨不同因素对实验的影响,发现无水K2CO3在邻甲酚羧基化反应过程中具有最好的催化效果;邻甲酚的转化率与产物收率随反应时间、催化剂相对投加量、反应温度及反应压力的变化呈现相应的规律。邻甲基水杨酸较佳的合成条件为:反应时间3 h,催化剂相对投加量0.5,反应温度190℃,反应压力8 MPa。通过对反应机理的研究表明,被吸附在催化剂表面的邻甲酚羟基上的H原子首先转移,产生邻甲基苯氧阴离子。进而,邻近CO2碳原子的邻甲基苯氧碳原子,将邻甲基苯氧基团转移到CO2碳原子上,同时在阳离子和CO2的一个氧原子之间形成键。最后,释放的氢原子重新传递给羧基就形成了邻甲基水杨酸。

图6 邻甲酚羧基化反应机理
对于反应过程中发生的副反应及生成的副产物,目前仍未可知,有待于进一步研究。
[1] Mette Mikkelsen,Mikkel Jørgensen,Frederik C Krebs.The teraton challenge.A review of fixation and transformation of carbon dioxide[J].Energy & Environmental Science,2010,3(1):43-81.
[2] Sakakura T,Cho J C,Yasuda H.Transformation of carbon dioxide[J].Chemical Reviews,2007,107(6):2365-2387.
[3] 倪祥根.邻甲基水杨酸的合成研究[D].杭州:浙江大学,2002.
[4] 谭明臣.超临界法合成酚酸的探究[D].济南:山东轻工业学院,2008.
[5] 王煜华,章德祥,吕仙荣,等.邻甲基水杨酸的合成研究[J].浙江化工,1990,21(2):1-3.
[6] 黄宁,孟明扬.溶剂法生产邻甲基水杨酸[J].染料工业,1995,32(5):30-32.
[7] 孟明扬,王景国,赵秀英,等.溶剂法合成邻甲基水杨酸[J].染料与染色,1988(4):21-24.
[8] 文震,党志,余德顺,等.超临界CO2流体萃取重金属的研究进展[J].化学进展,2001,13(4):310-314.
[9] 王亮,王树众,张钦明,等.超临界水氧化处理含油废水的实验研究[J].环境污染与防治,2005,27(7):546-549.
[10] 林春绵,徐明仙.超临界水氧化法降解葡萄糖的研究[J].化学反应工程与工艺,2001,17(1):79-83.
[11] 李国平,江涣峰,李金恒.超(近)临界流体中的催化加氢反应[J].化学进展,2001,13(6):455-460.
[12] 贺文智,姜兆华,索全伶.超临界流体沉淀技术制备超细粒子研究[J].化学进展,2003,15(5):361-366.
[13] 胡斯翰,徐明仙,林春绵.超临界CO2在有机合成中的资源化利用[J].化工进展,2010,29(6):984-990.
[14] Iijima Takayuki, Yamaguchi Tatsuaki.Efficient regioselective carboxylation of phenol to salicylic acid with supercritical CO2in the presence of aluminium bromide[J].Journal of Molecular Catalysis A:Chemical,2008,295(1-2):52-56.
[15] Iijima Takayuki,Yamaguchi Tatsuaki.K2CO3-cayalyzed direct synthesis of salicylic acid from phenol and supercritical CO2[J].Applied Catalysis A:General,2008,345(1):12-17.
[16] 徐明仙,胡斯翰,丁春晓,等.碳酸钾催化苯酚在超临界CO2中合成水杨酸的实验研究[J].高校化学工程学报,2011,25(3):529-532.
[17] 胡斯翰.超临界CO2中水杨酸(钠)的制备研究[D].杭州:浙江工业大学,2010.
[18] Li Zhenhuan,Su Kunmei.The direct reaction between CO2and phenol catalyzed by bifunctional catalyst ZrO2[J].Journal of Molecular Catalysis A:Chemical,2007,277(1-2):180-184.
[19] 高鸿宾.有机化学[M].第4版. 北京:高等教育出版社,2007.
[20] 汪小兰.有机化学[M].第4版. 北京:高等教育出版社,2005.
Experimental study on the synthesis of 3-methyl salicylic acid from carboxylated o-cresol in supercritical or subcritical carbon dioxide
ZHANG Ping1,XU Mingxian2,YU Jingyi1,LIN Chunmian1
(1College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310014,Zhejiang,China;2Hangzhou Vocational and Technical College,Hangzhou 310018,Zhejiang,China)
The synthesis of 3-methyl salicylic acid in supercritical or subcritical carbon dioxide has important meaning for the green synthesis of 3-methyl salicylic acid and resourcization of carbon dioxide. After comparing the catalytic activity of anhydrous potash,anhydrous sodium carbonate and so on,anhydrous potash was chosen as the best catalyst to synthesize 3-methyl salicylic acid directly from o-cresol by one-pot method in supercritical or subcritical carbon dioxide. At the condition of reaction time from 1—6 hours,catalyst´s relative dosage(nK2CO3/ nO-Cresol)from 0.05—1.25,reaction temperature from 130—270 ℃ and reaction pressure from 4—10MPa,o-cresol’s carboxylic reaction was studied in supercritical or subcritical carbon dioxide. The result showed that the conversion of o-cresol and the yield of 3-methyl salicylic acid both increased at first with the increase of time,and then the conversion became stable,but the yield decreased slightly in the end. The conversion and the yield increased rapidly at first and then increased slowly with the increase of catalyst´s relatively dosage. The conversion and the yield increased rapidly at first but then decreased with the increase of reaction pressure or reaction temperature. The conversion is about 19.7% and the yield is about 17.5%under the optimal condition that reaction time was 3 hours,catalyst´s relatively dosage was 0.5,reaction temperature was 190 ℃ and reaction pressure was 8 MPa. In addition,a possible reaction mechanism was proposed.
supercritical or subcritical carbon dioxide;o-cresol;3-methyl salicylic acid;one-pot synthesis;anhydrous potash
TQ 460.3
:A
:1000-6613(2012)05-1137-06
2011-11-24;修改稿日期;2012-01-12。
浙江省自然科学基金(Y5110158)及浙江省教育厅项目(Y200805324)。
张平(1986—),男,硕士研究生。联系人:林春绵,教授。E-mail lcm@zjut.edu.cn。
