吸附剂特性对CO2/CH4吸附分离的影响分析
2012-09-09李云东易红宏唐晓龙李芬容
李云东,易红宏,唐晓龙,李芬容,何 丹
(昆明理工大学环境科学与工程学院,云南 昆明 650093)
吸附剂特性对CO2/CH4吸附分离的影响分析
李云东,易红宏,唐晓龙,李芬容,何 丹
(昆明理工大学环境科学与工程学院,云南 昆明 650093)
用于 CO2/CH4二元混合体系吸附分离的吸附剂种类较多,效果参差不齐,而吸附剂的各种特性是影响分离效果的主要原因。本文从吸附剂特性出发,总结了孔结构、可交换阳离子、表面化学以及吸附剂湿度 4个因素对吸附分离效果的影响,并解释了造成各种影响的原因。得出结论:中孔有利于该二元体系的分离和胺基嫁接;在吸附剂骨架之外引入合适的可交换阳离子可促进吸附剂与CO2四极矩之间吸引力,提升分离效果;吸附剂的表面羟基也是影响胺基嫁接的重要因素;水分既有利于该体系的吸附分离,又可以促进胺基吸附剂再生。
二氧化碳;甲烷;吸附分离;影响因素
随着环境问题的日益严重以及石化能源的匮乏,如何开发利用H2、CH4等清洁能源以降低能耗,减少污染,已成为当今刻不容缓的任务。与氢能相比,CH4在近期内被广泛应用的可能性更大。此外,CH4是一种长寿命温室气体,虽然在大气中的含量远低于 CO2,但其全球增温潜势(GWP)是 CO2的21倍[1-2],直接排放进入大气会造成严重的温室效应。因此,合理利用CH4不仅可以缓解能源危机,也能够控制温室效应。CH4来源广泛,是天然气、沼气、垃圾填埋气及煤层气的主要成分,常与CO2等共存。不同的来源,其各组分含量差别较大,如表1所示。CO2的共存影响了CH4的燃烧效果,同时对运输管路造成腐蚀。实际上,CO2也是一种重要的资源,许多国家都在研究把CO2作为“潜在碳资源”加以综合利用,其在农产品保鲜、饮料加工、速冻食品、超临界萃取等领域具有重要应用[3-4]。因此,分离CH4/CO2二元混合体系是合理有效利用这两者必不可少的环节。
CH4/CO2分离方法有吸附法、膜分离法、低温分离法、化学转化法等。与其它方法相比较,吸附法具有众多优点[3,6]:①污染小;②脱碳脱水可同时完成;③吸附剂可再生重复使用;④工艺简单、投资少;⑤CO2和CH4易回收。因此在CH4/CO2分离方法中,吸附分离技术受到更多的关注与研究。吸附分离是一种利用吸附剂对不同气体的选择性吸附来使混合气体分开的技术,其基于吸附剂与不同吸附质之间的作用力差异,Yang[5]将吸附作用力分为色散力、静电力和化学键力。此处的静电力包括吸附剂电场与诱导偶极之间的力,电场与偶极之间的力以及场梯度与四极子之间的相互作用力。由表2可知,CO2、CH4的性质差异主要集中于四极距、酸碱性、临界温度以及溶解度,利用这些性质差异可实现该二元体系的分离。在吸附分离技术中,吸附剂的各种特性(如:孔结构、可交换阳离子和表面化学等)是影响分离效果的关键因素,决定着吸附分离成功与否。本文作者主要从孔结构、可交换阳离子、表面化学以及湿度4个方面来总结造成各种吸附剂分离效果差异的原因。

表1 不同来源CO2/CH4体系成分比较[5]

表2 CO2、CH4性质比较[6-7]
1 孔结构对CO2/CH4吸附分离的影响
1.1 孔径大小对CO2/CH4吸附分离的影响
孔径是衡量吸附剂是否适用于特定用途以及评价吸附性能好坏的重要指标。根据国际理论与应用化学协会(IUPAC)的分类,吸附剂的孔被分为微孔(孔径 d<2 nm)、中孔(孔径 2 nm<d<50 nm)和大孔(孔径d>50 nm)。孔径大小直接影响到了吸附剂与目标分子之间的亲和力、位阻以及比表面积。微孔率较高的吸附剂,其比表面积也相应较大[8],吸附量高,较低压力下即可达到吸附饱和;而中孔有利于大分子物质的吸附,并且有利于气体分子在孔道内的液化凝结。
微孔吸附剂的孔径很小,孔内与吸附质分子作用的表面原子更多,在微孔内壁面与壁面所产生的吸附力场发生叠加,吸附力增强,在较低压力下即可达到吸附饱和。对于分子直径相差较大的分子来说,微孔的位阻效应可实现混合气体的分离,这种情况下仅有较小的且形状适宜的分子才可扩散到吸附剂中,如炭化后的Saran的孔入口大小约为6 Å,因此可将异丁烷(动力学直径5.0 Å,可进入微孔)和新戌烷(动力学直径6.2 Å,不可进入微孔)成功分离[5]。但是,CO2(3.3 Å)和 CH4(3.8 Å)分子的动力学直径十分接近,较难利用微孔的位阻效应来分离二者。
对于中孔吸附剂,由于中孔孔径远大于吸附质分子直径,根据开尔文方程,毛细管内液体的饱和蒸气压小于水平液面的饱和蒸气压,气体发生凝聚,产生毛细管凝聚现象。一般认为,在临界温度以下,气体的物理吸附与气体的凝结很相似,被吸附在固体表面上的气体分子具有液体的性质。而在临界温度以上,气体不能够再被液化,离临界温度越远,达到一定吸附量所需的压力越高[9]。由表2可知,CH4的临界温度为190 K,CO2的临界温度为304.3 K,常温条件下,CH4为超临界气体,在吸附剂的微孔内可发生微孔填充,在孔径较大的孔内却不能发生多分子层覆盖以及毛细孔凝聚。而CO2属于亚临界气体,在固体表面可发生单分子层吸附及多分子层覆盖,不仅在微孔内可发生微孔填充,而且在较大孔的孔道内有发生毛细凝聚的可能。吸附剂比表面积是决定超临界气体(CH4)吸附量的关键因素,微孔愈丰富,比表面积愈高[6,8],因此具有丰富微孔的吸附剂有利于超临界气体的吸附。而亚临界气体CO2可在中孔中液化,富中孔的材料有利于这类气体的吸附。所以,当吸附材料具有丰富的中孔结构时,可促进 CO2的吸附,同时也抑制 CH4吸附,吸附分离性能提升。
Nicholson等[10]研究了不同孔径(微孔范围)的狭缝形孔和圆柱形孔对CO2/CH4的分离性能,结果显示,表面能较低的情况下,分离因子随着孔径的增大而增大,两种形状的孔,其孔径影响吸附分离的趋势大致相同。苏伟等[11]研究发现,中孔活性炭较纯微孔活性炭对 CO2/CH4有更好的分离效果。Chen等[12]研究了高压下Zn(BDC)(TED)0.5(BDC为苯二甲酸甲酯,benzenedicarboxylate;TED为3次乙二胺,triethylenediamine)对 CO2/CH4分离性能的影响,得出结论:随着压力的增加,具有较大孔体积的 Zn(BDC)(TED)0.5选择性也随之增强。Pires等[13]比较了Al-PLICs与Zr-PLICs的结构特点以及对CO2/CH4的吸附选择性,结果表明:Zr-PILC的吸附选择性比 Al-PILCs更好,原因之一在于Zr-PILCs具有较多的中孔体积。
1.2 孔径大小对胺基负载改性的影响
由于有机胺与CO2分子之间可发生反应形成较为强烈的化学键[反应如式(1)和式(2)所示],所以有机胺负载改性成为一种十分常用的增加吸附剂选择性的方法。然而,孔径大小对胺负载有着较大的影响,有机胺负载于吸附剂孔内之后,孔体积将会在一定程度上被填充,比表面积和孔容均有不同程度的降低,较大程度依赖于比表面积的物理吸附将会减弱,CO2和CH4物理吸附量随之减小,而CO2化学吸附量与胺基负载量直接相关(表 4)。Xu[14]、Jadhav[15]、Pinto[16]等分别选用β沸石、13X分子筛、黏土PCH(PCH由TEOS和黏土合成)作为胺基负载的载体,实验结果均发现:经有机胺负载之后,虽然吸附选择性明显增加,但这些微孔材料的部分孔道被封闭,孔容和比表面积有较大降低,如表3所示,CH4和CO2吸附量均有较大程度的降低,有机胺含量越大,这种趋势越明显。相对于分子筛、矿物黏土等微孔材料,具有较大孔径的介孔氧化硅、硅胶等可容纳大量的有机胺。Liu等[17-19]选用介孔材料SBA-15作为DIPA(二异丙醇胺)、TEA(三乙醇胺)负载载体,负载后的SBA-15分离性能分别提高16.7倍和7倍。王震等[3-4]用TEA(三乙醇胺)涂渍硅胶,结果与介孔材料类似,随着硅胶上有机胺的涂溃浓度的增大,CO2吸附量随之增加(最大可达改性前的3.9倍),CH4吸附量减小(表4)。

表3 胺基改性前后分子筛的性质变化[14-15]

表4 CH4和CO2在不同浓度TEA改性硅胶上的吸附量[4]
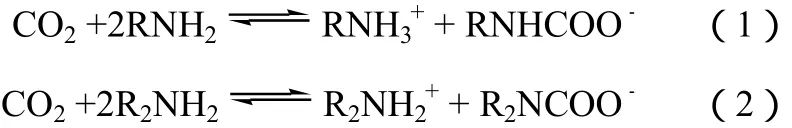
式中,RNH2为伯胺(primary);R2NH为仲胺,二级胺(secondary amine)。
1.3 孔径形状对CO2/CH4吸附分离的影响
除孔径之外,孔的形状也是影响吸附的重要因素,常见的孔形状有狭缝形、圆柱形、球形以及方形等。一般来说,吸附势排列为球形孔>圆柱形孔>狭缝形孔[5],这是由与吸附质作用的表面原子多少而决定的。另外,任何孔径都不可能是理想均匀的,很多固体表面具有复杂的结晶和几何结构以及化学组成,这些都是吸附剂非均匀性(Heterogeneity)的原因。孔的形状以及孔内存在的缺陷直接影响着吸附剂内表面对吸附质的吸附势以及吸附质的扩散。
Nicholson等[10]研究了孔的不同几何形状(狭缝形和圆柱形)对CO2/CH4分离因子的影响,结果显示,狭缝形孔的分离因子略大于圆柱形。马聪聪[20]比较了甲烷在不同尺寸下的方孔、矩形孔和圆柱孔中的吸附量,研究发现:当压力小于 5 MPa时,方孔的吸附量最大,而圆柱孔的吸附量远小于其它两种孔,方孔中的角对吸附有较大影响。
Cu-BTC[1,3,5-苯三甲酸铜(II)]是一种对多种混合气体有良好的吸附分离性能的 MOFs[21-22],分子式为[Cu3(BTC)2(H2O)x]n,与其它MOFs比较,其孔结构较为特殊,具有两类大小不同的孔道,主孔道(large pores)周围围绕着许多小的四面体孔道(side pockets),主孔道的尺寸大小约为 9 Å,四面体形孔的大小约为 5Å,并通过大小为3.5 Å的三角形孔窗与主孔道相连[23-24]。巨正则系综Monte Carlo(GCMC)模拟结果显示,主孔道周围的四面体孔道有助于提高Cu-BTC对CO2/CH4的吸附选择性[25],低压下,四面体孔道对CO2/CH4的分离起到决定性作用[26]。
2 可交换阳离子对CO2/CH4吸附分离的影响
吸附剂骨架之外的可交换阳离子与具有四极子的分子之间有较强的静电作用[27-28],计算如式(3)[5]所示。由表 2可以看出,CO2的四极矩为4.3×10-26esu·cm2,CH4为 0,较大的静电力差异可实现该二元气体的分离。另外,可交换阳离子的位置、尺寸也对分离效果有较大影响[29]。

吸附质可与沸石分子筛之间的晶格氧、骨架的Al和Si以及骨架之外的阳离子之间发生吸附作用。然而,Al和Si原子位于骨架的四面体的中心位置,没有直接暴露,不能与吸附质发生吸附作用,因此,吸附质分子和沸石的相互作用集中于晶格氧和骨架之外的阳离子。当分子筛硅铝比较低时,相对较高的铝含量可使其拥有较多的平衡阳离子,这些阳离子既提升了吸附剂的电场梯度和不均匀性,又与四极分子之间发生较强吸引。Harlick等[30]报道了不同硅/铝比的Y形和ZSM-5分子筛对CO2吸附的研究,发现 CO2的吸附量随着分子筛硅/铝比的降低而增加。Hernández-Huesca[29]、徐晓亮[31]等分别报道了不同硅/铝比的3种天然沸石和不同硅铝比的β沸石的CO2/CH4吸附选择性,结果发现,沸石的硅铝比越小则吸附选择性越好。
一般来说,恰当的离子交换可改变局部电场,提高吸附剂的阳离子密度和电场梯度,从而提高CO2/CH4的分离因子。考虑到阳离子半径的影响,具有较小半径的Li+(0.68 Å)和Na+(0.97 Å)常被选择用于离子交换。Xu等[28]用低硅铝比的β沸石进行 Na+的离子交换,离子交换之后的 β沸石对CO2吸附量得以提高,吸附选择性提高62%。许青[32]讨论了Li+改性对MOF-5的CO2/CH4分离性能的影响,GCMC模拟结果表明:Li+交换后的MOF-5在金属簇以及配体附近出现了较大的负电势梯度,静电贡献从 20%增大到 80%左右,吸附选择性也随着提高。以上的模拟结果已在Bae等[33]的试验中得到验证,Li+可以和MOFs中的羟基发生离子交换,交换后的锂离子和四极矩分子 CO2之间形成较为强烈的相互作用,这也是Li+交换对MOFs CO2/CH4分离性能的首次实验研究报道。而不恰当的离子交换会产生相反的效果,Delgado等[27]使用 NH4+交换 Na-丝光沸石中的 Na+,交换之后的沸石中产生了较多的硅醇羟基,电场与电场梯度均一定程度降低,CO2吸附量和分离效果下降。
化学还原也可以将金属阳离子引入吸附剂,与离子交换不同,化学还原引入阳离子是指金属单质与吸附剂骨架发生氧化还原之后生成金属阳离子的方式。图1为金属Li和某MOF发生氧化还原反应的图示,在化学还原之后,阳离子可诱导MOFs骨架发生移位。Mulfort等[35-38]用化学还原的方法将Li+、Na+、K+3种阳离子引入某种MOF,阳离子的引入导致MOF对四极矩分子H2吸附量明显增加,H2与阳离子的相互作用强弱排列为 Li+>Na+>K+,这说明化学还原引入的阳离子和四极矩之间的作用力同样与阳离子尺寸有直接关系。与H2吸附类似的原理,化学还原引入阳离子Li+同样有利于CO2/CH4的分离[33-34],Bae等[33]比较了离子交换和化学还原两种引入阳离子的方式,化学还原的效果略差于离子交换,认为:离子交换提升CO2/CH4选择性的原因是CO2与吸附剂之间的吸引力增强,而化学还原则是由于骨架发生的移位。

图1 MOF与Li之间的化学还原图示[34]
3 吸附剂表面化学性质对CO2/CH4吸附分离的影响
与胺基负载有所不同,胺基嫁接常依赖于吸附剂载体的表面化学性质。Huang等[39]指出,胺基官能团嫁接成功与否取决于表面羟基(—OH)与胺基官能团的反应。氧化硅材料的表面富含硅醇羟基(—OH),可较好地嫁接有机胺官能团。
Belmabkhout等[40-41]按照 Sayari等[42]的方法,将四甲基氢氧化铵(TMAOH)和溴化十六烷基三甲基铵(CTAB)嫁接在 MCM-41之上,改性后MCM-41的CO2吸附量和吸附选择性明显优于13X分子筛和活性炭。Belmabkhout等[43-44]还用三胺(triamine)改性MCM-41,得到TRI-PE-MCM-41( triamine-grafted pore-expanded mesoporous silica),对低浓度和高浓度的 CO2均有很好的吸附选择性,穿透曲线陡峭,吸附等容热(isosteric heat)较大(92 kJ/mol),再生稳定,循环使用 7次后,CO2吸附容量仅降低1.5%。与氧化硅材料不同,活性炭上表面羟基的缺失造成胺基嫁接量较少,如果要用胺基嫁接的方式来提升活性炭对CO2的吸附量和吸附选择性,必须对活性炭进行前处理。何平等[45-46]指出,经浓硝酸氧化处理后,活性炭表面酸性基团增加,胺基嫁接效果有所改善,最佳条件下CO2吸附量增加6.5倍。
4 吸附剂湿度对CO2/CH4吸附分离的影响
CO2在水中有较大的溶解度,水分有利于CO2的吸附。压力升高到某一特定值(1.3 MPa)后可生成CO2水合物,导致吸附量急剧增加。而在一定压力范围内,水分的存在则会抑制CH4的吸附,随压力升高,吸附量增加较少,而超过这一特定压力后,CH4的吸附量将“跳跃”(图2)增加[47-49]。从图3中可以明显看出,在CH4突跃增加之前,水分可以较大程度上提高吸附剂对CO2/CH4的吸附选择性。

图2 CH4在不同含水量的介孔炭上的吸附等温线[47]

图3 CH4和CO2在活性炭上的吸附等温线(水蒸气含量1.3%)[48]
对于胺基改性的吸附剂而言,水分的存在有利于胺基再生。从反应方程式可以看出,胺基(RNH2和 R2NH)与 CO2反应之后生成 RNHCOO-和R2NCOO-[式(1),式(2)],而 H2O 可使得RNHCOO-和 R2NCOO-重新生成 RNH2和 R2NH[式(4),式(5)],实现胺基的再生循环,大大提高CO2吸附量。Huang[39]、Lu[50]等均已证实,一定含量的水分有利于CO2的吸附,但随着水蒸气含量增加到一定程度,水分子和CO2分子相互竞争吸附位,会造成吸附量的降低。

另外,水分可改变吸附剂性质,改变分离性能。Yazaydın等[51]研究了水分对Cu-BTC分离CO2/CH4的影响,作者认为,水分子可以增强Cu-BTC电场,从而增强Cu-BTC与CO2分子之间的吸引力,提升CO2吸附量以及吸附选择性。
5 结 论
总结了孔结构、可交换阳离子、表面化学以及吸附剂湿度4种吸附剂特性对CO2/CH4二元混合体系吸附分离效果的影响,得出结论:中孔有利于该二元体系的分离和胺基负载;在吸附剂骨架之外引入合适的可交换阳离子可促进吸附剂与CO2四极子之间吸引力,提升分离效果;吸附剂的表面羟基是影响胺基嫁接的重要因素;水分既有利于该体系的吸附分离,又可以促进胺基吸附剂再生。
然而,这4种吸附剂特性的相互影响尚不明确。例如:可促进分离的水分也会破坏吸附剂的内部环境,影响骨架之外阳离子的存在形式,改变表面化学组成,孔的结构也会受到影响;阳离子的引入也会改变吸附剂的表面化学等。此外,综合吸附剂多种特性来讨论其对吸附分离效果影响的研究也未见报道,这些问题均有待在今后研究工作中进一步深入。
[1] 高庆先,杜吴鹏,卢士庆,等. 中国城市固体废弃物甲烷排放研究[J]. 气候变化研究进展,2006,2(6):269-272.
[2] 王明星,戴爱国,黄俊,等. 中国 CH4排放量的估算[J]. 大气科学,1993,17(1):52-63.
[3] 李喜. 甲烷/二氧化碳吸附剂研究[D]. 天津:天津大学,2005.
[4] 王震. 甲烷/二氧化碳的吸附法分离[D]. 天津:天津大学,2005.
[5] Yang R T. Adsorbents:Fundamentals and Applications[M].Hoboken:John Wiley and Sons,2003.
[6] 王玉新,周亚平,苏伟. 不同结构活性炭对CO2、CH4、N2及O2的吸附分离性能[J]. 化工进展,2009,28(2):206-210.
[7] 赵兴祥,张丽莉,徐晓亮,等. CO2/CH4/N2在SAPO-17上的吸附分离性能研究[J]. 石油与天然气化工,2009,38(5):383-389.
[8] 周理,吕昌忠,王怡林,等. 述评超临界温度气体在多孔固体上的物理吸附[J]. 化学进展,1999,11(3):221-226.
[9] 周亚平,杨斌. 气体超临界吸附研究进展[J]. 化学通报,2000,63(9):8-13.
[10] Nicholson D,Gubbins K E. Separation of carbon dioxide-methane mixtures by adsorption:Effects of geometry and energetics on selectivity[J]. The Journal of Chemical Physics,1996,104(20):8126-8134.
[11] 苏伟,周理,周亚平,等. 孔结构对活性炭吸附CH4和CO2的影响[J]. 天然气工业,2006,26(10):147-150.
[12] Chen Y F,Lee J Y,Babarao R,et al. A highly hydrophobic metal-organic framework Zn(BDC)(TED)0.5 for adsorption and separation of CH3OH/H2O and CO2/CH4:An integrated experimental and simulation study[J]. The Journal of Physical Chemistry C,2010,114(14):6602-6609.
[13] Pires J,Saini V K,Pinto M L. Studies on selective adsorption of biogas components on pillared clays:Approach for biogas improvement[J]. Environmental Science & Technology,2008,42(23):8727-8732.
[14] Xu X,Zhao X,Sun L,et al. Adsorption separation of carbon dioxide,methane and nitrogen on monoethanol amine modified β-zeolite[J].Journal of Natural Gas Chemistry,2009,18(2):167-172.
[15] Jadhav P D,Chatti R V,Biniwale R B,et al. Monoethanol amine modified zeolite 13X for CO2adsorption at different temperatures[J].Energy & Fuels,2007,21(6):3555-3559.
[16] Pinto M L,Pires J. Porous materials prepared from clays for the upgrade of landfill gas[J]. Journal of Physical Chemistry C,2008,112(37):14394-14402.
[17] Liu X,Li J,Zhou L,et al. Adsorption of CO2,CH4and N2on ordered mesoporous silica molecular sieve[J]. Chemical Physics Letters,2005,415(4-6):198-201.
[18] Liu X,Zhou L,Fu X,et al. Adsorption and regeneration study of the mesoporous adsorbent SBA-15 adapted to the capture/separation of CO2and CH4[J]. Chemical Engineering Science,2007,62(4):1101-1110.
[19] 吴彩丽,刘秀伍,苏伟,等. DIPA改性SBA15介孔分子筛用于CO2/CH4分离的性能研究[J]. 天然气化工,2010,35(2):42-48.
[20] 马聪聪. 流体在不同形状限定空间及 CMK材料内吸附及相行为研究[D]. 北京:北京化工大学,2009.
[21] Liang Z,Marshall M,Chaffee A L. CO2adsorption-based separation by metal organic framework(Cu-BTC)versus zeolite(13X)[J].Energy & Fuels,2009,23(5):2785-2789.
[22] Min Wang Q,Shen D,Bulow M,et al. Metallo-organic molecular sieve for gas separation and purification[J]. Microporous and Mesoporous Materials,2002,55(2):217-230.
[23] Hamon L,Jolimatre E,Pirngruber G D. CO2and CH4separation by adsorption using Cu-BTC metal-organic framework[J]. Industrial &Engineering Chemistry Researc,2010,49(16):7497-7503.
[24] 陈丹,张丽,刘迎春,等. 烷烃混合物在 Cu-BTC中的吸附与分离[J]. 化学学报,2008,66(20):2227-2234.
[25] Xue C,Yang Q,Zhong C. Effects of the side pockets on gas separation in metal-organic framework Cu-BTC:A molecular simulation study[J]. Molecular Simulation,2009,35(15):1249-1255.
[26] Yang Q,Zhong C. Molecular simulation of carbon dioxide/methane/hydrogen mixture adsorption in metal-organic frameworks[J]. The Journal of Physical Chemistry B,2006,110(36):17776-17783.
[27] Delgado J A,Uguina M A,Gómez J M,et al. Adsorption equilibrium of carbon dioxide,methane and nitrogen onto Na-and H-mordenite at high pressures[J]. Separation and Purification Technology,2006,48(3):223-228.
[28] Xu X,Zhao X,Sun L,et al. Adsorption separation of carbon dioxide,methane,and nitrogen on Hβ and Na-exchanged β-zeolite[J]. Journal of Natural Gas Chemistry,2008,17(4):391-396.
[29] Hernández-Huesca R,Díaz L,Aguilar-Armenta G. Adsorption equilibria and kinetics of CO2,CH4and N2in natural zeolites[J].Separation and Purification Technology,1999,15(2):163-173.
[30] Harlick P J E,Tezel F H. An experimental adsorbent screening study for CO2removal from N2[J]. Microporous and MesoporousMaterials,2004,76(1-3):71-79.
[31] 徐晓亮,赵兴祥,孙林兵,等. CO2、CH4和N2在不同硅/铝比β沸石上的吸附分离性能[J]. 化工进展,2009,28(12):2116-2121.
[32] 许青. 金属-有机骨架材料中气体吸附分离及材料改性设计的分子模拟研究[D]. 北京:北京化工大学,2010.
[33] Bae Y S,Hauser B G,Farha O K,et al. Enhancement of CO2/CH4selectivity in metal-organic frameworks containing lithium cations[J].Microporous and Mesoporous Materials,2011,141(1-3):231-235.
[34] Farha O K,Bae Y S,Hauser B G,et al. Chemical reduction of a diimide based porous polymer for selective uptake of carbon dioxide versus methane[J]. Chemical Communication,2010,46(7):1056-1058.
[35] Mulfort K L,Farha O K,Stern C L,et al. Post-synthesis alkoxide formation within metal-organic framework materials:A strategy for incorporating highly coordinatively unsaturated metal ions[J].Journal of the American Chemical Society,2009,131(11):3866-3868.
[36] Mulfort K L,Hupp J T. Chemical reduction of metal-organic framework materials as a method to enhance gas uptake and binding[J]. Journal of the American Chemical Society,2007,129(31):9604-9605.
[37] Mulfort K L,Hupp J T. Alkali metal cation effects on hydrogen uptake and binding in metal-organic frameworks[J]. Inorganic Chemistry,2008,47(18):7936-7938.
[38] Mulfort K L,Wilson T M,Wasielewski M R,et al. Framework reduction and alkali-metal doping of a triply catenating metal-organic framework enhances and then diminishes H2uptake[J]. Langmuir,2009,25(1):503-508.
[39] Huang H Y,Yang R T. Amine-grafted MCM-48 and silica xerogel as superior sorbents for acidic gas removal from natural gas[J].Industrial & Engineering Chemistry Research,2003,42(12):2427-2433.
[40] Belmabkhout Y,Sayari A. Adsorption of CO2from dry gases on MCM-41 silica at ambient temperature and high pressure 2:Adsorption of CO2/N2,CO2/CH4and CO2/H2binary mixtures[J].Chemical Engineering Science,2009,64(17):3729-3735.
[41] Belmabkhout Y,Serna-guerrero R,Sayari A. Adsorption of CO2from dry gases on MCM-41 silica at ambient temperature and high pressure.1:Pure CO2adsorption[J]. Chemical Engineering Science,2009,64(17):3721-3728.
[42] Sayari A,Yang Y. Highly ordered MCM-41 silica prepared in the presence of decyltrimethylammonium bromide[J]. The Journal of Physical Chemistry B,2000,104(20):4835-4839.
[43] Belmabkhout Y,Sayari A. Effect of pore expansion and amine functionalization of mesoporous silica on CO2adsorption over a wide range of conditions[J]. Adsorption,2009,15(3):318-328.
[44] Belmabkhout Y,Weireld G D,Sayari A. Amine-bearing mesoporous silica for CO2and H2S removal from natural gas and biogas[J].Langmuir,2009,25(23):13275-13278.
[45] 何平. 多胺基材料的制备表征及其对CO2吸附性能的研究[D]. 北京:北京化工大学,2010.
[46] 何平,张忠良,金君素,等. 胺接枝活性炭的制备及其对CO2的吸附性能[J]. 北京化工大学学报:自然科学版,2010,37(3):6-8.
[47] Liu X,Zhou L,Sun Y,et al. Methane sorption on ordered mesoporous carbon in the presence of water[J]. Carbon,2006,44(8):1386-1392.
[48] Sun Y,Xue Q,Zhou Y,et al. Sorption equilibria of CO2/CH4mixture on activated carbon in presence of water[J]. Journal of Colloid and Interface Science,2008,322(1):22-26.
[49] Zhou L,Liu X,Li J,et al. Sorption/desorption equilibrium of methane in silica gel with pre-adsorption of water[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2006,273(1-3):117-120.
[50] Lu C,Bai H,Su F,et al. Adsorption of carbon dioxide from gas streams via mesoporous spherical-silica particles[J]. Journal of the Air Waste Management Association,2010,60(4):489-496.
[51] Yazaydın Ö,Benin A I,Faheem S A,et al. Enhanced CO2adsorption in metal-organic frameworks via occupation of open-metal sites by coordinated water molecules[J]. Chemistry of Materials,2009,21(8):1425-1430.
Impact of the characteristics of adsorbents on the adsorption and separation of CO2/CH4binary system
LI Yundong,YI Honghong,TANG Xiaolong,LI Fenrong,HE Dan
(Faculty of Environmental Science and Engineering,Kunming University of Science &Technology,Kunming 650093,Yunnan,China)
There are many types of adsorbents which are used for adsorption and separation of CO2/CH4binary mixtures system. It is the various characteristics of adsorbents that affect separation result. As a starting point,four kinds of adsorbent properties affecting separation,which include porous structure,exchangeable cations,surface chemistry and moisture of adsorbent,are summarized in this article and the reason of all kinds of influences are explained. We come to several conclusions,including that mesoporous is conducive to the separation and amine grafting;the introduction of corresponding exchangeable cations can enhance the affinity between quadrupole and adsorbents,and improve the adsorption selectivity;surface hydroxyl is also an important factor affecting grafting amine;moisture can enhance the separation performance of adsorbent but also is conducive to grafting amine.
carbon dioxide;methane;adsorption separation;effect factor
O 647.3;TE 645
:A
:1000–6613(2012)05–0974–07
2011-10-20;修改稿日期:2011-11-16。
国家自然科学基金(21077047)及云南省中青年学术和技术带头人后备人才项目(2007PY01-10)。
李云东(1986—),男,硕士研究生,从事大气污染控制研究。联系人:易红宏,女,教授。E-mail yhhtxl@163.com。
