常绿岩垂草(Lippia nodiflora‘KURAPIA-S1’)对持续淹水胁迫的生理响应
2012-09-08耿养会蒋宣斌周小舟何邦亮
彭 秀,耿养会,蒋宣斌,周小舟,何邦亮
(重庆市林业科学研究院,三峡库区森林生态保护与恢复重庆市市级重点实验室,重庆 400036)
常绿岩垂草(Lippia nodiflora‘KURAPIA-S1’)系引进自日本,经杂交改良的马鞭草科过江藤属多年生匍匐草本植物,该品种开白色小花,具有四季常绿、耐旱、耐热、抗病虫害等特点,能高密度、快速覆盖土壤表面,是一种较为理想的水土保持材料。目前,常绿岩垂草已在重庆石漠化地区开展了引种适应性研究,表现较好,为扩大其应用领域和范围,探索其在三峡库区消落带的应用可能性,需要对常绿岩垂草的耐淹性进行试验研究,但相关研究还未见有报道。因此,本文开展了对持续淹水胁迫下常绿岩垂草叶片过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量、游离脯氨酸(PRO)含量、相对电导率等指标、存活率及外部形态的变化研究,以期从这些生理指标探索常绿岩垂草的耐淹机理,为其在三峡库区消落带植被恢复与重建中的应用与推广提供理论依据。
1 材料与方法
1.1 材料
2011年10月将生长基本一致的常绿岩垂草带土盆栽,置于重庆市林业科学研究院苗圃中进行相同光照、水分等常规管理,于12月1日开展试验。
1.2 方法
1.2.1 试验设计
本试验将试验用苗分成两组,即对照组和完全水淹组,每组100盆,完全水淹组包括20 d、40 d、60 d、80 d等4个水淹时间。对照组植株放置于试验基地旷地中,进行浇水、除草等常规田间管理。完全水淹组植株放置于注水的水池中,植株顶端距水面约20 cm,试验期间所有植株均处于被完全淹没的状态。试验共持续80 d,至2012年1月结束。试验结束后,将水淹组植株放置于试验基地旷地中,进行浇水、除草等常规田间管理,观测春季是否恢复正常生长,以计算其存活率。
试验之日取1次样,以后每间隔20 d取1次样,采集植株顶端功能叶片,对其生理生化指标连续进行4次测定,每次测定3个重复。具体测定的生理生化指标包括:常绿岩垂草叶片的过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量、游离脯氨酸(PRO)含量、相对电导率。
1.2.2 测定方法
过氧化物酶(POD)活性的测定采用愈创木酚法[1];超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)光还原法[1];过氧化氢酶(CAT)活性的测定采用紫外吸收法[2];丙二醛(MDA)含量的测定采用硫代巴比妥酸法[3];游离脯氨酸(PRO)含量的测定采用酸性茚三酮法[4];相对电导率采用DDS-11A数显电导率仪测定[5]。
1.2.3 数据分析
用统计分析软件SPSS13.0进行试验数据的处理和分析。用Duncan多重比较(Duncan's multiple range test)法进行多重比较,检验每个生理指标在不同水淹时间的差异显著性,用独立样本t测试(Independent t-test)检验同一水淹时间下全淹处理植株与对照植株之间生理指标的差异。文中的图表由Microsoft Excel软件制作完成。
2 结果与分析
2.1 过氧化物酶(POD)活性的响应
持续淹水胁迫下,常绿岩垂草叶片POD活性随处理时间的延长呈现降—升—降的趋势(图1)。持续淹水20 d时,POD活性降到最低值3065 μ·g-1min-1,比对照水平(2943 μ·g-1min-1)高 122 μ·g-1min-1;持续淹水40 d时,POD 活性明显升高至6174 μ·g-1min-1,比对照水平(7193 μ·g-1min-1)低1019 μ·g-1min-1;持续淹水 60 d、80 d时,POD 活性又逐渐降低至5393 μ·g-1min-1、5091 μ·g-1min-1,分别比对照水平(5630 μ·g-1min-1、6402 μ·g-1min-1)低 238 μ·g-1min-1、1312 μ·g-1min-1。由图 1 可知,持续淹水胁迫下常绿岩垂草叶片POD活性在0~60 d变化趋势与对照相同且没有显著差异,但在60 d~80 d,持续淹水胁迫下常绿岩垂草叶片POD活性下降却与对照相反,且在80 d时显著低于对照(P<0.05)。

图1 持续淹水胁迫下常绿岩垂草POD活性的变化(平均值±标准误)Fig.1 Changes of POD activity in leaves of Lippia nodiflora‘KURAPIA-S1’(mean±SE)
2.2 超氧化物歧化酶(SOD)活性的响应
持续淹水胁迫下,常绿岩垂草叶片SOD活性随处理时间延长呈现升—降—升的趋势(图2)。持续淹水40 d时,SOD 活性升到最高值1820 μ·g-1,比对照水平(2404 μ·g-1)低 584 μ·g-1;持续淹水60d 时,SOD 活性降到最低值616 μ·g-1,比对照水平(906 μ·g-1)低 290 μ·g-1。由图 2 可知,持续淹水胁迫下的常绿岩垂草叶片SOD活性在处理时间内变化趋势与对照相同并始终显著低于对照(P<0.05),但在60d~80d,持续淹水胁迫下的常绿岩垂草叶片SOD活性变化较小没有显著差异。
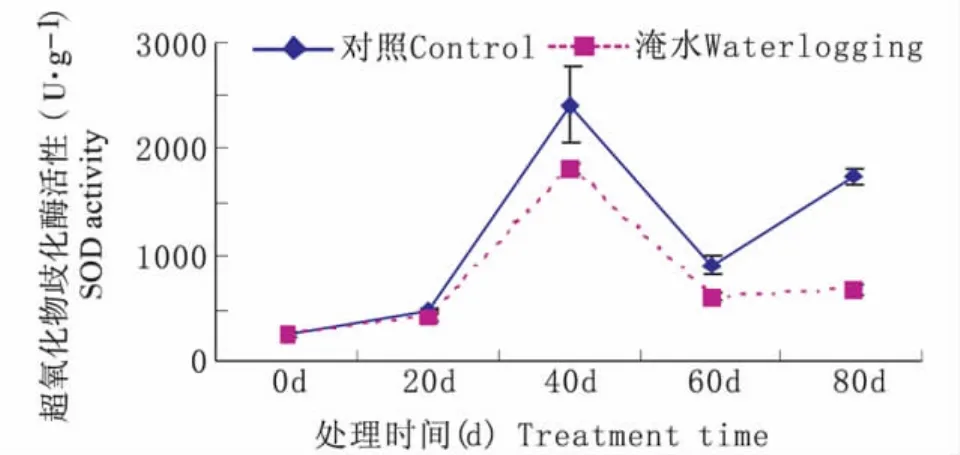
图2 持续淹水胁迫下常绿岩垂草SOD活性的变化(平均值±标准误)Fig.2 Changes of SOD activity in leaves of Lippia nodiflora‘KURAPIA-S1’(mean±SE)
2.3 过氧化氢酶(CAT)活性的响应
持续淹水胁迫下,常绿岩垂草叶片CAT活性随处理时间延长呈现降—升—降—升的剧烈变化趋势(图3)。持续淹水20 d时,CAT活性降到最低值1.42 μ · g-1min-1,比 对照水 平 (4.43 μ · g-1min-1)低 3.01 μ·g-1min-1;持续淹水 40 d 时,CAT 活性升到最高值 6.61 μ·g-1min-1,比对照水平(4.31 μ·g-1min-1)高 2.30 μ·g-1min-1;持续60 d、80 d 时,CAT 活性先降至2.82 μ·g-1min-1再升至3.99 μ·g-1min-1,分别比对照水平(4.36 μ·g-1min-1、5.37 μ · g-1min-1)低 1.54 μ · g-1min-1、1.38 μ·g-1min-1。由图 3 可知,对照的常绿岩垂草叶片CAT活性在0~60 d变化较小且没有显著差异,至80 d时才显著升高(P<0.05),但在20 d、40 d、60 d、80 d 时,与持续淹水处理均达到差异显著水平(P<0.05)。

图3 持续淹水胁迫下常绿岩垂草CAT活性的变化(平均值±标准误)Fig.3 Changes of CAT activity in leaves of Lippia nodiflora‘KURAPIA-S1’(mean±SE)
2.4 丙二醛(MDA)含量的响应
持续淹水胁迫下,常绿岩垂草叶片MDA含量随处理时间延长呈现逐渐下降的趋势(图4)。持续淹水80 d时,MDA含量降到最低值0.55 mmol·g-1,比对照水平(2.83 mmol·g-1)低 2.28 mmol·g-1。由图4可知,持续淹水胁迫下的常绿岩垂草叶片MDA含量在淹水处理前期0 d、20 d之间和后期60 d、80 d之间变化较小且没有显著差异,在20 d、40 d、60 d时,MDA含量变化较大且两两之间差异显著(P <0.05),而在20 d、40 d、60 d、80 d 时,持续淹水处理与对照均达到显著水平(P<0.05)。

图4 持续淹水胁迫下常绿岩垂草MDA含量的变化(平均值±标准误)Fig.4 Changes of MDA content in leaves of Lippia nodiflora‘KURAPIA-S1’(mean±SE)
2.5 游离脯氨酸(PRO)含量的响应
持续淹水胁迫下,常绿岩垂草叶片PRO含量随处理时间延长呈现降—升—降的趋势(图5)。持续淹水40 d 时,PRO 含量降到最低值 0.81 μg·g-1,比对照水平(3.86 μg·g-1)低 3.06 μg·g-1;持续淹水60 d、80 d 时,PRO 含量升到 2.41 μg·g-1后又降到 0.98 μg·g-1,比对照水平(8.38 μg·g-1、17.28 μg·g-1)分别低 5.97 μg·g-1、16.30 μg·g-1。由图5可知,持续淹水胁迫下常绿岩垂草叶片PRO含量在0~60 d变化趋势与对照相同且显著低于对照(P<0.05),但在60 d~80 d,持续淹水胁迫下常绿岩垂草叶片PRO含量下降却与对照相反,但其值仍然显著低于对照(P<0.05)。
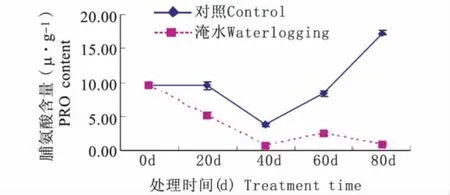
图5 持续淹水胁迫下常绿岩垂草PRO含量的变化(平均值±标准误)Fig.5 Changes of PRO content in leaves of Lippia nodiflora‘KURAPIA-S1’(mean±SE)
2.6 相对电导率的响应
持续淹水胁迫下,常绿岩垂草叶片相对电导率随处理时间延长呈现升—降—升的趋势(图6)。持续淹水20 d时,相对电导率升到28.69%,比对照水平(23.37%)高5.33%;持续淹水60 d时,相对电导率降到 13.13%,比对照水平(11.13%)高2.00%;持续淹水80 d时,相对电导率升到最高39.99%,比对照水平(34.37%)高5.63%。由图6可知,持续淹水胁迫下常绿岩垂草叶片相对电导率在0~40 d、60 d~80 d变化趋势与对照相同,但40 d ~60 d 下降却与对照相反;在20 d、40 d、60 d、80 d时,持续淹水处理与对照均达到差异显著水平(P<0.05)。
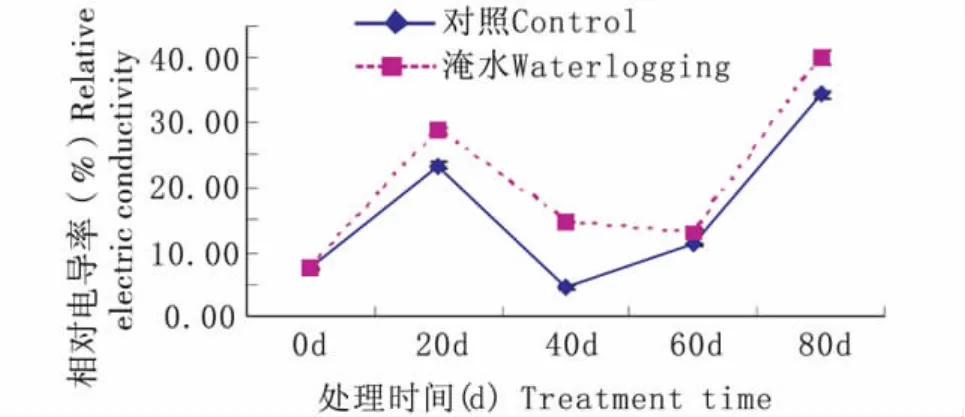
图6 持续淹水胁迫下常绿岩垂草相对电导率的变化(平均值±标准误)Fig.6 Changes of Relative electric conductivity in leaves of Lippia nodiflora‘KURAPIA-S1’(mean±SE)
2.7 存活率及外部形态的变化
常绿岩垂草对持续水淹有较强的耐受能力,从20 d一直到80 d的全淹处理后,存活率始终都保持为100%。在全淹情况下,常绿岩垂草能够持续产生新的叶片,新生叶片及茎干较小且直立,颜色为绿色,但随着淹水时间的延长,新叶生长速度与数量逐渐减缓和减少,老叶片则不断枯死凋落。对照条件下,常绿岩垂草随冬季的到来而慢慢进入休眠期,新叶生长逐渐停止,老叶片不枯不凋,叶片颜色由绿色变为暗墨绿色。在解除淹水胁迫后,常绿岩垂草随春季的到来恢复正常生长。
3 讨论
淹水胁迫会破坏细胞内自由基清除与产生的动态平衡,造成大量的活性氧积累,但植物体内SOD、POD、CAT共同组成1个有效的清除系统,能有效地组织植物体内活性氧和MDA的积累,提高植株耐性[6]。研究表明,不同植物在淹水后保护酶系统活性变化差异较大[7~11],表明不同植物对淹水的反应不同。本研究结果显示,在淹水胁迫前期(0~40 d),常绿岩垂草叶片的POD、SOD、CAT活性均表现为上升趋势,说明常绿岩垂草在淹水胁迫下体内产生活性氧的速度较为缓慢,在较长时间内活性氧慢慢累积达到最高峰,诱导保护酶系统协同作用抵抗外界环境胁迫,随着淹水时间的延长(40 d~80 d),常绿岩垂草叶片的POD、SOD、CAT活性均表现为下降,可能此时常绿岩垂草对淹水胁迫已经产生了适应性,各种防御系统被调动起来,不再产生活性氧自由基,因此,也不需要过多的保护酶加以清除。
细胞膜的稳定性是植物细胞执行正常生理功能的基础。植物在逆境条件下体内通常会产生活性氧,从而启动膜脂过氧化或膜脂脱脂作用,或改变细胞质膜透性,进而影响植物代谢,表现为MDA的积累与相对电导率的增加。MDA的产生作为叶片衰老的标志,是衡量不同植物物种或品种耐淹能力强弱的指标之一。随着淹水时间的延长,常绿岩垂草叶片MDA的含量逐渐降低,这与在烟草、枫杨水涝研究中植物质膜透性随水涝胁迫程度增加而增大的结论相反[11~14],可能与常绿岩垂草在淹水条件下产生新叶片有关,这说明常绿岩垂草具有较强的耐淹能力。本试验常绿岩垂草相对电导率在淹水初期明显升高,然后随处理时间延长而略微下降,至淹水胁迫后期又显著升高,说明膜系统在淹水初期和后期受到一定程度的损害,细胞外渗物质增多,但由于MDA含量在降低,一定程度上降低了淹水胁迫对细胞膜系统的损害。
PRO是一种重要的渗透调节物质,许多研究表明,植物在水分胁迫条件下体内PRO含量的变化与其合成受激、氧化受抑和蛋白质合成受阻有关。在对烤烟、大米草的研究中[14,15],植物在淹水胁迫下体内PRO含量增大,表明植物体内活性氧代谢失调,引起自由基的积累,加剧细胞膜脂过氧化作用,导致渗透调节物质增加。本研究常绿岩垂草叶片PRO含量减少,可能由于常绿岩垂草耐淹性较强,细胞质膜受损程度小,因此没有引起植物体内渗透调节物质的增加。
存活率是判断植物水淹耐受能力的重要指标,也是判断植物在河岸带可能的分布范围的重要标准[16~18]。在三峡水库消落区低海拔地段的水淹可持续长达6个月,而本试验证实,常绿岩垂草在长达80 d的全淹处理后存活率为100%,有较强的水淹耐受能力,有可能也能够耐受库区消落区低海拔地段的水淹环境而存活。为了缓解水淹对植株造成的伤害,不同的耐淹植物能够采取不同的策略来适应水淹环境,有的植物可以加速枝条和叶片的伸长生长,以快速“逃离”水淹逆境[19-21],本研究常绿岩垂草在水淹胁迫下持续产生新的细长叶片且呈直立状,这可能是其对水淹环境积极的适应性响应。通过常绿岩垂草在持续水淹胁迫下的生理响应分析得知,常绿岩垂草有较强的水淹耐受能力,有可能用于三峡库区消落带植被恢复与重建。
[1]郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社,2006:68~159.
[2]中国科学院上海植物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999.
[3]赵世杰,许长城,邹琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207~210.
[4]郝再彬.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.
[5]熊庆娥.植物生理学实验指导[M].雅安:四川农业大学,2004:23~24.
[6]Ushimaru T,Kanematsu S,Katayama M.Antioxidative enzymes in seedlings of Nelumbo nucifera germinated under water[J].Physiology Plantarum,2001,112:39 ~46.
[7]何嵩涛,刘国琴,樊伟国.银杏对水涝胁迫的生理反应[J].山地农业生物学报,2000,19(4):272 ~275.
[8]高洪波,章铁军,吴晓蕾,等.淹水胁迫下γ-氨基丁酸对黄瓜幼苗生长和生理代谢的影响[J].内蒙古农业大学学报,2007,28(3):158 ~162,167.
[9]陈传红,吴斌华,李荣同,等.淹水对西瓜幼苗SOD、POD活性和某些营养物质的影响[J].江苏农业科学,2008(5):146~147,274.
[10]古志钦,张利权.互花米草对持续淹水胁迫的生理相应[J].环境科学学报,2009,29(4):876 ~881.
[11]钟雪花,杨万年,吕应堂.淹水胁迫下对烟草、油菜某些生理指标的比较研究[J].武汉植物学研究,2002,20(5):395~398.
[12]曾淑华,刘飞虎,覃鹏,等.淹水对烟草生理指标的影响[J].烟草科技,2004(1):36~38.
[13]李纪元,饶垅兵,方新高.人工淹水胁迫下枫杨种源MDA含量的地理变异[J].浙江林业科技,1999,19(4):22 ~27.
[14]黎时光,杨友才,曾强,等.淹水胁迫对烤烟不同生育时期生理生化特性的影响[J].华北农学报,2008,23(3):116 ~119.
[15]李红丽,智颖飙,雷光春,等.外来克隆植物大米草对模拟潮汐淹水时间的生理相应[J].湿地科学,2010,8(2):125~131.
[16]Gibbs J,Greenway H.Mechanisms of anoxia tolerance in plants I.Growth,survival and anaerobic catabolism.Functional Plant Biology,2003,30:1 ~47.
[17]van Eck W H J M,van de Steeg H M,Blom C W P M,et al.Is tolerance to summer flooding correlated with distribution patterns in river floodplains?A comparative study of 20 terrestrial grassland species.Oikos,2004,107:393 ~405.
[18]Vervuren P J A,Blom C W P M,de Kroon H,et al.Extreme flooding events on the Rhine and the survival and distribution of riparian plants species.Journal of Ecology,2003,91:135 ~146.
[19]Voesenek L A C J,Clomer T D,Pierik R,et al.How plants cope with complete submergence.New Phytologist,2006,170(2):213~226.
[20]Voesenek L A C J,Rijnders J H G M,Peeters A J M,et al.Plant hmrmones regulate fast shoot elongation under water:from genes to communities.Ecology,2003,85(1):16 ~27.
[21]Groeneveld H W,Voesenek L A C J.Submergence-induced petiole elongation in Rumex palustris is controlled by developmental stage and storage compounds.Plant and Soil,2003,253:115 ~123.
