兔抗MyosinⅩ多克隆抗体的制备及初步应用
2012-09-08张建华施恒亮翟艳华俞华莉曹让娟朱筱娟
张建华,施恒亮,翟艳华,俞华莉,曹让娟,朱筱娟
(东北师范大学生命科学学院,吉林长春13 0024)
兔抗MyosinⅩ多克隆抗体的制备及初步应用
张建华,施恒亮,翟艳华,俞华莉,曹让娟,朱筱娟
(东北师范大学生命科学学院,吉林长春130024)
为制备兔抗肌球蛋白Ⅹ(m y o s i nⅩ,M y oⅩ)多克隆抗体,合成了含有M y oⅩN端1000~1021个氨基酸的多肽,将纯化后的多肽与钥孔戚血蓝蛋白(k e y h o l e l i m p e t h e m o c y a n i n,K LH)进行交联;通过背部皮下免疫新西兰大白兔获得免疫血清,并通过E L I S A、免疫印迹、免疫荧光等分析对免疫血清进行了初步的验证.结果表明:经过4次免疫后可获得免疫血清,E L I S A检测表明抗体终效价达到1∶51200,抗原吸附实验进一步证明了此多克隆抗体的特异性.利用获得的多克隆抗体检测了多种组织中M y oⅩ的表达,发现兔抗M y oⅩ多克隆抗体可特异性识别多种组织中的M y oⅩ.免疫荧光染色表明该抗体可以显示M y oⅩ在C O S-7细胞、N L T细胞和神经元中的分布.
肌球蛋白Ⅹ;多克隆抗体;半抗原
1 材料与方法
1.1 动物
新西兰大白兔,由北京华阜康动物中心提供,雌性,体重约2k g.
1.2 M y oⅩ分子N端多肽抗原的合成
参考H i r o s h i T o k u o和M i t s u o I k e b e的报道[10],根据M y oⅩN端1000~1021氨基酸序列设计并合成多肽作为半抗原,多肽序列为N′-D D D D A F K D S P N P S HE GH S D QR T S-C′.免疫用抗原为C端交联载体蛋白K LH的完全抗原,由上海吉尔生化有限公司完成.合成多肽14μg,取其中10μg与K LH交联用于免疫动物,4μg非偶联的半抗原用于E L I S A检测抗血清效价.弗氏佐剂和羊抗兔
I g G-HR P为S i g m a公司产品.E C L反应试剂盒为G E-H e a l t h c a r e公司产品.
1.3 兔抗M y oⅩ多克隆抗体的制备
将完全抗原1m g溶于1m L P B S中,并与等体积的弗氏佐剂进行充分的乳化.将乳化后的抗原进行背部多点皮下注射免疫新西兰大白兔.首次免疫后2周加强免疫1次,第三次免疫之前进行耳缘静脉取血,采用E L I S A检测效价以确定加强免疫的次数.首次免疫采用完全弗氏佐剂,加强免疫均使用不完全弗氏佐剂.最后一次加强免疫后一周颈动脉放血,收集血液于4℃过夜,析出血清;10000r/m i n,4℃,离心10m i n,分离血清.
1.4 E L I S A检测抗血清效价
用10μg/m L的半抗原包被96孔板,每孔100μL,4℃孵育过夜后,用P B S T洗涤3次,每次4m i n;用10%(w/v)脱脂奶粉-P B S进行封闭,每孔150μL,37℃孵育1h;每孔加入用P B S倍比稀释的抗血清100μL(对照为未免疫兔血清),37℃孵育1h;洗涤,每孔加入1∶10000稀释的HR P标记的羊抗兔I g G 100μL,37℃孵育1h,洗涤3次后进行TMB显色,37℃孵育15 m i n,终止反应后,测定样品的D(450)值.
1.5 M y oⅩ多克隆抗体的特异性分析
1.5.1 组织蛋白的提取
用R I P A裂解液(含10 m L/L N P-40,50 mm o l/L N a C l,P B S(p H=7.2),2 mm o l/L E D TA, 50mm o l/L氟化钠,0.2mm o l/L胆矾酸钠,蛋白酶抑制剂)裂解鼠脑、心、肝、肺、肾、皮肤等组织,冰上孵育30m i n.其间每间隔5m i n用涡旋振荡器振荡一次,此后离心(10000r/m i n,4℃,10m i n),收集上清获得组织蛋白.同样方法获得肿瘤SW 480和SW 620的蛋白抽提液.
1.5.2 免疫印迹分析
取含15μg总蛋白的裂解液,加入S D S-P AG E样品缓冲液,100℃加热煮沸5m i n后,进行常规的S D S-P AG E电泳,分离胶浓度为8%.电泳结束以后将蛋白样品转移至P V D F膜上,用5%(w/v)脱脂奶粉室温封闭1h;加入1∶3000稀释的兔抗M y oⅩ多克隆抗体,室温下孵育1h;P B S T缓冲液洗膜后,加入羊抗兔I g G-HR P抗体,室温下孵育1h;P B S T缓冲液洗涤膜后,E C L法显色.
1.5.3 免疫荧光染色
将盖玻片用3%冰醋酸浸泡30m i n后冲洗,再用75%的酒精浸泡1h以上,自来水冲洗干净,晒干.将细胞按1×105个/m L的数量铺到已包被盖玻片的12孔板中,37℃温箱中培养12~24h后吸掉培养基;用预冷的4%多聚甲醛室温固定10m i n;用含0.2%T r i t o n的P B S室温打孔10m i n;用2%B S A室温封闭1h;加入以1∶1000的比例稀释的兔抗血清,室温反应1h,P B S洗涤3次,每次5m i n;用P B S以1∶5000的比例稀释二抗,室温反应1h,P B S洗涤3次,每次5m i n;去离子水洗涤两次,每次5m i n; 75%甘油(P B S稀释)封片,显微镜观察,拍照记录结果.
2 结果
2.1 半抗原的合成及偶联
应用P l o t o f P r o t e i n H y d r o p a t h i c P r o f i l e软件对M y oⅩ序列的亲水性进行分析(见图1 A),根据亲水性分析曲线,设计并合成含有M y oⅩN端21个氨基酸的多肽作为半抗原;经高效液相色谱纯化以后的多肽纯度为95.27%(见图1 B),半抗原的氨基酸序列为M y oⅩ分子N端1000~1021氨基酸(见图1 C).
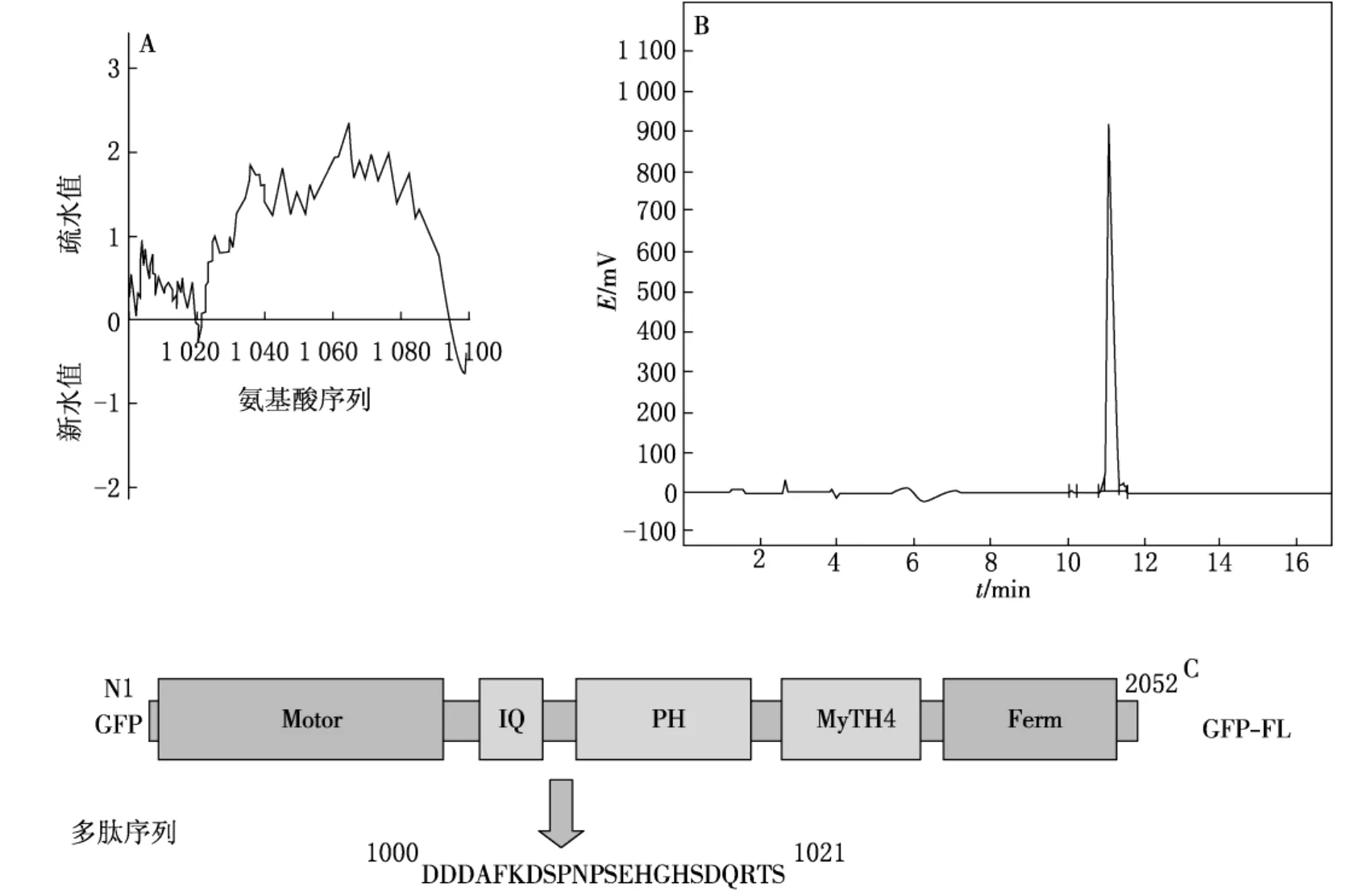
图1 多肽序列的选择及纯度分析
2.2 兔抗M y oⅩ多克隆抗体的效价分析
经4次动物免疫后,用E L I S A进行效价测定,半抗原检测效价达到1∶6400,说明抗血清可以与多肽半抗原发生抗原抗体反应.全抗原检测效价达到1∶51200,说明进行K LH偶联后加强了半抗原的免疫原性.
2.3 兔抗M y oⅩ多克隆抗体的特异性分析
取胎龄16.5d的鼠脑组织,分别用免疫前血清、免疫后按1∶5000稀释的免疫血清和经M y oⅩ抗原吸附后的免疫血清(5m L,按1∶1000稀释后的抗血清中加入2m g偶联的多肽抗原室温反应1h)进行W e s t e r n b l o t分析,检测免疫血清的特异性.如图2所示,左泳道是免疫前的兔血清,可见免疫前的兔血清不能识别M y oⅩ相应的条带;中间泳道是免疫后的免疫血清,可以检测到分别与M y oⅩ的全长形式和无头形式相对应的两个条带,相对分子质量分别为240000和165000,与文献报道相符;右泳道是进行抗原吸附后的免疫血清,由于抗原中和,免疫血清丧失识别抗原能力,因此,检测不到与M y oⅩ的全长和无头形式相对应的两个条带.以上实验说明抗血清可以特异性识别和结合M y oⅩ抗原.

图2 兔抗M y oⅩ多克隆抗体对M y oⅩ蛋白结合特异性分析
2.4 兔抗M y oⅩ多克隆抗体有效识别多种组织中表达的M y oⅩ
分别将鼠脑、大脑、小脑、心、肝、肺、肾、皮肤组织作为电泳样本,利用获得的抗体进行W e s t e r n b l o t分析.如图3 A所示,兔抗M y oⅩ多克隆抗体可以识别鼠脑组织(包括大脑和小脑)中相对分子质量分别为240000和165000的两种形式的M y oⅩ,证实了神经系统中两种形式M y oⅩ的存在.在鼠心、肝、肺、肾和皮肤组织中,检测到M y oⅩ不同水平的表达(见图3 B).另外,该多克隆抗体还可以识别结肠癌细胞SW 480和SW 620中的M y oⅩ(见图3 C),说明该抗体具有广泛的组织识别能力.

图3 兔抗M y oⅩ多克隆抗体对鼠多种组织的免疫印记分析
2.5 兔抗M y oⅩ多克隆抗体的免疫荧光分析
用该多克隆抗体分别对C O S-7细胞、N L T细胞和神经元进行免疫荧光染色,如图4所示,可以清晰地看到在C O S-7细胞、N L T细胞和神经元中M y oⅩ的分布.在C O S-7和N L T细胞中,呈现典型的细胞突起末端积累的特征;在培养的大鼠海马神经元中在轴突、树突和胞体都有着色,细胞核周围强染色的部位为M y oⅩ合成后在内质网积累.

图4 兔抗M y oⅩ多克隆抗体分别在C O S-7细胞、N L T细胞和神经元中的免疫荧光分析
3 讨论
M y oⅩ是一种只在脊椎动物中表达的非传统的肌球蛋白,可作为动力蛋白调节细胞的基本生命活动.M y oⅩ在肌肉、肾脏、肺、胸腺等组织均有不同程度的表达,在一些癌细胞中也有上调的趋势.全长形式的M y oⅩ是细胞内重要的分子马达,与丝状伪足的形成和延伸相关[13-14].在培养的哺乳动物细胞中M y oⅩ在板状伪足的边缘、膜皱边和丝足顶端定位[15].M y oⅩ的头部动力区对于丝足的形成非常重要.丝足是细胞迁移前端的突起,丝足的增多和延长是细胞定向迁移能力增强的表现[16].微管、微丝细胞骨架系统与细胞迁移息息相关,而M y oⅩ与微丝、微管均有相互作用,这表明了M y oⅩ与细胞迁移存在联系.由E L I S A的结果显示,本研究制备的多克隆抗体能够与合成的半抗原发生抗原抗体的特异性反应,证明了此抗体的特异性.进一步的抗原吸附实验也证明了此多克隆抗体的特异性.这种多克隆抗体为M y oⅩ在肿瘤转移过程中的作用研究提供了有利的条件.
在中枢神经系统特别是脑组织中,M y oⅩ的表达是非常稳定而且丰富的.值得注意的是,无头形式的M y oⅩ存在于脑组织中,并且呈现出与全长形式的M y oⅩ不同的表达模式.这说明无头形式的M y oⅩ只在中枢神经系统发育过程中发挥作用,只是具体作用机制尚不清楚.本研究制备的M y oⅩ多克隆抗体为研究M y oⅩ在脑发育过程中的作用奠定了基础.
[1] S OU S A A D,CHE N E Y R E.M y o s i n-Ⅹ:a m o l e c u l a r m o t o r a t t h e c e l l's f i n g e r t i p s[J].T r e n d s C e l l B i o l,2005,15(10):533-539.
[2] C I RU L L I V,Y E B RA M.N e t r i n s:b e y o n d t h e b r a i n[J].N a t R e v M o l C e l l B i o l,2007,8(4):296-306.
[3] J I NG N H,S HE NG N Y,X I E Z H.T h e f u n c t i o n o f BMP s i g n a l i n g p a t h w a y d u r i n g t h e c e n t r a l n e r v o u s s y s t e m d e v e l o p m e n t[J].C h i n J C e l l B i o l,2009,31(1):2-8.
[4] P I X C,R E N R Q,K E L L E Y R,e t a l.S e q u e n t i a l r o l e s f o r m y o s i n-X i n BMP 6-d e p e n d e n t f i l o p o d i a l e x t e n s i o n,m i g r a t i o n,a n d a c t i v a t i o n o f BMP r e c e p t o r s[J].J C e l l B i o l,2007,179(3):1569-1582.
[5] D AN E N E H.I n t e g r i n p r o t e o m e s r e v e a l a n e w g u i d e f o r c e l l m o t i l i t y[J].S c i S i g n a l,2009,89(2):58.
[6] AV RAAM I D E S C J,GA RMY S B,VA RN E R J A.I n t e g r i n s i n a n g i o g e n e s i s a n d l y m p h a n g i o g e n e s i s[J].N a t R e v C a n c e r,2008,8(8):604-617.
[7] Z HU X J,WANG C Z,D A I P G,e t a l.M y o s i nⅩr e g u l a t e s n e t r i n r e c e p t o r s a n d f u n c t i o n s i n a x o n a l p a t h-f i n d i n g[J].N a t C e l l B i o l,2007,9(2):184-192.
[8] S OU S A A D,CHE N E Y R E.M y o s i n-X:a m o l e c u l a r m o t o r a t t h e c e l l's f i n g e r t i p s[J].T r e n d s C e l l B i o l,2005,15(10):533-539.
[9] T OY O S H I MA F,N I S H I D A E.I n t e g r i n-m e d i a t e d a d h e s i o n o r i e n t s t h e s p i n d l e p a r a l l e l t o t h e s u b s t r a t u m i n a n E B 1-a n d m y o s i n X-d e p e n d e n t m a n n e r[J].EMB O J,2007,26(6):1487-1498.
[10] Y ON E Z AWA S,K I MURA A,KO S H I B A S.M o u s e m y o s i nⅩ:m o l e c u l a r a r c h i t e c t u r e a n d t i s s u e e x p r e s s i o n a s r e v e a l e d b y n o r t h e r n b l o t a n d i n s i t u h y b r i d i z a t i o n a n a l y s e s[J].B i o c h e m B i o p h y s R e s C o mm u n,2000,271(2):526-533.
[11] T OKUO H,I K E B E M.M y o s i n X t r a n s p o r t s M e n a/VA S P t o t h e t i p o f f i l o p o d i a[J].B i o c h e m B i o p h y s R e s C o mm u n,2004,319(1):214-220.
[12] S OU S A A D,B E R G J S,R O B E R T S ON B W,e t a l.M y o X i n b r a i n:d e v e l o p m e n t a l r e g u l a t i o n,i d e n t i f i c a t i o n o f a h e a d l e s s i s o f o r m s a n d d y n a m i c s i n n e u r o n s[J].J C e l l B i o l,2006,119(1):184-194.
[13] B OH I L A B,R O B E R T S ON B W,CHE N E Y R E.M y o s i n-Ⅹi s a m o l e c u l a r m o t o r t h a t f u n c t i o n s i n f i l o p d i a f o r m a t i o n[J].P r o c N a t l A c a d S c i U S A,2006,103(33):12411-12416.
[14] T OKUO H,MA B U CH I K,I K E B E M.T h e m o t o r a c t i v i t y o f M y o s i n-Ⅹp r o m o t e s a c t i n f i b e r c o n v e r g e n c e a t t h e c e l l p e r i p h e r y t o i n i t i a t e f i l o p o d i a f o r m a t i o n[J].J C e l l B i o l,2007,179(2):229-238.
[15] N I E S,K E E Y,B R ONN E R F M.M y o s i n-Ⅹi s c r i t i c a l f o r m i g r a t o r y a b i l i t y o f X e n o p u s c r a n i a l n e u r a l c r e s t c e l l s[J].D e v B i o l,2009,335(1):132-142.
[16] K E R B E R M L.A n o v e l f o r m o f m o t i l i t y i n f i l o p o d i a r e v e a l e d b y i m a g i n g M y o s i n-Ⅹa t t h e m i n g l e-m o l e c u l e l e v e l[J].C u r r B i o l,2009,19(11):967-973.
(责任编辑:方 林)
T h e p r e p a r a t i o n a n d p r e l i m i n a r y a p p l i c a t i o n o f r a b b i t p o l y c l o n a l a n t i b o d y a g a i n s t M y o s i nⅩ
Z HANG J i a n-h u a,S H I H e n g-l i a n g,Z HA I Y a n-h u a,YU H u a-l i,C AO R a n g-j u a n,Z HU X i a o-j u a n
(S c h o o l o f L i f e S c i e n c e s,N o r t h e a s t N o r m a l U n i v e r s i t y,C h a n g c h u n 130024,C h i n a)
T o o b t a i n t h e r a b b i t p o l y c l o n a l a n t i b o d i e s a g a i n s t M y o s i nⅩ,ap o l y p e p t i d e c o n t a i n i n g o f 1000~1021a m i n o a c i d s f r o m N-t e r m i n a l o f M y o s i nⅩw a s s y n t h e s i z e d a n d c o u p l e d t o K LH.T h e n,t h e p o l y p e p t i d e w a s u s e d t o i mm u n i z e N e w Z e a l a n d w h i t e r a b b i t s b y s u b c u t a n e o u s i n j e c t i o n t o p r e p a r e t h e a n t i s e r u m.T h e t i t e r o f t h e a n t i s e r u m r e a c h e d t o 1∶51200a f t e r 4t i m e s o f i mm u n e a s r e v e a l e d b y E L I S A,a n d t h e s p e c i f i c i t y o f t h e p o l y c l o n a l a n t i b o d y w a s c o n f i r m e d b y a n t i g e n a b s o r p t i o n t e s t.F u r t h e r m o r e,f o u n d t h i s p o l y c l o n a l a n t i b o d y c a n s p e c i f i c a l l y r e c o g n i z e d M y oⅩi n s e v e r a l t i s s u e s a s r e v e a l e d b y W e s t e r n b l o t.I n a d d i t i o n,i mm u n o f l u o r e s c e n c e d i s p l a y e d t h e d i s t r i b u t i o n o f M y o s i nⅩi n C O S-7c e l l s,N L T c e l l s a n d p r i m a r i l y c u l t u r e d n e u r o n s.I n c o n c l u s i o n,t h e M y o s i nⅩp o l y c l o n a l a n t i b o d y w a s s u c c e s s f u l l y p r e p a r e d,w h i c h p r o v i d e d a p o w e r f u l t o o l f o r f u r t h e r s t u d y o f e x p r e s s i o n a n d d i s t r i b u t i o n o f M y o s i nⅩi n t i s s u e s a n d c e l l s.
M y o s i nⅩ;p o l y c l o n a l a n t i b o d y;h a p t e n
R 392.1[学科代码]180·2150
A
1000-1832(2012)01-0140-05
肌球蛋白是一种马达蛋白,以肌动蛋白丝作为运行的轨道,通过AT P的水解导致构型的变化从而在肌动蛋白丝上移动,调节细胞骨架的改构和细胞运动.目前鉴定的肌球蛋白家庭成员有20余种,其中肌球蛋白Ⅹ(m y o s i nⅩ,M y oⅩ)是仅表达于脊椎动物中的一种肌球蛋白,相对分子质量为240000.M y oⅩ含有与肌动蛋白及AT P结合的头部动力区;其颈部的I Q区域可与钙调蛋白结合,螺旋结构域参与形成二聚体;其尾部区域包括了一个P E S T蛋白水解位点,3个连续的P H结构域(p l e c k s t r i n h o m o l o g y d o m a i n),M y TH 4结构域(m y o s i n-t a i l h o m o l o g y 4d o m a i n)和F E RM结构域(b a n d-4.1/e z r i n/r a d i x i n/m o e s i n)[1].M y oⅩ的尾部结构域能与许多功能蛋白结合,目前已经报道的有N e t r i n-1受体D C C[2]、BMP受体A L K 6[3-4]、I n t e g r i n[5-7]及微管等.已有的实验证明:M y oⅩ定位在细胞的板状伪足、膜褶皱和丝足顶端,通过与肌动蛋白的结合及M e n a/VA S P的运输参与丝足的形成与延伸过程[8].一系列的酵母双杂交、体外相互作用和哺乳动物细胞实验证明,M y oⅩ通过F E RM结构域与D C C及N e o g e n i n的胞内段P 3结构域结合,从而在N e t r i n-1-D C C介导的神经轴突导向和突起生长过程中发挥作用[9].最近的研究表明,在动物大脑发育过程中还有另一种相对分子质量为165000左右的无头形式的M y oⅩ[10-11],同全长的M y oⅩ相比,这种无头形式的M y oⅩ缺少头部动力区,因此不具备分子马达的功能[12].但是这两种形式的M y oⅩ是如何被转录调控的,目前尚不清楚.
半抗原又称不完全抗原,是指具有抗原性而无免疫原性的物质.半抗原能与相应抗体结合产生抗原-抗体反应,但是半抗原本身相对分子质量过小,无法刺激机体产生免疫反应.用化学方法把半抗原与具有免疫原性的大分子蛋白-载体相结合以后,半抗原就构成了载体的一个新的表位,这种半抗原-载体复合物便能刺激免疫反应发生.
M y oⅩ的相对分子质量比较大,抗原表位比较复杂,为了研究M y oⅩ分子在肿瘤发生和神经发育中的作用,本文利用P l o t o f P r o t e i n H y d r o p a t h i c P r o f i l e软件对M y oⅩ序列进行了分析,选取了N端的21个氨基酸,以此多肽为免疫原制备了兔抗M y oⅩ多克隆抗体,并对其进行了鉴定和初步应用,为研究M y oⅩ在组织及细胞中的表达和分布提供了有效的手段.
2011-05-25
国家自然科学基金资助项目(30871302;301170142);吉林省自然科学基金资助项目(200805130).
张建华(1986—),女,硕士研究生;通讯作者:朱筱娟(1966—),女,博士,教授,博士研究生导师,主要从事神经发育研究.
