转化生长因子β1和Smad4蛋白在肝癌组织中的表达及其意义
2012-09-07马洪波陈伟瑜
马洪波,黄 涛,韩 风,陈伟瑜
我国约有90%的肝癌患者具有乙型肝炎背景,部分患者存在丙型肝炎病毒 (HCV)、乙型肝炎病毒 (HBV)以及丁型肝炎病毒 (HDV)的重叠感染,其在经过长期的慢性炎症后可逐渐演变为肝硬化等。现代分子生物学研究发现,转化生长因子β1-抑癌基因 (TGF-β1-Smad)信号通路在肝纤维化、肝炎、肝硬化过程中扮演着重要角色,是目前分子生物学研究的热点之一[1]。Smad4蛋白由DPC4基因编码,是一类对TGF-β1信号起转导作用的胞质信号级联效应分子,具有受体激活型效应的Smad(R-Smad)受到信号刺激后会发生磷酸化,导致蛋白自身的构象发生变化并与同型的Smad4蛋白相互结合而形成寡聚体,寡聚体转位入核之后则参与调控很多靶基因的表达,发挥TGF-β1-Smad信号通路的调控效应;而抑制型的Smad(I-Smad)也必须和Smad4蛋白进行相互作用后才可抑制TGF-β1信号向下一级传递[2-3]。DPC4基因所编码的蛋白即Smad4蛋白对整个TGF-β1-Smad信号转导途径起关键作用,该基因的表达异常会引发细胞无限增殖的现象,研究TGF-β1与Smad4蛋白在肝癌组织中的表达具有重要意义。
1 资料与方法
1.1 一般资料 选取2008年3月—2011年4月我院收治的肝癌患者54例,其中男31例,女23例,年龄24~67岁,平均44.9岁。肿瘤分期:Ⅰ期14例,无显著肝癌症状和体征;Ⅲ期19例,有腹腔积液、黄疸、远处转移、恶液质症状之一;Ⅱ期21例,症状介于Ⅰ期与Ⅲ期之间。患者的肝癌组织均在术后冷冻保存备用;同时选取患者的癌旁组织分别编号冷冻后备用。
1.2 方法
1.2.1 试剂与仪器 浓缩型兔抗人TGF-β1和Smad4蛋白单克隆抗体均购自Sigema公司,工作浓度为1∶200。原位杂交检测试剂盒、二氨基联苯胺 (DAB)试剂盒、链霉亲和素-过氧化复合物 (ABC)等购自罗氏公司。
1.2.2 实验方案 采用原位杂交显色法 (IHCABC法),TGF-β1以及Smad4一抗工作浓度均为1∶200,行DAB显色及常规原位杂交 (ISH)。以磷酸盐缓冲液 (PBS)为阴性对照,以有淋巴结转移的癌组织作为阳性对照。蛋白质原位杂交与RNA原位杂交按照《分子克隆实验指南》[4]进行。对肝癌组织及癌旁组织Smad4 mRNA和Smad4蛋白表达量进行分析,确定肝癌组织及癌旁组织中DPC4基因在转录和翻译水平上是否存在差异,即Smad4 mRNA和Smad4蛋白的差异。若存在差异 (已经预实验证实),则进一步探讨Smad4蛋白与TGF-β1的相关性,寻找二者的关系。
1.3 结果判定 在400倍光镜下随机选取8个视野进行拍照,胞质及胞膜上出现棕黄色颗粒为阳性,阳性细胞的结构必须清晰,着色明显且定位准确,计算阳性染色面积所占比例,阳性细胞面积占总面积的80%及以上计4分;占总面积的50%~79%计3分;占总面积的10%~49%计2分;小于总面积的10%计1分;不着色为阴性,计0分。同时进行光密度半定量分析,并求得其平均值,按阳性信号的强度计分,阴性计0分,弱阳性计2~3分,中度阳性计4~5分,强阳性计6~7分。阳性面积评分和信号强度评分的乘积为总分,总分≤5分为低表达,>5分为高表达。
1.4 统计学方法 采用SPSS 13.0软件进行统计学处理,计量资料以 (±s)表示,采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 肝癌组织及癌旁组织中Smad4蛋白及Smad4 mRNA的表达和半定量结果 Smad4蛋白在肝癌组织中高表达21例,高表达率为38.9%;癌旁组织中高表达25例,高表达率为46.3%,两种组织中Smad4蛋白高表达率比较,差异有统计学意义 (χ2=16.59,P=0.01);Smad4 mRNA在肝癌组织中高表达28例,高表达率为51.9%;癌旁组织中高表达36例,高表达率为66.7%,两种组织中Smad4 mRNA高表达率比较,差异有统计学意义 (χ2=7.83,P=0.01)。肝癌组织中Smad4蛋白阳性面积与癌旁组织比较,差异无统计学意义 (P>0.05),光密度值比较,差异有统计学意义 (P<0.05);肝癌组织中Smad4 mRNA阳性面积和光密度值与癌旁组织比较,差异均有统计学意义 (P<0.05,见表1)。
表1 肝癌组织及癌旁组织中Smad4蛋白及Smad4 mRNA的表达和半定量结果 (±s,n=54)Table 1 The expression and semi-quantitative results of Smad4 gene and Smad4 mRNA in HCC tissues and adjacent noncancerous tissues
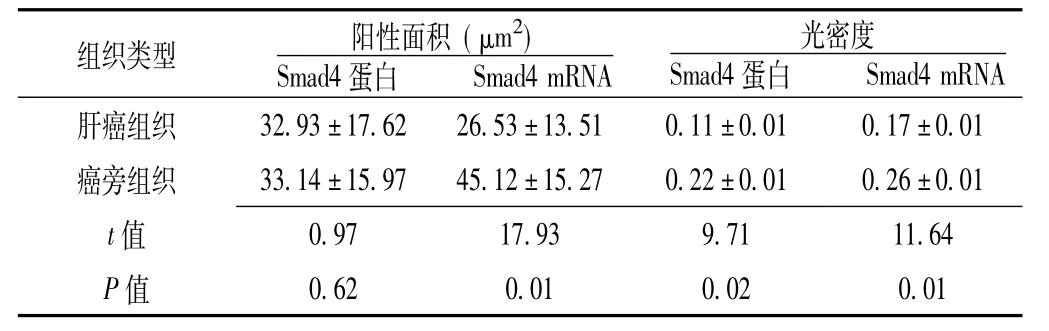
表1 肝癌组织及癌旁组织中Smad4蛋白及Smad4 mRNA的表达和半定量结果 (±s,n=54)Table 1 The expression and semi-quantitative results of Smad4 gene and Smad4 mRNA in HCC tissues and adjacent noncancerous tissues
组织类型 阳性面积 (μm2)Smad4蛋白Smad4 mRNA肝癌组织 32.93±17.62 26.53±13.51 0.11±0.01 0.17±0.01 Smad4 mRNA光密度Smad4蛋白癌旁组织 33.14±15.97 45.12±15.27 0.22±0.01 0.26±0.01 t 0.97 17.93 9.71 11.64 P值值0.62 0.01 0.02 0.01
2.2 肝癌组织中TGF-β1表达和Smad4蛋白表达与临床病理特征的关系 肝癌组织中TGF-β1和Smad4蛋白高表达率在男女间,差异均无统计学意义 (P>0.05);以45岁为界,肝癌组织中TGF-β1和Smad4蛋白高表达率在不同年龄间比较,差异均有统计学意义 (P<0.05);在不同病理分期间比较,差异亦均有统计学意义 (P<0.05),且随着病理分期增加,TGF-β1和Smad4蛋白高表达率明显升高 (见表2)。
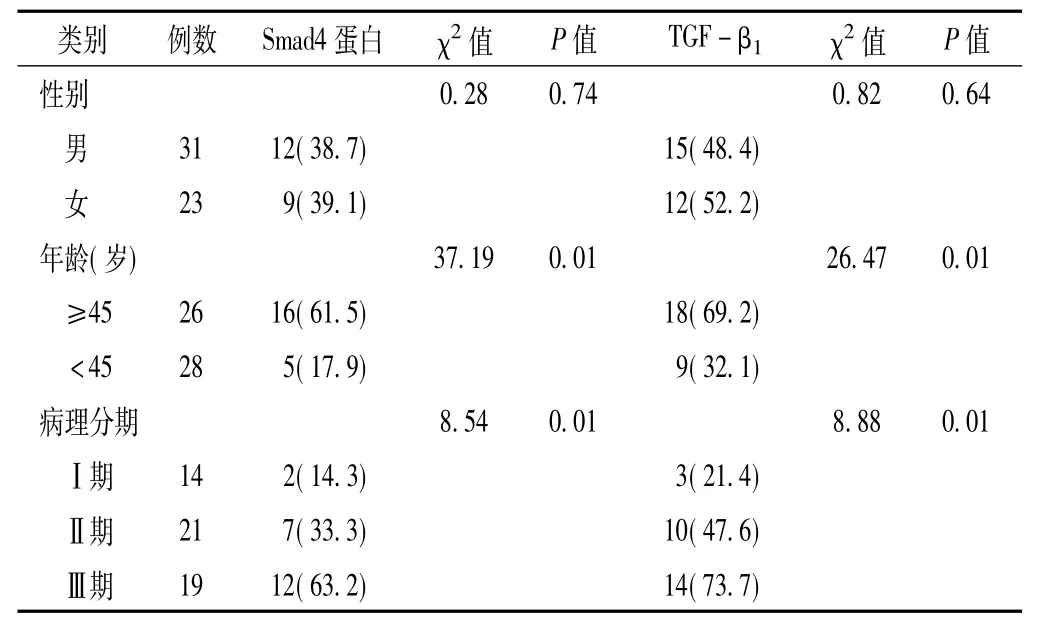
表2 肝癌组织中TGF-β1表达和Smad4蛋白表达与病理特征的关系〔n(%),n=54〕Table 2 Relationship between the expression of TGF-β1and Smad4 protein in HCC tissues and clinical pathological features
3 讨论
肿瘤的发生发展是多因素、多基因表达共同变化的过程,主要与癌基因的激活及抑癌基因的失活或受抑制有关,细胞增殖和细胞信号转导途径在其中扮演着重要角色[5-6]。TGF-β1对细胞的调控机制非常复杂,主要通过多条信号转导通路来完成,在这些信号转导通路中有TGF-β1以及相关受体蛋白尤其是Smad蛋白家族参与。这些作用分子的功能及状态影响着细胞对生长调节信号的传导、应答及反馈。TGF-β1参与细胞的多种基因调控,是很多与肿瘤组织生长有关的负调节因子,在人体细胞分化以及恶性肿瘤行为中具有重要作用。DPC4基因是在上个世纪由Hongmei等[7]发现的新型抑癌基因,是TGF-β1-Smad信号通路的关键转录因子,可看做是一个中心分子。而Smad 4蛋白能够与Smad家族成员的任意一种发生相互作用,一旦DPC4基因发生缺失、突变或沉默,将导致其功能丧失,进而导致整个信号通路甚至整个细胞代谢发生紊乱,最终形成肿瘤[8]。受 DPC4基因调控的下游基因有 p21、TSP1等。p21是细胞周期蛋白依赖性激酶的抑制物,能够抑制CDK与细胞周期蛋白形成复合物,并使细胞生长停留在G1期,进而调控细胞的分裂增殖。其他下游基因主要调控一些细胞的增殖分化、凋亡以及血管生成。胃癌、胰腺癌、乳腺癌等均与DPC4基因的缺失和突变有关,TGF-β1-Smad信号通路对于肿瘤的发生发展极其重要[10-12]。
本研究结果显示,肝癌组织中Smad4蛋白高表达率和半定量结果均低于癌旁组织,说明肝癌细胞内部DPC4基因呈低表达甚至不表达,使得TGF-β1-Smad信号通路受阻,进而导致机体对肝癌细胞的分裂、分化和增殖失去控制。如果肝癌细胞能重新正常表达DPC4基因,可能会有效地抑制肝癌的进一步发展。肝癌组织中TGF-β1和Smad4蛋白高表达与患者性别无关,而与病理分期和年龄增长 (≥45岁)有关。但本研究样本例数有限,所采用的方法本身存在一定的局限性,只能揭示Smad4蛋白在肝癌组织和癌旁组织的表达特征,要想得到Smad4蛋白与肝癌发生关系的直接证据,需构建DPC4基因表达载体,进一步研究其在肝癌组织中的病理变化,深入探讨TGF-β1和Smad4蛋白的作用。
1 Samarakoon R,Chitnis SS,Higgins SP,et al.Redox- induced Src kinase and caveolin-1 signaling in TGF-β1-initiated SMAD 2/3 activation and PAI- 1 expression [J].PLoS One,2011,6(7):e22896.
2 Wang QL,Tao YY,Yuan JL,et al.Salvianolic acid B prevents epithelial-to-mesenchymal transition through the TGF-beta1signal transduction pathway in vivo and in vitro [J].BMC Cell Biol,2010,11:31.
3 Mickey M,Martin,Jessica A,et al.Elton TGF - β1stimulates human AT1 receptor expression in lung fibroblasts by cross talk between the Smad,p38 MAPK,JNK,and PI3K signaling pathways[J].Am J Physiol Lung Cell Mol Physiol,2007,293(3):L790 -L799.
4 黄培堂译.分子克隆实验指南 (上下册) [M].科学出版社,2005:1012-1633.
5 Piyali Mukherjee,Sherry L,Winter,et al.Cell cycle arrest by transforming growth factor β1near G1/S is mediated by acute abrogation of prereplication complex activation involving an Rb-MCM interaction[J].Mol Cell Biol,2010,30(3):845 -856.6 Huang WC,Yen FC,Shie FS,et al.TGF -β1blockade of microglial chemotaxis toward Aβ aggregates involves SMAD signaling and downregulation of CCL5 [J].J Neuroinflammation,2010,7:28.
7 Hongmei Peng,Oscar A,Carretero,et al.Ac- SDKP inhibits transforming growth factor-β1-induced differentiation of human cardiac fibroblasts into myofibroblasts [J].Am J Physiol Heart Circ Physiol,2010,298(5):H1357-H1364.
8 陈国平,夏立平.TGF-β/Smads信号转导途径与肿瘤的关系[J].海南医学院学报,2009,15(1):91.
9 夏立平,刘晓力,陈国平,等.TGF-β1、TGF-βR1、Smad4在乳腺癌发生、发展中的作用及其相互关系[J].海南医学院学报,2010,16(6):693-698.
10 丁平,宋炳红,朱利敏,等.TGF-β/Smad4基因信号通路对结直肠癌肿瘤细胞株转移潜能影响的研究[J].中华肿瘤防治杂志,2011,18(19):1519-1521.
11 程朋,曾维政,苏晓妹,等.TGFβ1与Smad4基因在肝细胞癌中的表达及意义 [J].临床肿瘤学杂志,2009,14(7):609-613.
12 陈桂敏,王少贤.肝纤维化TGF-β1/smad信号通路中医药研究进展[J].海南医学院学报,2010,16(6):810-812.
