响应曲面法优化莲房原花青素提取工艺研究
2012-09-07陈卫航谭美亭
陈卫航,谭美亭,张 婕
(郑州大学化工与能源学院,河南郑州450001)
原花青素(Procyanidins,简称PC)是一类多酚化合物的总称,由不同数量的儿茶素或表儿茶素缩合而成[1].原花青素是目前国际上公认的清除人体内自由基最有效的天然抗氧化剂之一,其抗氧化能力是维生素E的50倍以上,是维生素C的20倍以上[2].莲房为莲科药用植物莲的成熟花托,含有丰富的原花青素(Procyanidins of Lotus Seed Pot,简称LSPC),含量达7.8%[3],在莲加工过程中,大量的莲房被丢弃,资源未被充分利用.从莲房中提取PC实际上属于废弃物利用,研究莲房原花青素的提取工艺不仅具有很大的科学价值,还会带来巨大的经济效益.目前,关于莲房PC的研究还处于起步阶段,主要在药理作用方面[4-5].据文献报道,莲房中原花青素的提取方法有微波辅助丙酮提取法[6]、脉冲超声辅助丙酮提取法[7]和双酶辅助乙醇提取法[8],但关于单一乙醇提取法提取莲房中原花青素并采用响应面法优化工艺条件的研究鲜见报道.笔者以废弃物莲房为原料,采用乙醇作为提取剂提取,并利用响应面分析法[9]优化莲房中原花青素的最佳提取工艺参数,以期为莲房原花青素的工业化生产提供依据.
1 材料与方法
1.1 实验材料与仪器
干燥莲房:购于河北安国市中药材市场;
试剂:原花青素标准品(四川维克奇生物有限公司)、香草醛、甲醇、乙醇、浓盐酸,均为分析纯;仪器:RE-52A旋转蒸发器(上海亚荣生化仪器厂)、AB204-N电子分析天平(梅特勒-托利多仪器有限公司)、UV-1810S紫外分光光度计(北京普析通用仪器有限责任公司)、THZ-82数显水浴恒温振荡器(江苏城西晓阳电子仪器厂).
1.2 实验方法
1.2.1 原花青素标准曲线测定
采用香草醛—浓盐酸显色法[10]:精确称取原花青素标准品配制成1.0 mg/mL对照品标准溶液,再配制成40~200 μg/mL浓度对照品标准系列.在10 mL反应瓶中依次加入20 g/L香草醛溶液2.5 mL、浓盐酸2.5 mL,冷却后加入原花青素标准溶液1 mL,混合均匀后在20℃下避光显色反应20 min.以香草醛/甲醇、浓盐酸和甲醇的体积比为2.5∶2.5∶1.0混合溶液作为空白对照,在500 nm处测吸光度.以吸光度为纵坐标,莲房原花青素浓度为横坐标绘制标准曲线方程:y=0.004 24x-0.022 86,R2=0.999 97.
1.2.2 莲房原花青素的提取
称取脱脂莲房2.00 g,按一定料液比加入乙醇水溶液,在设定温度下恒温搅拌浸提一定时间后,抽滤,保存滤液,将滤渣重复提取,提取2次,合并滤液,定容稀释后测定莲房原花青素浓度,并计算原花青素提取量.
1.2.3 原花青素含量的测定
原花青素含量测定采用香草醛-浓盐酸显色法[10].莲房原花青素(LSPC)提取量 Y=VCn100/(1 000×W).式中:Y为每100 g莲房中得到莲房原花青素量,mg/100 g;V为提取液体积,mL;C为提取液中莲房原花青素浓度,mg/mL;n为提取液稀释倍数;W为莲房重量,g.
1.2.4 单因素和响应曲面法试验设计
以乙醇体积分数、液料比、提取温度、提取时间为影响因素,考察其对莲房原花青素提取量的影响.根据单因素实验结果,设计4因素3水平的响应面优化实验.为考察方便,提取次数均为1次,试验均设3次重复,取平均值.
2 结果与分析
2.1 单因素试验结果
选定实验条件为乙醇体积分数为50%,温度为50℃,时间为2 h,液料比为20 mL/g.在保持其中3个因素固定的条件下,变化另一个因素,分别研究乙醇体积分数、液料比、提取温度、提取时间的变化对莲房原花青素提取量的影响,结果如图1所示.由图1可知,随着乙醇体积分数、液料比、提取温度、提取时间的增加,原花青素提取量也相应增加,当乙醇体积分数为50%,液料比为20 mL/g,提取温度为55℃,提取时间为50 min时,莲房原花青素有最大提取量.故取乙醇体积分数40%~60%、液料比15~25 mL/g、提取温度45~65℃、提取时间为40~60 min范围内进行响应曲面实验.
2.2 响应曲面法设计方案与试验结果
根据Box-Behnken试验设计原理,在单因素试验的基础上,选取乙醇体积分数、液料比、提取温度和提取时间4个因素为自变量,分别用X1、X2、X3、X4表示,以莲房原花青素提取量为响应值Y,并以1、0、-1分别代表自变量的高、中、低水平,因素编码及各自变量水平见表1,试验方案及结果见表2.

图1 (a)乙醇体积分数的影响(温度50℃,时间2 h,液料比20 mL/g)

图1 单因素对LSPC提取量的影响Fig.1 Effects of factors on LSPC extraction yield

表1 响应曲面分析因素与编码水平Tab.1 Factors and levels of response surface methodology
实验设计共29个实验点,其中1~24为析因点,25~29为零点,析因点在变量取值为X1、X2、X3、X4所构成的三维顶点 ,零点为区域的中心点,其中零点实验重复5次,用以估算实验误差.
2.3 二元回归方程拟合和方差分析
利用Design Expert7.1.6软件对表2数据进行二次多元回归拟合,得到莲房原花青素提取量预测值对编码自变量的二次多项回归方程:
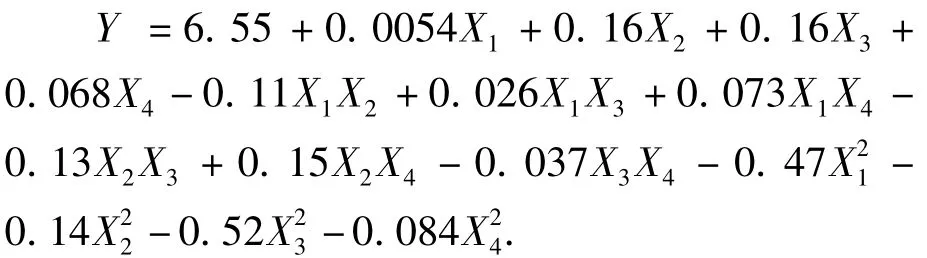
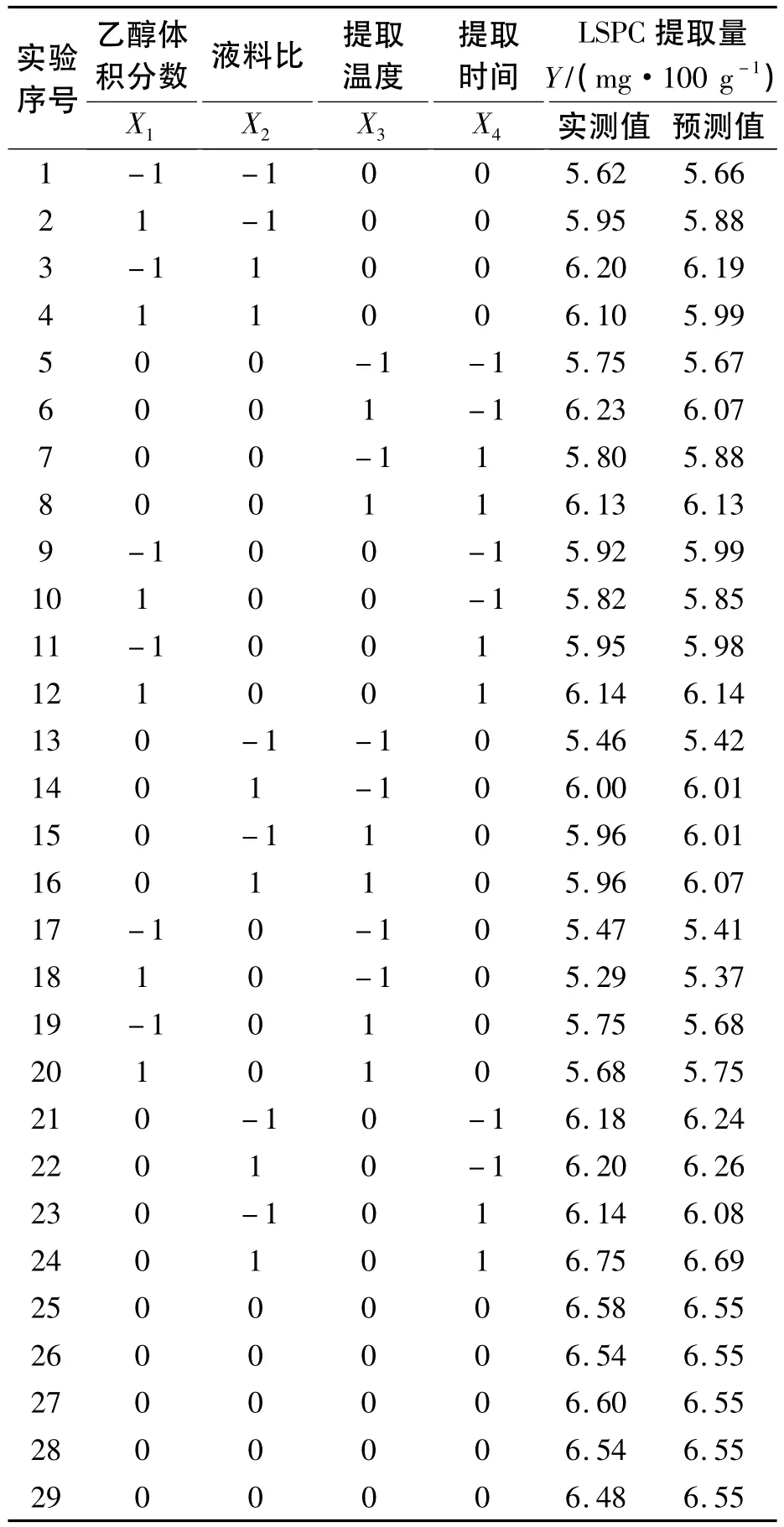
表2 响应曲面法优化LSPC提取工艺分析方案与试验结果Tab.2 The experimental design and results of response surface methodology on LSPC extraction technology
模型的可靠性可从方差分析(表3)及相关系数来考察.结果表明,模型是极显著的 (P<0.01),回归模型的决定系数为0.967 9,说明回归方程可以很好地描述各因素与响应值之间的真实关系.因此,可利用此回归方程确定莲房原花青素最佳提取工艺条件.
回归方程中各变量对响应值影响的显著性,由F检验法判定,概率 P的值越小,则相应变量的显著性程度越高.从表3可以看出,一次项X2、X3是极显著(P <0.01),X4是显著(P < 0.05),二次项 X1X2、X2X3是显著,X2X4是极显著是极显著,是显著,其余项均不显著.因此,各具体试验因子对响应值的影响不是简单的线性关系.从 F值可以看出,单因素对原花青素提取量的影响顺序依次是提取温度 >液料比>提取时间>乙醇体积分数.

表3 响应面法优化LSPC提取工艺方差分析结果Tab.3 The results of ANOVA on LSPC extraction technology
2.4 交互作用分析
图2是根据回归方程所绘制出各因素交互作用的响应面图,其投影面为等高线图.对比可知,提取温度对莲房原花青素提取量的影响最为显著,表现为图2(b)、2(d)、2(f)的曲面较为陡峭,这说明要获得良好的提取效果,在提取过程中对提取温度的控制至关重要.由图2(e)可以直观地反映出液料比与提取时间之间交互作用相当显著,表现为该图等高线的椭圆形状最为显著,而乙醇体积分数与料液比、液料比与提取温度之间交互作用也是显著的.这些结果都与回归方程的方差分析相吻合,说明响应面优化设计能够较好地反映出试验所设定的四个因素对莲房原花青素提取量的影响.


2.5 最优工艺条件及验证试验
利用Design Expert7.1.6软件根据所建立的数学模型进行参数最佳化分析,得到最优提取工艺条件为:乙醇体积分数为50%,液料比25 mL/g,提取温度55℃,提取时间60 min,提取1次,进行4次重复验证试验,测得莲房原花青素提取量为6.678 mg/100 g,与理论预测值6.693 mg/100 g接近.因此,采用响应面分析法优化得到的工艺可行,参数准确可靠,具有实用价值.
3 结论
在单因素实验基础上,采用响应面分析法设计实验,对莲房原花青素提取工艺参数进行优化,建立莲房原花青素提取量的二次多项式数学模型,模型具有显著性,模型决定系数为0.967 9.由Design Expert7.1.6软件对数学模型进行参数最优化分析并结合生产实际,得到莲房原花青素提取的最佳工艺条件为乙醇体积分数为50%、液料比25 mL/g、提取温度55℃、提取时间60 min,提取1次,实际提取产量为6.678 mg/100 g,与理论预测值6.693 mg/100 g接近.本研究为工业化利用丰富的莲房资源提取原花青素提供了依据.
[1]高羽,董志.原花青素的药理学研究现状[J].中国中药杂志,2009,34(6):651-655.
[2]BAGCHI D,GARG A,KROHN RL,et al.Oxygen free radical scavenging abilities of vitamins C and E and a grape seed proanthocyanidin extract in vitro[J].Res Commun Mol Pathol Pharmacol,1997,95(2):179-189.
[3]凌智群.莲房原花青素及其生物、药理活性研究[D].武汉:华中农业大学食品科学系,2001.
[4]GONG Yu-shi,LIU Lie-gang ,XIE Bi-jun,et al.A-meliorative effects of lotus seedpod proanthocyanidins on cognitive deficits and oxidative damage in senescence-accelerated mice[J].Behavioural Brain Research,2008,194(1):100-107.
[5]DUAN Yu-qing,ZHANG Hai-hui,XU Fei-fei,et al.Inhibition effect of procyanidins from lotus seedpod on mouse B16 melanoma in vivo and in vitro[J].Food Chemistry,2010,122(1):84-91.
[6]段玉清,闫永胜,张海晖,等.莲房多酚的微波辅助提取技术[J].江苏大学学报,2009,30(9):437-440.
[7]段玉清,张海晖,李金凤,等.脉冲超声辅助提取莲房多酚的工艺[J].农业工程学报,2009,25(1):193-197.
[8]汪志慧,孙智达,谢笔钧,等.响应曲面法优化双酶法提取莲房原花青素[J].食品科学,2010,32(4):64-68.
[9]杨文雄.响应面方法及其在食品工业中的应用[J].中国食品添加剂,2005(2):68-71.
[10]郑俊霞,肖付才,李华.香草醛-HPLC结合法测定葡萄籽超微粉中的原花青素[J].食品科技,2009,34(11):304-308.
