瑞舒伐他汀对晚期内皮祖细胞增生、迁移及凋亡的影响
2012-09-05刘文娴
盛 瑾 刘文娴 李 鹏
(首都医科大学附属北京安贞医院心内科监护室,北京100029)
1997年,Asahara等[1]从人外周血中分离得到一类具有内皮细胞及祖细胞特性的细胞,将其命名为内皮祖细胞(endothelial progenitor cells,EPCs)。随后发现根据细胞形态、表面标记和增生能力的不同,EPCs分为早期 EPCs和晚期 EPCs[2]。大量的动物和临床试验[3]表明,EPCs是维持内皮完整性和血管自身平衡的重要部分。晚期EPC较早期EPCs形成管腔能力和增生能力更强,可最终生成血管内皮细胞,参与血管新生,修复受损内皮的功能可以更好的促进心肌梗死后心肌的修复。作为新一代的他汀药,瑞舒伐他汀已经被证实拥有更强的降脂及稳定、部分逆转粥样斑块和改善血管内皮功能的治疗价值[4],但其是否对晚期EPCs的功能具有改善作用,国内外相关研究较少,因此我们进行本项研究,探讨不同浓度、不同作用时间瑞舒伐他汀对晚期EPCs的增生、迁移和凋亡的影响。
1 材料与方法
1.1 试剂与器材
1.1.1 试剂
EPC培养基(endothelium basis medium 2,EBM-2;美国Sigma公司),胰蛋白酶和胎牛血清(美国Gibco公司),人纤维连接蛋白(美国Sigma公司),人淋巴细胞分离液(英国Amersham Pharmacia公司),FITC标记的荆豆凝集素(FITC-ulex europaeus agglutinin,FITC-UEA-I;美国Sigma公司),Dil标记的乙酰化低密度脂蛋白(Dil-acetylated low density lipoprotein,Dil-acLDL;美国Molecular Probe公司),苯基四氮唑溴盐(华美生物工程公司),二甲基亚砜(美国Sigma公司),Transwell小室(美国 Sigma公司),TUNEL试剂盒(美国 罗氏公司),瑞舒伐他汀(阿斯利康公司)。
1.1.2 主要器材
荧光倒置显微镜(德国 Leica 4000B型),荧光正置显微镜(日本OlympusBX-51),CO2细胞培养箱(日本三洋公司产品),酶标检测仪(德国 Beckman公司),超净工作台(北京昌平长城净化空气仪器厂),离心机(上海安亭科学仪器厂TGL-16C)。细胞培养板、离心管、培养皿等耗材购自美国Corning公司。
1.2 方法
1.2.1 研究对象
健康雄性Wistar大鼠,体质量180~220 g,8~12周,购自斯贝福(北京)实验动物科技有限公司,实验动物许可证号:13706。
1.2.2 晚期EPCs的培养和分离
将健康Wistar大鼠处死后,取下肢长骨骨髓,加到淋巴细胞分离液中,离心,吸取单个核细胞层,置入EBM-2中,重悬细胞,然后接种于纤维连接蛋白预包被的6孔板中。每隔2 d换液,用PBS洗除非贴壁细胞,继续培养至28 d,再加PBS洗除非贴壁细胞,实验时取对数生长期细胞[5]。
1.2.3 细胞染色及鉴定
在细胞培养第28 d,用体积分数4%多聚甲醛固定,洗涤,应用体积分数0.1%Triton-100打孔,将贴壁细胞与 Dil-acLDL(2.4 mg·L-1)孵育;将 FITCUEA-I(10.0 mg·L-1)加入标本中,孵育1 h,最后用体积分数50%甘油封片,应用荧光显微镜观察。镜下Dil-acLDL染色细胞呈红色,FITC-UEA-I染色细胞呈绿色,DAP染色细胞I呈蓝色,3种染色均为阳性的细胞可鉴定为正在分化的晚期EPCs。
1.2.4 试验分组及药物干预
1)药物配制:瑞舒伐他汀以无水乙醇溶解后,再加入与瑞舒伐他汀等摩尔的NaOH,50℃水浴2 h,调整pH值至7.20,过滤除菌,调节浓度至0.001、0.01、0.1、1.0、10、100 μmol/L 备用。
2)试验分组:(1)他汀不同浓度组:①对照组:以不含瑞舒伐他汀培养基与EPCs共培养,共培养时间与实验组一致。②实验组:以含不同浓度瑞舒伐他汀的培养基(分别为 0.001、0.01、0.1、1.0、10.0、100.0 μmol/L)与晚期EPCs共培养24 h。(2)他汀共培养不同时间组:①对照组:以含0.1 μmol/L瑞舒伐他汀的培养基与晚期EPCs共培养0 h。②实验组:以含0.1 μmol/L瑞舒伐他汀的培养基与晚期EPCs共培养不同时间 (分别为 1、3、6、12、24、48 h)。
1.2.5 晚期EPCs增生能力的检测
将同等数目的晚期EPCs(2×103)接种于96孔板,每孔加培养液100 μL,培养24 h细胞贴壁后分别加入不同浓度的瑞舒伐他汀,每组设4个复孔,设不加药物的阴性对照组;继续培养24 h后,加入体积分数5%苯基四氮唑溴盐10 μL,继续培养4 h;加二甲基亚砜100 μL,室温下脱色摇床上振荡10 min溶解,置酶标检测仪测定450 nm处的吸光度(A),比较各组间的增生功能的差异。
1.2.6 晚期EPCs迁移能力的检测
将同等数目的晚期 EPCs(2×104)悬于100 μL培养液中,注入Transwell小室的上室;将含有血管内皮生长因子(50 μg·L-1)的500 μL培养液加入到下室,孵育24 h后取出,刮去上层未移动细胞,用体积分数4%多聚甲醛固定10 min,Giemsa染色30 min,去离子水清洗后晾干,倒置显微镜下随机选择3个连续高倍视野(200×),计数迁移至底层的EPCs,比较各组间迁移功能的变化。
1.2.7 晚期EPCs凋亡能力的检测
应用TUNEL试剂盒进行凋亡检测:用4%的多聚甲醛固定1 h,PBS缓冲液漂洗,加入3%H2O2阻断液20℃作用10 min,加穿孔液于4℃作用30 min,加50 μL TUNEL反应混合液,加覆盖膜,湿盒中37℃作用1 h,加50 μL 转换POD 溶液,加50 μL DAB 底物,避光显色1~2 min,根据显色情况及时用PBS漂洗后在显微镜下观察。TUNEL阳性的细胞比例由在3个不同的视野数至少200个细胞来确定。重复试验3次。
1.3 统计学方法
应用SPSS 13.0软件进行数据处理及分析,实验数据用均数±标准差(±s)表示,计量资料多组间比较采用单因素方差分析,计数资料多组间比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 晚期EPCs的生物学特征
培养2 d后大部分(70% ~80%)早期EPCs贴壁;细胞呈圆形,体积较小(图1A);培养至第7~8天,细胞体积增大,透亮度增强,呈现梭形早期EPCs(图1B);第27~28天,呈现铺路石样晚期EPCs(图1C)。

图1 光镜下早期EPCs与晚期EPCs的细胞形态Fig.1 Cell morphology of early EPCs and late EPCs in optical microscope
2.2 晚期EPCs的荧光染色鉴定
晚期EPCs具有吞噬功能,可吞噬Dil标记的乙酰化低密度脂蛋白(Dil-acLDL)以及FITC标记的荆豆凝集素(FITC-UEA-I)。在荧光显微镜下,Dil-acLDL呈红色(图2A),FITC-UEA-I呈绿色(图2B),DAPI细胞核染色呈蓝色(图2C)。据此,可鉴定为正分化的晚期EPCs(图2D)。

图2 晚期EPCs荧光染色鉴定Fig.2 Fluorescent staining demonstrated late endothelial progenitor cells
2.3 瑞舒伐他汀对晚期EPCs增生功能的影响
MTT法检测晚期EPCs增生功能变化,结果显示:与对照组(A值为0.227±0.006)相比,加入不同浓度瑞舒伐他汀(分别为 0.001、0.01、0.1、1.0、10.0、100.0 μmol/L)培养细胞24 h后,均能改善 EPCs的增生活性(P<0.05)。EPCs的增生活性在0.1 μmol/L组增加最明显(P<0.01),并且0.1 μmol/L组与其他各组比较,差异均有统计学意义(P<0.05)。而当继续增加瑞舒伐他汀浓度时,EPCs的增生活性反呈下降趋势,但100 μmol/L组(A值为0.274±0.010,P<0.01)仍高于对照组(图3A)。
0.1 μmol/L瑞舒伐他汀处理晚期EPCs持续不同时间(分别为 1、3、6、12、24、48 h)后,除 1 h 组与对照组相比差异无统计学意义外,细胞的增生功能随处理时间的延长而增强,显示了时间依赖性(P<0.05),48 h效果最强(A值为0.300±0.008,P<0.01)(图3B)。瑞舒伐他汀可显著地改善晚期EPCs的增生功能,且呈浓度依赖性(F=64.11,P<0.01)和时间依赖性(F=62.22,P <0.01)。

图3 瑞舒伐他汀对晚期EPCs增生功能影响Fig.3 Effects of rosuvastatin on late EPCs proliferation
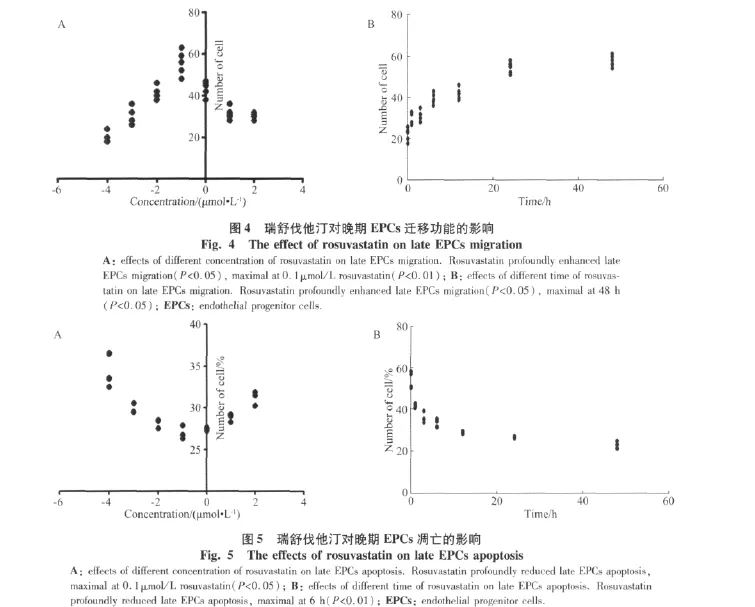
2.4 瑞舒伐他汀对晚期EPCs迁移功能的影响
采用Transwell小室检测瑞舒伐他汀对晚期EPCs迁移功能的影响,发现各浓度(分别为0.001、0.01、0.1、1.0、10.0、100.0 μmol/L)瑞舒伐他汀共培养 24 h后均明显改善EPCs的迁移功能(P<0.05)。当浓度为0.1 μmol/L时,瑞舒伐他汀改善作用最强(P<0.01);当随浓度增高,改善作用无明显提高;而当继续增加瑞舒伐他汀浓度时,EPCs的增生活性反呈下降趋势,与浓度为0.1 μmol/L时相比,浓度为100.0 μmol/L的瑞舒伐他汀提高晚期EPCs的迁移功能差异无统计学意义(P=0.06)(图4A)。
当浓度为0.1μmol/L的瑞舒伐他汀与晚期EPCs共培养(分别为 1、3、6、12、24、48 h)不同时间后,其明显提高晚期 EPCs迁移功能;与对照组相比(N=22.2±3.2),提示细胞的迁移功能随处理时间的延长而增强,显示了一定时间依赖性(P<0.05),24~48 h效果最佳,与对照组相比(N=22.2±3.2),共培养48 h后,其迁移功能显著提高(N=48.6±3.4,P<0.01)(图4B)。瑞舒伐他汀可显著改善晚期EPCs的迁移功能,且呈浓度依赖性(F=16.83,P<0.01)和时间依赖性(F=54.64,P <0.01)。
2.5 瑞舒伐他汀对晚期EPCs凋亡功能的影响
TUNEL试剂盒检测细胞凋亡功能,结果为:当共培养24 h后,瑞舒伐他汀浓度自0.001 μmol/L~100.00 μmol/L均能增强EPCs抗凋亡能力(P<0.05),随浓度升高,瑞舒伐他汀降低凋亡功能增强;当浓度为0.1 μmol/L时,晚期EPCs凋亡率最低(P<0.01);但随浓度进一步升高(分别为1.0、10.0、100.0×10-4μmol/L),凋亡率无明显降低(图5A)。浓度为100.0 μmol/L和浓度为0.1 μmol/L的瑞舒伐他汀,对晚期EPCs凋亡功能降低程度相似(P=0.22)。当浓度为0.1 μmol/L时,与对照组(凋亡率为33.22±0.91)相比,瑞舒伐他汀随培养时间延长(分别为 1、3、6、12、24、48 h)均可改善晚期EPCs的凋亡功能。当共培养6 h,瑞舒伐他汀可显著降低细胞凋亡(凋亡率为26.96±0.81,P<0.01),但此时较共培养48 h的凋亡率无明显变化(P=0.06)。说明处理需持续一段时间才会对改善细胞凋亡有影响,随处理时间的延长抑制凋亡的作用能得到一定程度的改善,但继续延长时间抑制作用进入平台期,未得到进一步增强(图5B)。瑞舒伐他汀可显著降低晚期EPCs的凋亡功能,且具有浓度依赖性(F=31.20,P <0.01)和时间依赖性(F=69.33,P <0.01)。
3 讨论
EPCs主要存在于骨髓,也可来源于外周血、脾脏、脂肪等组织。主要功能是促进血管新生和维持内皮功能;与早期EPCs相比,晚期EPCs更成熟,增生能力更强,分泌更多一氧化氮(NO),形成新生血管能力更强[6]。本实验发现,培养2 d后细胞呈圆形、体积较小的单个核细胞;第7~8天时,变为梭形的早期EPCs,28 d时出现铺路石样的晚期EPCs;且可吞噬荧光染料FITC-UEA-I和Dil-acLDL,因此可鉴定为晚期EPCs。
冠状动脉粥样硬化性心脏病(以下简称冠心病)、高血压、糖尿病等患者的晚期EPCs数量减少、功能受损[6-8],HMGCoA还原酶抑制剂(即他汀类药)除了抑制胆固醇合成外,他汀类药物还有很多有益的心血管保护作用,例如改善内皮功能异常、增加一氧化氮(N0)生物利用率[9]。他汀对于内皮功能的改善作用已被实验证实,但机制尚待研究。而瑞舒伐他汀作为新一代的他汀已经被证实拥有更强的降脂效果及稳定、逆转粥样斑块,改善血管内皮功能的治疗作用[10],Werner等[3]观察到给予小鼠瑞舒伐他汀,其外周血循环早期内皮祖细胞计数在用药后24 h即有明显升高并持续到用药24 h后。同时瑞舒伐他汀明显促进颈动脉损伤的再内皮化并抑制血管内膜的过度增生。试验证明了瑞舒伐他汀能增强晚期EPCs增生、迁移的功能,抑制细胞的凋亡。与传统他汀如辛伐他汀、洛伐他汀相比,无需经肝脏代谢转化为活性二羟酸,因此可直接以非前体药物应用。
Llevadot等[11]发现,0.1μmol/L 辛伐他汀可明显改善早期EPCs的增生功能达19%(A值,0.47±0.04 vs 0.56±0.03;P<0.01),提高其迁移能力达12倍(细胞计数,5 ±4 vs 64 ±26;P <0.01);Loomans等[12]发现,0.1 μmol/L阿托伐他汀可将高血糖模型小鼠骨髓来源早期EPCs的数量恢复至正常(增加30% ~40%)。与Llevadot研究相比,本试验发现,瑞舒伐他汀改善晚期EPCs增生功能的作用更强(33%),也可提高细胞的迁移功能,证明瑞舒伐他汀能够明显提高晚期EPCs增生、迁移的功能,减少细胞的凋亡,体现了细胞功能的改善与药物浓度及作用时间的相关性。说明瑞舒伐他汀较传统他汀对EPCs同样存在保护作用,可以通过促进新生血管的形成而促进心肌梗死后心肌修复,为他汀类药物的心血管保护机制提供了更丰富的理论基础。但由于既往实验多为早期EPCs,故在改善EPCs细胞功能方面,瑞舒伐他汀是否优于传统他汀,还需要进一步研究实验证明。
本实验发现虽然高浓度(100 μmol/L)时瑞舒伐他汀细胞功能仍较对照组强,但随着浓度增加,高剂量的瑞舒伐他汀对晚期EPCs的保护作用已经降低。因为本实验为体外实验,与临床实验差距较大:首先实验对象为大鼠的内皮祖细胞,非人类的内皮祖细胞;其次本实验中瑞舒伐他汀直接处理细胞,而体内实验代谢较复杂,口服药量与血药浓度的关系估算困难,而且大鼠与人类的用药量或血药浓度关系直接以体质量换算可能欠妥,故本实验未能给出临床上瑞舒伐他汀的血药浓度与0.1 μmol/L这个最佳浓度的关系。但在相关临床研究中Hristov等[13]发现,冠心病患者高剂量(40 mg/d)、长期应用(>8周)他汀后,外周血中早期EPCs数量明显减少,且与他汀剂量明显相关。同样提示临床加大他汀药物剂量与血管内皮功能的改善可能不成正比。
受实验条件及时间限制,本实验未能涉及瑞舒伐他汀对晚期EPCs功能影响的机制问题。但现有实验发现,传统他汀可通过多种机制改善EPCs的功能,如:通过增多Akt磷酸化和NO量,改善体外培养的早期EPC的增生、迁移功能,降低凋亡水平[14]。但既往研究[15-17]多针对早期EPCs,且不同研究中所采用的药物及浓度不同,处理时间、实验方法也存在很多差异,实验结果亦不统一,因此关于瑞舒伐他汀对晚期EPCs功能影响的机制是否与既往文献一致尚需进一步证实。
结论:瑞舒伐他汀能够提高晚期内皮祖细胞的增生、迁移功能,减少细胞的凋亡,且具有一定的浓度及时间依赖性。
[1]Asahara T,MuroharaT,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-967.
[2]Mukai N,Akahori T,Komaki M,et al.A comparison of the tube forming potential of early and late endothelial progenitor cells[J].Exp Cell Res,2008,314(3):430-440.
[3]Werner N,Kosiol S,Schiegl T,et al.Circulating endothelial progenitor cells and cardiovascular outcomes[J].N Engl J Med,2005,353(10):999-1007.
[4]Ridker P M,Danielson E,Fonseca F A,et al.Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein[J].N Engl J Med,2008,359(21):2195-2207.
[5]Christophe Dubois,Xiaoshun Liu,Piet Claus,et al.Different effects of progenitor cell populations on left ventricular remodeling and myocardial neovascularization after myocardial infarction[J].J Am Coll Cardiol,2010,55(20):2232-2243.
[6]余跃.干细胞基础与临床[M].北京:中国科学技术大学出版社,2008:102-105.
[7]申琳,崔君.多廿烷醇和瑞舒伐他汀治疗老年高脂血症的成本一效果分析[J].临床误诊误治,2011,24(10):87-89.
[8]王惜诵,王龙彪.不同剂量氟伐他汀对慢性心力衰竭大鼠心肌组织血管紧张素Ⅱ和脑利钠肽水平影响的实验研究[J].解放军医药杂志,2011,23(1):1-3.
[9]Nissen S E,Nicholls S J,Sipahi I,et al.Effect of very high-intensity statin therapy on regression of coronary atherosclerosis:the ASTEROID trial[J].JAMA,2006,295(13):1556-1565.
[10]Jones P H,Hunninghake D B,Ferdinand K C,et al.Statin Therapies for Elevated Lipid Levels Compared Across Doses to Rosuvastatin Study Group.Effects of rosuvastatin versus atorvastatin,simvastatin,and pravastatin on nonhigh-density lipoprotein cholesterol, apolipoproteins,and lipid ratios in patients with hypercholesterolemia:additional results from the STELLAR trial[J].Clin Ther,2004,26(9):1388-1399.
[11]Llevadot J,Murasawa S,Kureishi Y,et al.HMG-CoA reductase inhibitor mobilizes bone marrow derived endothelial progenitor cells[J].J Clin Invest,2001,108(3):399-405.
[12]Loomans C J,van Haperen R,Duijs J M,et al.Differenti-ation of bone marrow-derived endothelial progenitor cells is shifted into a pro-inflammatory phenotype by hyperglycemia[J].Mol Med,2009,15(5-6):152-159.
[13]Hristov M,Fach C,Becker C,et al.Reduced numbers of circulating endothelial progenitor cells in patients with coronary artery disease associated with long-term statin treatment[J].Atherosclerosis,2007,192(2):413-420.
[14]Shao H,Tan Y,Eton D,et al.Statin and stromal cell derived factor-1 additively promote angiogenesis by enhancement of progenitor cells incorporation into new vessels[J].Stem Cells,2008,26(5):1376-1384.
[15]Minami Y,Satoh M,Maesawa C,et al.Effect of atorvastatin on microRNA 221/222 expression in endothelial progenitor cells obtained from patients with coronary artery disease[J].Eur J Clin Invest,2009,39(5):359-367.
[16]Patschan D,Patschan S,Henze E,et al.LDL lipid apheresis rapidly increases peripheral endothelial progenitor cell competence[J].J Clin Apher,2009,24(5):180-185.
[17]Matsumura M,Fukuda N,Kobayashi N,et al.Effects of atorvastatin on angiogenesis in hindlimb ischemia and endothelial progenitor cell formation in rats[J].J Atheroscler Thromb,2009,16(4):319-326.