脑室内注射脂多糖大鼠海马部位星形胶质细胞的变化
2012-09-05赵咏梅吕风月徐群渊
赵咏梅 吕风月 徐群渊
(1.首都医科大学宣武医院神经变性病教育部重点实验室北京市老年病医疗研究中心,北京100053;2.首都医科大学北京神经科学研究所,北京100069)
帕金森病(Parkinson’s disease,PD)是一种多发于中老年人的中枢神经系统慢性进行性变性疾病,其主要病理学改变是黑质多巴胺(dopamine,DA)能神经元进行性变性缺失,其发病机制目前尚不十分清楚。近年的研究[1]表明,暴露于各种有促炎作用的感染因子或毒素引起的神经炎性反应可能是PD发病的一个重要因素。不同于以往向黑质纹状体部位直接注射脂多糖(lipopolysaccharide,LPS)造成黑质DA能神经元变性的模型[2-3],本课题组[4]采用侧脑室注射LPS造成全脑炎性反应,证明炎性反应对黑质DA能神经元具有长时程毒性作用。直到LPS注射后24周,大鼠黑质部位酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性染色神经元数较注射0.9%氯化钠注射液(normal saline,NS)的对照组大鼠明显减少[4-5],因此,该模型较符合PD中DA能神经元慢性变性的特点。同时,由于该模型排除了直接向黑质纹状体部位注射LPS造成的对黑质纹状体部位的机械性刺激及LPS对神经元的直接损伤作用,因此比以往PD模型更好地模拟了脑内炎性反应引起黑质DA能神经元慢性变性的过程。
星形胶质细胞是脑内的主要的神经胶质细胞,在各种胶质细胞中数量最多、分布最广。在PD患者及动物模型中,黑质致密部除了大量的DA能神经元缺失外,还存在轻至中度的星形胶质细胞激活[6]。研究[7]显示,那些周围星形胶质细胞较少的DA能神经元更易于变性,提示星形胶质细胞对DA能神经元存在保护作用。另有研究[8-9]发现,在PD患者脑内,含α-synuclein阳性星形胶质细胞的出现与黑质DA能神经元的死亡有关,其数量与PD中黑质部位神经元缺失的严重程度相关[9]。因此,星形胶质细胞在PD中具有复杂的作用。我们已有的研究[4]表明,在侧脑室注射LPS诱导的脑内炎性反应模型中,黑质部位的星形胶质细胞呈现“急性激活-静止-再次激活”状态。在本研究中,我们主要观察大鼠侧脑室注射LPS后海马部位星形胶质细胞的激活情况及表达的变化,以进一步研究星形胶质细胞在DA能神经元慢性变性过程中的作用。
1 材料和方法
1.1 实验动物及分组
健康雄性SD大鼠(Sprague-Dawley rats)64只,体质量250~300 g,购自北京维通利华实验动物技术有限公司,动物分级为无特定病原体级(specific pathogen free,SPF),动物合格证号:SCXK(京)2007-0001。采用数字表法随机分为NS对照组和LPS实验组,每组分4个时间点进行观察,即给药后2、4、12、24周,每个时间点8只大鼠。
1.2 实验仪器及试剂
脑立体定位仪(Benchmark-900,美国 David KopF),冰冻切片机(LEICA CM3050S,德国 Leica公司),LPS(Sigma公司),胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体(北京中杉生物技术有限公司)。Sp免疫组化试剂盒购自Zymed Laboratories公司。Western blotting仪器及Gel-Doc凝胶成像分析系统为Bio-Rad公司产品。
1.3 脑内炎性反应大鼠模型制作
6%水合氯醛(360 mg/kg)腹腔注射麻醉大鼠。将1 mg LPS溶于800 μL NS中配成1.25 g/L的LPS溶液,新鲜配制,冰冻保存。根据包新民的大鼠脑立体定位图谱确定侧脑室注射位点,即前囟后0.8 mm,正中线右旁开1.3 mm,硬膜下3.5 mm。将20 μL NS或浓度为1.25 g/L的LPS注入右侧脑室。注射速度为1 μL/min,共 20 min 注完,留针 15 min,以 1 mm/min的速度缓慢退针,以防LPS沿针道反流溢出。
1.4 免疫组织化学染色
大鼠麻醉后经左心室灌注NS 250 mL,接着灌注4℃预冷的4%多聚甲醛400 mL(pH 7.4),速度先快后慢,随后取出脑组织放入4%的多聚甲醛溶液中后固定,24 h后放入含30%蔗糖的0.1 mol/L PB溶液中,待其完全沉底后用冰冻切片机连续冠状切片,厚度60 μm。从第三脑神经平面开始留取切片,每6个切片取1张,进行GFAP抗体免疫组织化学染色。免疫组化染色主要步骤为:3%H2O2室温10 min,5%正常羊血清封闭30 min,加入1∶700稀释的GFAP抗体,阴性对照不加一抗,室温孵育过夜。1∶300稀释的生物素标记的二抗室温孵育2 h,1∶300稀释的辣根酶标记的链酶卵白素抗体室温孵育2 h,每个步骤间用PBST充分漂洗,最后用二氨基联苯胺(DAB)显色,常规脱水、透明、封固,显微镜下观察。
1.5 Western blotting分析
大鼠麻醉后快速断头取脑,于冰上剥离双侧海马,加入裂解液裂解,离心后取上清液变性,BCA法蛋白定量。电泳时配置10%的分离胶,5%的浓缩胶,脑组织样品先经50 V恒压电泳后换150 V恒压电泳,并用电转法将蛋白转移到PVDF膜上(100 V,3 h)。5%的脱脂奶粉室温封闭PVDF膜1 h,1∶20 000稀释的 GFAP抗体4℃孵育过夜,次日辣根过氧化物酶标记的二抗室温孵育2 h,ECL显色曝片。以β-actin作为内参,重复上述实验3次,对显影条带进行吸光度分析。
GFAP蛋白表达量表示方法:用Gel-Doc凝胶成像分析系统,Quantity One图像分析软件分析得出X片上GFAP条带的平均吸光度值和面积,及相应的βactin条带的平均吸光度值和面积。首先,分别计算出每个条带的平均吸光度值与面积的乘积,然后将每个GFAP条带吸光度值与面积的乘积比上相应β-actin吸光度值与面积的乘积,并以相应NS对照组大鼠的比值作为1,相应LPS实验组用相对比值表示GFAP表达水平。
1.6 统计学方法
所有数据用SPSS 11.5统计软件处理,计量资料用均数±标准差(±s)表示,采用两独立样本均数比较的t检验进行组间比较,以P<0.05为差异有统计学意义。
2 结果
2.1 注射LPS后,大鼠海马部位GFAP阳性细胞变化
GFAP免疫组织化学染色结果显示,NS对照组大鼠不同时间点海马部位星形胶质细胞形态无明显变化,均呈未激活状态。LPS注射2周后LPS实验组大鼠海马部位星形胶质细胞明显激活,与相应NS对照组相比表现为胞体外形肥大,突起变短增粗,染色加深(图1)。而到LPS注射后4周和12周时,LPS实验组大鼠海马部位星形胶质细胞激活不明显,细胞都呈现胞体较小,分支细、短,染色较浅。到LPS注射后24周时,LPS实验组海马部位的星形胶质细胞又出现极其轻度的激活。

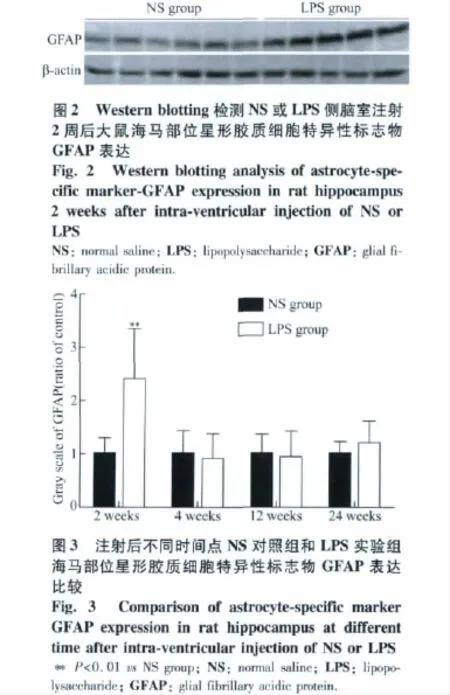
图1 NS或LPS侧脑室注射2周后大鼠海马部位星形胶质细胞特异性标志物GFAP免疫组织化学染色Fig.1 Immunohistochemistry of rat hippocampal astrocytes stained with astrocyte-specific marker GFAP antibody at 2 weeks after intra-ventricular injection of NS or LPS(original magnification 400×)
2.2 注射LPS后,大鼠海马部位GFAP蛋白表达变化
Western blotting研究结果表明,NS对照组大鼠不同时间点海马部位GFAP蛋白表达量无明显变化。LPS实验组大鼠海马部位GFAP蛋白表达量在LPS注射2周时明显高于相应NS对照组,为相应NS对照组的2.39倍,差异有统计学意义(t=3.901,P=0.005)(图2,3)。而4周和12周时,LPS实验组大鼠海马部位GFAP蛋白表达量与相应NS对照组相比变化不明显。到LPS注射后24周时,LPS实验组大鼠海马部位GFAP蛋白表达量比相应NS对照组略有增高,是相应NS对照组的1.19倍,但差异无统计学意义(t=1.137,P=0.275)(图2,3)。
3 讨论
在正常生理状态下,星形胶质细胞在脑内起着重要的作用,如参与构成神经组织网架、维持细胞外环境的稳定、作为能源的储存部位储存糖原、吸收和降解某些兴奋性神经递质、参与血脑脊液屏障的构成等。星形胶质细胞在PD中的作用较为复杂。一方面,它可以通过释放多种神经营养因子、抗氧化物质来保护DA能神经元;而另一方面,它亦可以因某些刺激因素的作用释放各种炎性细胞因子对DA能神经元起破坏作用。
本课题组以往的研究[4]表明,侧脑室注射 LPS后,大鼠黑质纹状体部位的星形胶质细胞在LPS注射早期(2周)明显激活,且GFAP蛋白表达明显高于相应NS对照组。本研究结果发现,LPS实验组大鼠海马部位的星形胶质细胞在LPS注射2周时有明显激活,且GFAP蛋白表达量比相应NS对照组明显增加(P<0.05),说明侧脑室注射LPS后星形胶质细胞的急性激活并不仅局限于黑质部位,脑内其他部位(如海马)也存在星形胶质细胞的急性激活。现普遍认为,在中枢神经系统损伤早期,星形胶质细胞反应通过血液-中枢神经系统接触面的调节、细胞外离子和神经递质水平的调节、细胞外基质的修复以及为神经元提供营养支持等方面,对于神经元的存活是有益的[10]。因此,此时星形胶质细胞的激活对神经元主要为保护作用,是对LPS所引起的损伤的一种保护性反馈反应,且对脑内神经元(包括海马部位神经元和黑质神经元)都存在这种保护作用。
尽管在中枢神经系统损伤早期,星形胶质细胞激活对神经元的存活是有益的,然而,长期的星形胶质细胞激活对于神经元的修复是否存在保护作用尚存在争议。一方面,反应性星形胶质细胞增生可干扰神经元的再生[11]。而且激活的星形胶质细胞可释放某些毒性物质如炎性反应因子而参与神经变性过程[12]。但另一方面,通过缝隙连接的神经元-星形胶质细胞间接触和星形胶质细胞释放的营养因子对于神经元的存活都是必需的[13]。本研究结果表明,注射后4和12周,LPS实验组大鼠海马部位星形胶质细胞均未见明显激活,GFAP蛋白表达量与NS对照组相比也未见明显差异,说明侧脑室注射LPS后大鼠海马部位的星形胶质细胞并非一直处于激活状态。到注射后24周时,LPS实验组大鼠海马部位星形胶质细胞又出现轻度激活,但LPS实验组GFAP蛋白表达量与相应NS对照组相比差异无统计学意义(P>0.05),说明在LPS注射晚期(24周),大鼠海马部位的星形胶质细胞激活不如急性期(2周)明显。我们在以往研究[4]中发现,注射LPS 24周后大鼠黑质纹状体部位星形胶质细胞激活非常明显,此时LPS实验组大鼠黑质部位的TH阳性神经元数目也显著低于相应NS对照组,且动物出现明显的行为学障碍,提示此时的星形胶质细胞激活反应主要局限于脑内黑质部位,针对的是黑质部位的神经元。
总之,本研究观察到,侧脑室注射LPS后,大鼠海马内星形胶质细胞变化不如黑质纹状体系统明显,这进一步证明了星形胶质细胞在该炎性反应模型中具有选择性作用,黑质部位星形胶质细胞很可能参与了黑质DA能神经元的变性过程。
[1]McGeer P L,Yasojima K,McGeer E G.Inflammation in Parkinson’s disease[J].Adv Neurol,2001,86:83-89.
[2]Hernández-Romero M C,Delgado-Cortés M J,Sarmiento M,et al.Peripheral inflammation increases the deleterious effect of CNS inflammation on the nigrostriatal dopaminergic system[J].Neurotoxicology,2012,33(3):347-360.
[3]Hunter R L,Dragicevic N,Seifert K,et al.Inflammation induces mitochondrial dysfunction and dopaminergic neurodegeneration in the nigrostriatal system[J].J Neurochem,2007,100(5):1375-1386.
[4]赵咏梅,吕风月,许秋岩,等.大鼠脑内炎症对黑质多巴胺能神经元的长时程毒性作用及星形胶质细胞变化[J].中华老年医学杂志,2010,29(5):416-419.
[5]赵咏梅,吕风月,徐群渊.脑源性神经营养因子在脑室注射脂多糖大鼠黑质多巴胺能神经元变性中的作用[J].首都医科大学学报,2009,30(5):648-652.
[6]Rappold P M,Tieu K.Astrocytes and therapeutics for Parkinson’s disease[J].Neurotherapeutics,2010,7(4):413-423.
[7]Halliday G M,Stevens C H.Glia:initiators and progressors of pathology in Parkinson’s disease[J].Mov Disord,2011,26(1):6-17.
[8]Sidoryk-Wegrzynowicz M,Wegrzynowicz M,Lee E,et al.Role of astrocytes in brain function and disease[J].Toxicol Pathol,2011,39(1):115-123.
[9]Braak H,Sastre M,Del Tredici K.Development of alphasynuclein immunoreactive astrocytes in the forebrain parallels stages of intraneuronal pathology in sporadic Parkinson’s disease[J].Acta Neuropathol,2007,114(3):231-241.
[10]Rathinam M L,Watts L T,Narasimhan M,et al.Astrocyte mediated protection of fetal cerebral cortical neurons from rotenone and paraquat[J].Environ Toxicol Pharmacol,2012,33(2):353-360.
[11]Wanner I B,Deik A,Torres M,et al.A new in vitro model of the glial scar inhibits axon growth[J].Glia,2008,56(15):1691-1709.
[12]Fernandes A, BritesD. Contribution ofinflammatory processes to nerve cell toxicity by bilirubin and efficacy of potential therapeutic agents[J].Curr Pharm Des,2009,15(25):2915-2926.
[13]L'Episcopo F,Tirolo C,Testa N,et al.Glia as a turning point in the therapeutic strategy of Parkinson’s disease[J].CNS Neurol Disord Drug Targets,2010,9(3):349-372.
