多聚二磷酸腺苷(ADP)核糖聚合酶-1介导高糖致大鼠肾脏系膜细胞tPA/PAI-1的紊乱
2012-09-04朱恒梅祝胜郎陈结慧李向阳
朱恒梅,祝胜郎,陈结慧,叶 玲,蒋 莹,李向阳
(深圳市第六人民医院肾内科,广东 深圳 510082)
多聚二磷酸腺苷(ADP)核糖聚合酶-1介导高糖致大鼠肾脏系膜细胞tPA/PAI-1的紊乱
朱恒梅,祝胜郎*,陈结慧,叶 玲,蒋 莹,李向阳
(深圳市第六人民医院肾内科,广东 深圳 510082)
目的 探讨多聚二磷酸腺苷(ADP)核糖聚合酶-1(PARP-1)在高糖(25 mmol/L)作用下大鼠肾脏系膜细胞tPA/PAI-1纤溶系统紊乱中的作用。方法(1)体外培养大鼠肾脏系膜细胞株(MCs 1097),使用高糖(25 mmol/L)处理大鼠肾脏系膜细胞,部分实验组中应用PARP-1特异性抑制剂PJ34(3×10-6mol/L)进行干预处理。(2)RT-PCR及Western blot检测PARP-1的mRNA及蛋白表达。(3)高通量比色测定法检测PARP-1的活性。(4)ELISA法测定细胞上清液tPA、PAI-1的分泌蛋白。结果(1)高糖显著诱导大鼠肾脏系膜细胞PARP-1 mRNA和蛋白的表达,PJ-34可明显抑制高糖诱导的PARP-1 mRNA和蛋白的过度表达。同时,高糖显著诱导大鼠肾脏系膜细胞PARP-1激活,PJ-34可显著抑制高糖诱导的PARP激活。(2)高糖轻度减少大鼠肾脏系膜细胞分泌型tPA的蛋白表达,显著增加大鼠肾脏系膜细胞分泌型PAI-1的蛋白表达,导致tPA/PAI-1比值降低,PJ-34显著预防高糖诱导的上述改变。结论高糖可以诱导培养的大鼠肾脏系膜细胞内PARP激活,PARP1表达增加,PJ-34预处理可以明显降低高糖诱导的大鼠肾脏系膜细胞内PARP的激活以及下游tPA/PAI-1纤溶系统紊乱,提示高糖可能通过过度激活PARP来诱导tPA/PAI-1功能紊乱。
系膜细胞;PARP;高糖;tPA/PAI-1;纤溶系统
PARP是一类存在于多数真核细胞中的蛋白质翻译后修饰酶,能选择性识别并结合DNA缺口的DNA结合蛋白酶,具有保持染色体结构完整、参与DNA复制和转录的功能,在维持基因组稳定和细胞死亡过程中发挥作用[1-2]。高血糖介导的活性氧(ROS)可以激活多聚ADP核糖聚合酶[Poly(ADP-ribose)polymerase,PARP],提示其在糖尿病病程中可能发挥作用。组织型纤溶酶原激活物/纤溶酶原激活物抑制物-1(tPA/PAI-1)是主要的纤溶酶原/纤溶酶系统,不仅能直接降解细胞外基质,还能激活金属蛋白酶间接降解基质,处于各种调节酶系的上游,在糖尿病肾小球硬化中发挥重要作用。肾小球系膜细胞是糖尿病肾病(DN)损伤的中心环节,因此本实验以大鼠肾脏系膜细胞作为研究对象,探讨多聚二磷酸腺苷(ADP)核糖聚合酶-1(PARP-1)在高糖致tPA/PAI-1紊乱中的作用,以探讨PARP在糖尿病肾病发生发展中的作用。
1 材料与方法
1.1 材料 D-Glucose购自Sigma公司,PJ-34购自默克公司;细胞培养用RPMI 1640,胎牛血清购自Gibco公司;Trizol溶液购自美国Invitrogen公司;胰岛素购自甘李药物公司,Trizol Reagent购自Invitrogen公司;细胞裂解液、HRP标记的兔抗大鼠Ⅱ抗购自Cell signaling公司,兔抗大鼠PARP-1一抗购自CHEMICON公司;tPA、PAI-1酶联免疫吸附法(ELISA)试剂盒购自上海太阳生物技术有限公司;PARP/ Apoptosis检测试剂盒购自trevigen公司;RevertAidTMFirst Strand cDNA逆转录试剂盒购自Fermentas公司,Taq DNA聚合酶购自Takaka公司。其余化学试剂为国产分析纯。
1.2 方法
1.2.1 细胞培养及分组大鼠肾脏系膜细胞株(MCs 1097,购自美国ATCC公司)培养于含有15%胎牛血清及0.6 U/ml胰岛素的RPMI 1640培养基中。细胞培养至85%融合后,换用无血清培养基培养24 h,后换用新鲜无血清的DMEM低糖(5 mmol/L)培养基,分别加入药物刺激干预:高糖刺激组中高糖浓度为25 mmol/L,刺激时间为24 h。PJ34干预组先给予3× 10-6mol/L PJ34孵育1h后,加入高糖刺激24 h。单纯使用PJ34组作为对照。
1.2.2 细胞总蛋白提取 细胞用PBS清洗后加入细胞裂解液,冰上放置5 min。用细胞刮刮取细胞,收集至1.5 ml Eppendorf管中,放置于冰上。用超声粉碎仪在冰上进行超声粉碎,500 W、1 s×15次,以剪切DNA,降低黏稠度。4℃,12 000 r/min离心10 min,留取上清。取10 μl上清测定浓度,余储存于-80℃备用。细胞总蛋白提取物做Western blot分析高糖对于大鼠肾脏系膜细胞PARP-1表达的影响。
1.2.3 RT-PCR 大鼠肾脏系膜细胞总RNA的提取按照Trizol说明书操作。RT-PCR引物购自美国INVITROGEN公司上海分部。逆转录反应及RT-PCR反应:取1.0 μg的总RNA采用RevertAidTMFirst Strand cDNA Synthesis Kit,以Oligo(dT)18为引物合成第一链cDNA(按试剂盒说明书进行);②PCR:采用Takaka公司试剂盒PCR反应扩增。引物序列如表1。产物储存于-20℃。取8 μl PCR产物在含有0.5 μg/ml溴化乙淀(EB)的1.5%琼脂糖凝胶中以85 V恒压电泳30 min,紫外检测仪上观察,用凝胶图像成像系统成像及进行扫描定量分析DNA带的含量,以所测得积分吸光度与内参照β-Actin积分吸光度的比值代表半定量值。PARP-1及β-Actin引物及反应条件见表1。

表1 PCR引物合成序列
1.2.4 细胞培养液上清中tPA PAI-1的含量按照ELISA试剂盒(上海太阳生物技术有限公司)说明书进行。
1.2.5 PARP活性检测 细胞PARP活性检测按照PARP/Apoptosis检测试剂盒(trevigen公司)说明书进行。
1.3 统计学处理 采用SPSS13.0进行统计分析,计量资料以均数±标准差表示,各组数据之间差异显著性用多个样本均数比较及两两用ANOVA方差分析检验。检验水准α=0.05。
2 结果
2.1 PJ34抑制高糖诱导大鼠肾脏系膜细胞PARP-1的过表达 应用高糖刺激大鼠肾脏系膜细胞,高糖组系膜细胞PARP-1 mRNA和蛋白的表达较较低糖对照组明显增加,分别较低糖对照组增加72.3%和68.4%(P<0.05),PJ34组系膜细胞PARP-1 mRNA和蛋白的表达分别减少为高糖组的31.8%和55.5%(P<0.05,见图1,图2)。单纯使用PJ-34不影响系膜细胞PARP-1的表达。同时,高糖显著诱导大鼠肾脏系膜细胞PARP-1激活,高糖组为对照组活性的1.77倍(P<0.05),给予PJ-34预处理可显著抑制高糖诱导的PARP激活,活性降低为高糖刺激组的67.8% (P<0.05,见图3)。
2.2 PJ34 抑制高糖诱导大鼠肾脏系膜细胞上清液tPA及PAI-1蛋白的过表达 应用高糖刺激大鼠肾脏系膜细胞,高糖组系膜细胞分泌的tPA蛋白显著下降,较低糖对照组下降30.0%(P<0.05),分泌的PAI-1蛋白明显增加,较低糖对照组增加70.7%(P<0.05),tPA/PAI-1比值较低糖对照组减少41.0%(P<0.05)。PJ34组系膜细胞分泌的tPA蛋白有所增加,较高糖组增加30.8%(P<0.05),分泌的PAI-1蛋白则较高糖组明显下降,为高糖组的73.2%(P<0.05),tPA/PAI-1比值则较高糖组增加78.6%(P<0.05,见图4)。单纯使用PJ-34不影响系膜细胞上清液tPA及PAI-1蛋白的表达。

图1 高糖(25 mmol/L)诱导PARP-1 mRNA表达及PJ34的干预作用
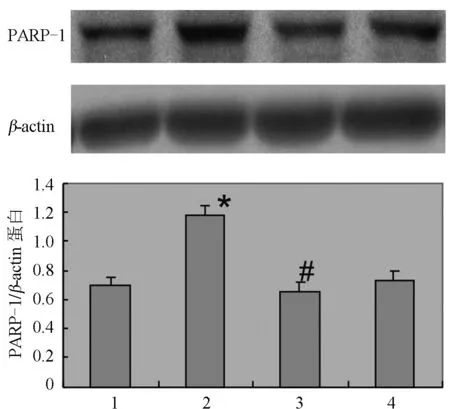
图2 高糖(25 mmol/L)诱导PARP-1蛋白表达及PJ34的干预作用
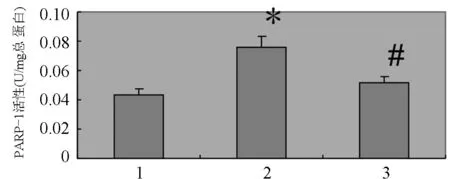
图3 高糖(25 mmol/L)诱导PARP-1活性表达及PJ34的干预作用

图4 高糖(25 mmol/L)诱导tPA、PAI-1蛋白的过表达及PJ34的干预作用
3 讨论
DN是糖尿病严重的并发症之一,也是发达国家终末期肾病(End stage renal disease,ESRD)的首要原因,我国近年来发病率也有不断上升的趋势[3]。糖尿病肾病早期的病理变化主要表现为:肾小球系膜基质增宽及毛细血管基底膜增厚,后期出现肾小球硬化及肾间质纤维化。糖尿病肾病的发病过程中,细胞外基质(ECM)堆积是其病理损害的关键。ECM的过度积聚可以导致肾小球系膜膜基质增厚,肾小球肥大,进而导致肾小球硬化。ECM的产生增加和(或)降解减少是ECM积聚的主要原因。ECM主要包括胶原(Collagen,COL),层粘连蛋白(Laminin,LN),纤维连接蛋白(Fibronectin,FN)[4-5]。笔者未发表的数据再次证实了高糖显著增加COLⅣ和FN表达。tPA/PAI-1是主要的纤溶酶原/纤溶酶系统,PAI-1是tPA的天然抑制剂,糖尿病时,tPA/PAI-1功能紊乱,导致tPA表达减少,PAI-1表达增多,抑制了纤溶系统的功能,使纤溶酶酶原活化减少,纤维蛋白/纤维蛋白原降解减少,ECM降解受到抑制,在糖尿病ECM积聚中发挥重要作用[6]。在本研究中,我们同样观察到应用高糖刺激大鼠肾脏系膜细胞,高糖组系膜细胞分泌的tPA蛋白有所下降,PAI-1蛋白明显增加,tPA/PAI-1比值降低,再次证实糖尿病时tPA/PAI-1功能紊乱。
研究表明,高糖损伤的细胞类型都具有一致的特点,都有ROS的生成增多[7]。高血糖介导的ROS通过在过度激活PARP来抑制关键的糖酵解酶GAPDH,引起糖酵解的中间产物大量堆积,其中,增加的中间产物3-磷酸甘油醛激活了AGE途径和PKC途径[8]。另一种中间产物6-磷酸果糖使得己糖氨通路流量增加[9]。最终,GAPDH的抑制使得糖酵解的第一步代谢物—葡萄糖水平升高。高糖可增强羟基化途径,降低醛糖还原酶活性,从而激活多元醇途径[10]。而Suzuki等[11]证实高糖诱导PAI-1基因表达部分是通过PKC途径;也有报道指出,高糖也能经己糖氨通路及AGE途径促进PAI-1基因表达[12]。因此,我们可推断高糖通过过度激活PARP来诱导tPA/PAI-1功能紊乱。
PARP是一类存在于多数真核细胞中的蛋白质翻译后修饰酶。主要存在于细胞核内,少量存在于细胞浆内。它是能选择性识别并结合DNA缺口的DNA结合蛋白酶,主要通过修复DNA单链及双链断裂在维持基因组的完整性方面发挥作用[1]。我们既往研究发现抑制PARP可以显著改善高糖所致腹膜间皮细胞的PAI-1的表达,进而抑制其转分化及纤维化[13]。我们还发现下调PARP-1活性及表达能部分逆转AngII诱导的大鼠肾脏系膜细胞PAI-1的表达并抑制细胞外基质积聚[14]。而在本研究中,我们发现高糖刺激可以引起大鼠系膜细胞细胞内PARP激活,PARP-1表达升高以及分泌的tPA蛋白有所下降,PAI-1蛋白明显增加,tPA/PAI-1比值降低,提示tPA/PAI-1功能紊乱。我们还首次发现应用PARP抑制剂PJ34干预后大鼠系膜细胞PARP-1活性及表达降低,明显改善了高糖诱导的FtPA/PAI-1功能紊乱。首次证实了高糖可能通过过度激活PARP来诱导tPA/PAI-1功能紊乱。因此,研究和开发PARP抑制剂,将为临床治疗氧化应激相关性疾病提供新策略和新方法,为糖尿病肾病的治疗提供一个新的思路。
[1]Luo X,Kraus WL.On PAR with PARP:cellular stress signaling through poly(ADP-ribose)and PARP-1[J].Genes Dev,2012,26 (5):417-432.
[2]Javle M,Curtin NJ.The role of PARP in DNA repair and its therapeutic exploitation[J].Br J Cancer,2011,105(8):1114-1122.
[3]Breyer MD.Diabetic nephropathy:introduction[J].Seminars in Nephrology,2007,27(2):129.
[4]Jerums G,Panagiotopoulos S,Premaratne E,et al.Integrating albuminuria and GFR in the assessment of diabetic nephropathy[J].Nature Reviews Nephrology,2009,5(7):397-406.
[5]Chang SY,Chen YW,Chenier I,et al.AngiotensinⅡtypeⅡreceptor deficiency accelerates the development of nephropathy in type i diabetes via oxidative stress and ACE2[J].Exp Diabetes Res,2011: 521076.
[6]Al-Hamodi Z,Ismail IS,Saif-Ali R,et al.Association of plasminogen activator inhibitor-1 and tissue plasminogen activator with type 2 iabetes and metabolic syndrome in Malaysian subjects[J].Cardiovasc Diabetol,2011,10:23.
[7]Matough FA,Budin SB,Hamid ZA,et al.The role of oxidative stress and antioxidants in diabetic complications[J].Sultan Qaboos Univ Med J,2012,12(1):5-18.
[8]Kiss L,Szabó C.The pathogenesis of diabetic complications:the role of DNA injury and poly(ADP-ribose)polymerase activation in peroxynitrite-mediated cytotoxicity[J].Mem Inst Oswaldo Cruz, 2005,100(Suppl 1):29-37.
[9]Du X,Matsumura T,Edelstein D,et al.Inhibition of GAPDH activity by poly(ADP-ribose)polymerase activates three major pathways of hyperglycemic damage in endothelial cells[J].J Clin Invest, 2003,112(7):1049-1057.
[10]Busw MG.Hexosamines,insulin resistance,and the complications of diabetes:current status[J].Am J Physiol Endocrinol Metab, 2006,290(1):E1-E8.
[11]Suzuki M,AkimotoK,HattoriY,et al.Glucose upregulates plasminogen activator inhibitor-1 gene expression in vascular smooth muscle cells[J].Life Sci,2002,72(1):59-66.
[12]JamesLR,Fantus IG,Glodberg H,et al.Overexpression of GFAT activates PAI-1 Promoter in mesangial cells[J].Am J Physiol Renal Physiol,2000,279(4):F718.
[13]Lei P,Jiang Z,Zhu H,et al.Poly(ADP-ribose)polymerase-1 in high glucose-induced epithelial-mesenchymal transition during peritoneal fibrosis[J].Int J Mol Med,2012,29(3):472-478.
[14]Zhu H,Jiang Z,Lei P,et al.Role of poly(ADP-ribose)polymerase-1 activation in angiotensinⅡ-induced extracellular matrix accumulation in rat mesangial cells[J].Kidney Blood Press Res, 2011,34(5):320-327.
Effect of Poly(ADP-ribose)Polymerase-1 in high glucose-induced disorder of of tPA/PAI-1 in rat mesangial cells.
ZHU Heng-mei,ZHU Sheng-lang,CHEN Jie-hui,YE Ling,JIANG Ying,LI Xiang-yang.
Department of Nephrology,the Sixth Hospital of Shenzhen City,Shenzhen 510082,Guangdong,CHINA
ObjectiveTo investigate the role of Poly(ADP-ribose)Polymerase-1(PARP-1)in high glucose-induced disorder of tPA/PAI-1 in rat mesangial cells(RMCs).MethodsRMCs were constructed and then treated with or without high glucose(25 mmol/L).In some experimental groups,cells were pre-treated with PARP-1 inhibitor PJ34(3×10-6mol/L).RT-PCR was employed to detect the expression of PARP-1 mRNA,Western blot was used to detect the expression PARP-1 protein,and Colorimetric assay for its activity.Meanwhile,tPA and PAI-1 protein secretion were examined by ELISA.ResultsHigh glucose significantly stimulated the overexpression of both PARP-1 mRNA and protein in RMCs.At the same time,high glucose obviously stimulated PARP-1 activation,and PJ34 effectively inhibited the activation of PARP-1.Also,PJ34 suppressed high glucose-induced downregulation of tPAprotein secretion,upregulation of PAI-1 protein secretion and reversed the reduction of tPA/PAI-1 ratio.ConclusionPARP-1 mediates high glucose-induced disorder of tPA/PAI-1 in rat mesangial cells.
Mesangial cells;PARP;High glucose;tPA/PAI-1;Fibrinolytic system
R-322
A
1003—6350(2012)20—018—04
10.3969/j.issn.1003-6350.2012.20.007
2012-05-17)
深圳市科技局科技立项(编号:201102134);深圳市南山区计划项目(编号:南卫2011004)
朱恒梅(1970—),女,江西省赣州市人,主治医师,博士。
*通讯作者:祝胜郎,男,主任医师,硕士导师。E-mail:zhushenglang@yahoo.com.cn
