罗格列酮对异育银鲫血清生化指标和糖代谢的影响
2012-09-03武汉工业学院动物营养与饲料科学湖北省重点实验室侯永清丁斌鹰
武汉工业学院动物营养与饲料科学湖北省重点实验室 杨 玲 侯永清* 丁斌鹰
鱼类对碳水化合物的利用率较低(Wilson和Poe,1987)。但糖是最廉价的饲料能源,在鱼饲料中添加适量水平的碳水化合物能起到节约成本,减少饲料蛋白质作为能源被消耗的作用(Erfanullah 和 Jerri,1998;Kaushik 等,1989)。 大量研究表明,鱼类胰岛素受体可能偏少,影响了胰岛素的降血糖作用 (Ablett等,1983)。罗格列酮(rosiglitazone,RSG)属于噻唑烷二酮类,是一种口服降血糖药,能显著增强靶组织对胰岛素的敏感性,具有抗胰岛素抵抗的作用,长期应用有保护胰腺β细胞功能的作用 (Lebovitz等,2001)。目前,在小鼠上的研究表明,罗格列酮能有效降低小鼠餐后血糖及空腹血糖,有效调节糖代谢(Stum和Haring,2002)。但关于罗格列酮对鱼类糖代谢调控的研究鲜见报道。因此,本试验旨在通过在异育银鲫基础纯合日粮中添加不同水平的罗格列酮,研究其对异育银鲫血液生化指标和糖代谢的影响,以期为鱼类饲料中糖类物质的合理应用提供试验依据。
1 材料与方法
1.1 试验设计 试验饲料为精制饲料,以酪蛋白为蛋白源,以糊精为糖源,基础日粮配方及营养水平见表1。在基础日粮中分别添加0(对照组)、10(试验Ⅰ组)、15 mg/kg(试验Ⅱ组)和 20 mg/kg(试验Ⅲ组)罗格列酮,制成本试验所需的4种试验日粮。各种饲料原料分别过60目筛,按照逐级放大的原则充分混匀,再加入油、水,用小型绞肉机制成粒径为2.0 mm的湿饲料,在40℃下烘干,用小型粉碎机粉碎,过10目筛,制得颗粒饲料,于4℃下保存。
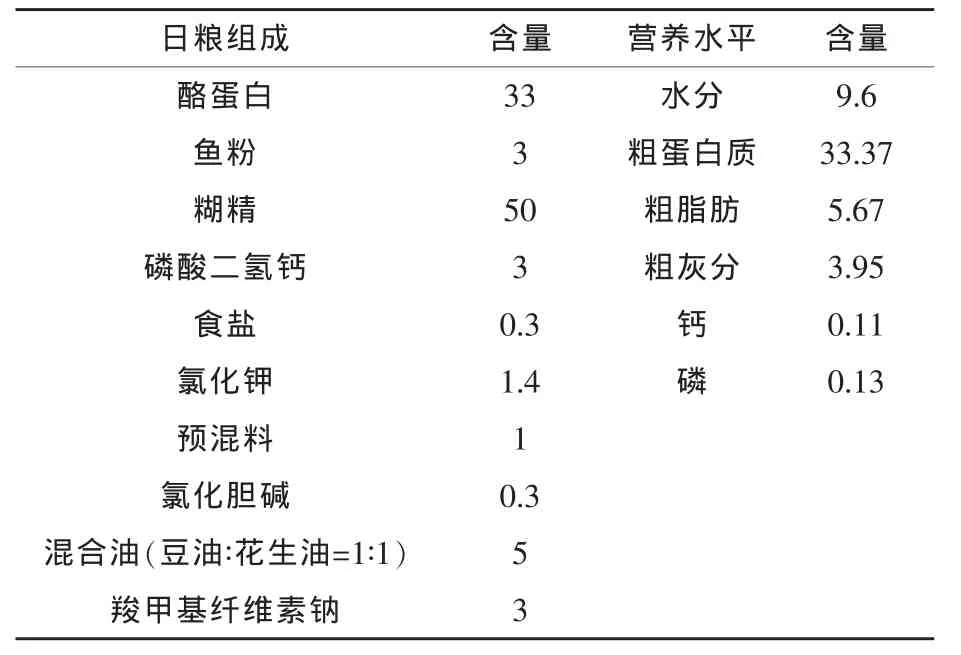
表1 基础日粮组成及营养水平 %
1.2 试验鱼种 异育银鲫 (Carassius auratus gibelio)(方正银鲫♀×兴国红鲤♂)购于武汉市东西湖渔场。用3%氯化钠溶液浸泡鱼种15 min后放入120 cm×120 cm×150 cm水泥池驯养。驯养30 d后,选择健康、规格和体重基本一致的鱼种480 尾,初体重为(5.30±0.38)g,随机分到 16 个100 cm×60 cm×60 cm水族箱中,每个水族箱放养30尾鱼。将16个水族箱随机分为对照组、试验Ⅰ组、试验Ⅱ组、试验Ⅲ组,每个组4个重复(箱)。
1.3 饲养管理 以鱼体重量的2%~4%投喂日粮,每天9∶00和15∶00各投喂一次并测定水温,早晚各吸一次粪,定期消毒、换水,24 h充气增氧,每周测一次水质。整个试验期间水质指标为:水温(26.4±4.56)℃,pH 为 7.0~7.5, 溶氧在 5 mg/L 左右,氨氮小于0.05 mg/L。试验期为30 d。
1.4 样品的采集 试验结束,断食24 h后,从每个水族箱随机取10尾鱼,用一次性注射器尾静脉采血,在4℃下静置2 h,然后在3000 r/min离心10 min,吸取上清液制备血清,放于-80℃保存备用。采完血后解剖取肝胰脏及背肌肉,于液氮速冻后-80℃保存待测。
1.5 测定指标与方法
1.5.1 饲料常规检测 将饲料用超微粉碎机粉碎,过60目。采用恒温干燥法(105℃)、凯氏定氮法、索氏抽提法和灼烧法(550℃)分别测定饲料的水分、粗蛋白质、粗脂肪和粗灰分含量。用高锰酸钾法和磷钒钼酸比色法分别测定饲料中的钙和磷含量。
1.5.2 血液生化指标 取出冷冻保存的血清,采用日立7020全自动生化分析仪测定,试剂盒均由浙江伊利康生物技术有限公司生产,测定指标包括:总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、谷丙转氨酶(GPT)、谷草转氨酶(GOT)、乳酸脱氢酶(LDH)、甘油三酯(TG)以及血糖。
1.5.3 糖代谢指标 取出冷冻保存的肝胰脏和背肌,用化学比色法测定肝糖原和肌糖原含量,丙酮酸激酶采用化学比色法测定,试剂盒均由南京建成生物工程研究所提供,胰岛素采用放射免疫法测定,试剂盒由北京华英生物技术研究所提供。
1.6 数据统计与分析 试验数据在SPSS13.0单因素方差分析(ONE-WAY ANOVA)的基础上,采用Duncan’s进行多重比较,显著水平设在P=0.05,试验结果均以“平均值±标准差”表示。
2 结果与分析
2.1 罗格列酮对异育银鲫血液生化指标的影响由表2可知,随着罗格列酮添加量的增加,血清中的GPT和GOT活性逐渐提高,试验Ⅱ组和Ⅲ组血清中GPT活性较对照组分别提高54.89%和71.06%(P<0.05)。Ⅲ组血清中的GOT活性显著高于对照组(P<0.05),达27.77%,其他各组间差异不显著(P>0.05)。Ⅲ组血清中的LDH较对照组高33.33%,差异显著(P<0.05),其他各组间差异不显著。与对照组相比,试验Ⅰ组、Ⅱ组和Ⅲ组血清中的TP显著提高(P<0.05),分别较对照组提高了5.89%、6.51%和9.21%。各个处理组间血清中的ALB、GLO和TG均差异不显著(P> 0.05)。
2.2 罗格列酮对异育银鲫糖代谢的影响 由表3可知,添加3种剂量的罗格列酮均能显著降低异育银鲫血清中的血糖浓度(P<0.05),与对照组相比,Ⅰ组、Ⅱ组和Ⅲ组血清中的血糖浓度分别降低10.50%、16.97%和21.26%,不同水平罗格列酮组间差异均不显著(P>0.05)。与对照组相比,Ⅰ组、Ⅱ组和Ⅲ组血清中的胰岛素含量显著降低(P<0.05),分别较对照组降低10.90%、13.59%和15.54%,不同水平罗格列酮组间差异不显著。与对照组相比,Ⅰ组、Ⅱ组和Ⅲ组肌糖原含量显著提高 (P<0.05),分别较对照组提高 14.90%、19.17%和22.19%。各个处理组间丙酮酸激酶活性和肝糖原的含量差异均不显著(P>0.05)。
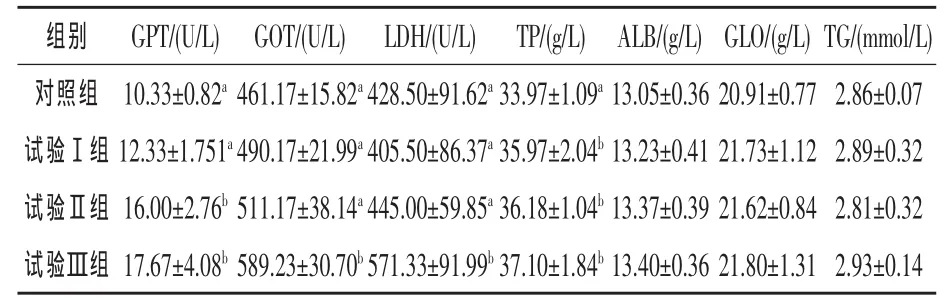
表2 罗格列酮对异域银鲫血清生化指标的影响
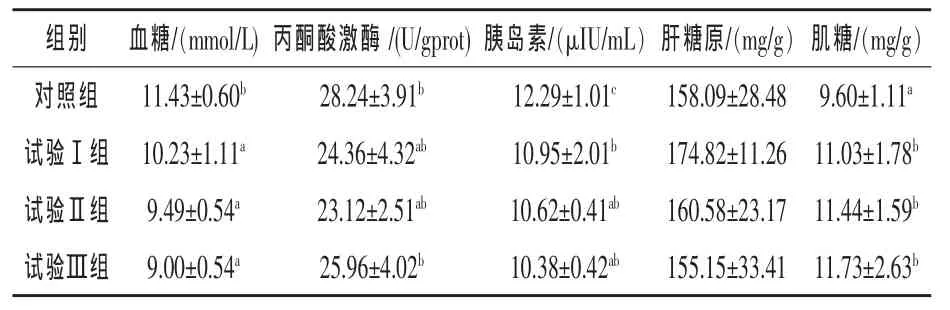
表3 罗格列酮对异育银鲫糖代谢的影响
3 讨论
3.1 罗格列酮对异育银鲫血清生化指标的影响血清生化指标的改变是组织细胞通透性发生改变和机体新陈代谢机能发生改变的反映(褚武英等,2008)。添加15 mg/kg罗格列酮使异育银鲫血清GPT活性显著升高,添加20 mg/kg罗格列酮血清GPT和GOT活性都显著升高,表明添加15 mg/kg罗格列酮时肝损伤较轻仅限细胞膜的通透性增加,细胞浆内的GPT释放入血,添加20 mg/kg罗格列酮时肝细胞受损严重,线粒体里的GOT释放入血(Berent等,2001)。这与报道过的高剂量的罗格列酮能使人肝功能失调的报道一致 (Freid等,2000;A1-Salman 等 ,2000;Ravinuthala Nori,2000;Hachey等,2000)。 添加 20 mg/kg罗格列酮时异育银鲫血清中LDH活性显著升高,说明在此添加量时异育银鲫心、肝、肺等组织器官受损。LDH从组织或细胞中逸出进入血中,使血清LDH及其相应组织的LDH同工酶活性增高 (张剑等,2006)。 这与 Freed等(2000)报道一致。
血清TP和ALB是反映动物营养状况的指标之一,良好的营养状况可使血清蛋白维持在较高的水平(Levy等,1989)。本试验3个添加水平的罗格列酮均能显著提高异育银鲫血清中TP含量,但各处理组间差异不显著。这说明该添加水平的罗格列酮均能起到促进蛋白质合成的作用。
3.2 罗格列酮对异育银鲫糖代谢指标的影响罗格列酮是一种高选择性PPARγ的激动剂,罗格列酮与PPAR的γ异构体结合,激活该受体,增强胰岛素对肝生糖作用的抑制,增强肌细胞对葡萄糖的摄取,同时提高胰岛β细胞功能(Lebovitz,2001;Lehmann 等,1995)。动物试验发现罗格列酮呈剂量依赖性降低空腹血糖和胰岛素水平(Stum和Haring等,2002)。罗格列酮不是直接刺激胰岛素的分泌,而是通过增强机体对胰岛素的敏感性达到降低血糖的效果。因此,在胰岛素缺乏的糖尿病动物中并未发现明显的降血糖作用。本试验结果表明,异育银鲫中不缺乏胰岛素,3个添加水平的罗格列酮均能显著的降低异育银鲫血糖的浓度和胰岛素水平,增加异育银鲫肝糖原的含量,且随着罗格列酮剂量的增加,血糖浓度和胰岛素水平随之降低。表明罗格列酮能有效的控制异育银鲫血糖浓度和胰岛素水平,增强肌细胞对葡萄糖的摄取。
4 结论
本试验3个添加水平的罗格列酮均能降低异育银鲫血糖浓度和胰岛素水平和提高肌糖原的含量,起到调节异育银鲫糖代谢的作用,但是添加15 mg/kg和20 mg/kg的罗格列酮对异育银鲫肝胰脏均会造成一定的损伤,因此,在本试验条件下罗格列酮适宜添加水平为10 mg/kg。
[1]褚武英,吴信,成嘉,等.低聚木糖对草鱼生长性能及血液生化指标的影晌[J].水生动物营养,2008,6:60~64.
[2]张剑,王京华,刘娟,等.常见血液病患者乳酸脱氢酶测定的临床意义[J].哈尔滨医科大学学报,2006,40(6):504~508.
[3]A1-Salman J,Arjomand H,Kemp D G,et al.HepatoceIlular injury in a patient receiving rosiglitazone.A case report[J].Ann Intern Med,2000,132(2):121.
[4]Ablett R R,Taylor M J,Selivonchick D P.The effect of high-protein and high-carbohydr ate diets on iodoinsulin binding in skeletal muscle plasma membranes and isolated hemocytes of rainbow trout (Salmo gairdneri)[J].Br J Nutr,1983,50:129~140.
[5]Berent D,Schmidt H,Wahli T,et al.Effluent from a sewage treatment works causes changes in serum chemistry of brown trout (Salmo trutta L)[J].Ecotox Environ Safe,2001,48(2):140~147.
[6]Erfanullah,Jerri A K.Effect of dietary carbohydrate-to-lipid ration on growth and body composition of walking catfish (Clarias batrachus)[J].Aquaculture,1998,161:l59~l68.
[7]Freed M,Fuell D,Menci L,et al.Effect of combination therapy with rosiglitazone and glibenclamide on PAI-1 antigen,PAI-1 activity,and tPA in patients with type 2 diabetes[J].Diabetologia,2000,43(suppl 1):A 1024.
[8]Freid J,Everitt D,Boscia J.Rosiglitazone and hepatic failure[J].Ann Intern Med,2000,132(18):164.
[9]Hachey D M,O’Nell M P,Force R W.Isolated elevation of alkaline phosphatase level associated with rosiglitazone[J].Ann Intern Med,2000,133(9):752.
[10]Kaushik S J,Luquet P,Blanc D,et al.Studies on the nutrition of Siberian sturgeon,Acipenser baeri.I.Utilization of digestible carbohydrate by sturgeon[J].Aquaculture,1989,76:97~l00.
[11]Lebovitz H E,Dole J F,Patwardhan R,et al.Rosiglitazon monotherapy is effective in patients with type 2 diabetes[J].J Clin Endocrinol Metab,2001,86(1):280.
[12]Lehmann J M,Moore L B,Smith-Oliver T A,et al.An antidiabetic thiazolidinedione is a high affinity ligand for peroxisome proliferator-activated receptor gamma (PPAR gamma)[J].Biology Chemistry,1995,270(22):12953~12956.
[13]Levy A,Perelman B,Waner T.Reference blood chemical values ostrich[J].American Journal of veterinary research struthio camelus,1989,50(91):1548~1550.
[14]Ravinuthala R S,Nori U.Rosiglitazone toxicity[J].Ann Intern Med,2000,133(8):658.
[15]Stum V M,HaringH U.Glitazoneclinicaleffectand molecular mechanisms[J].Ann Med,2002,34:217~22.
[16]Wilson R P,Poe W E.Apparent inability of channel catfish to utilize dietary mono-and disaccharides as energy source[J].Nutrition,1987,117:280~285.
