淀粉酶产生菌的分离筛选
2012-09-02卢福芝钱丰杨琴劳斌
卢福芝,钱丰,杨琴,劳斌
(河池学院化学与生命科学系,广西宜州546300)
淀粉酶产生菌的分离筛选
卢福芝,钱丰,杨琴,劳斌
(河池学院化学与生命科学系,广西宜州546300)
从大米厂、淀粉厂周边环境土壤中筛选到三株产淀粉酶能力较强的菌株Jz1、Jz2、Jz3。经形态特征及染色等初步鉴定,菌株Jz1和Jz3为芽孢杆菌属(Bacillus),菌株Jz2为短小杆菌属(Curtobacterium)。采用YoungJ.Y00改良法测定此三株菌株的淀粉酶活力分别为47.29 U/mL、48.48 U/mL、49.74 U/mL,具有较好的应用潜力。
淀粉酶;筛选;鉴定
淀粉酶(E3.2.1.1)是水解淀粉和糖原酶类的总称,广泛存在于动植物和微生物中,是最早实现工业生产,并且是迄今为止用途最广、产量最大的酶制剂品种[1]。淀粉酶种类繁多,特点各异,广泛应用于食品加工、医药、造纸、印染、酿造、洗涤剂、工业副产品及废料的处理、饲料工业及微生态制剂等多种领域[2-3]。我国淀粉资源丰富,淀粉酶应用范围非常广泛,使用量巨大,但我国酶制剂产品的品种少,剂型少,产品结构极不合理,应用范围非常狭窄,应用领域仅局限于淀粉加工和洗涤剂工业。而国际上其应用范围却遍及淀粉加工、洗涤剂、纺织、纸浆、造纸、酒精发酵、烘焙食品、动物饲料、果汁生产等众多领域[4]。目前,工业上主要采用微生物发酵法大量生产淀粉酶制剂[5]。本文从土壤中筛选出产淀粉酶的菌株,并对菌株的形态特征进行鉴定及产酶能力的检测,期望能将其应用于工业领域。
1 材料与方法
1.1 土壤来源
采自广西宜州市庆远镇(原宜州市大米厂内)小型米粉加工作坊及广西罗城科潮基业科技发展有限公司(罗城银汉淀粉总厂)周边的土壤。
1.2 培养基[6]
蛋白胨10 g/L,NaC l10 g/L,牛肉膏5 g/L,可溶性淀粉2 g/L。固体培养基加入琼脂20 g/L,pH值7.0~7.2,0.1 MPa,灭菌20 min。
1.3 初筛方法
称取土壤样品1.0 g装入小三角瓶中,加入9ml无菌水,充分振荡后静置,取上清液作浓度梯度稀释[5]。吸取10-4、10-5、10-6稀释液100μL均匀涂布于筛选平板上,于28℃培养箱中倒置培养120 h。待菌落长出后向培养平板均匀喷洒卢戈氏碘液,挑取有明显透明圈的菌落转接到液体培养基中,于28℃培养箱中培养36 h后,经划线分离培养48 h获得纯种,再转接到液体培养基中,28℃培养箱中培养24 h后于4℃保存[5]。
1.4 复筛方法
将所有初筛得到的菌种经活化培养后,取0.2μL菌液点样到筛选平板上。28℃培养箱中倒置培养24 h,待菌落长出后向培养平板均匀喷洒卢戈氏碘液,测定水解透明圈及菌落的直径,挑取d0/d1(d0为水解圈直径,d1为菌落直径)较大的菌株作为实验菌株,进行菌种鉴定及酶活检测。
1.5 细菌鉴定
根据《伯杰细菌鉴定手册》(第8版)[7],对所筛选到的菌株进行菌落特征、形态观察及革兰氏染色。
1.6 淀粉酶活力测定
采用YoungJ.Y00改良法[8-10]进行酶活力测定。其原理是根据淀粉酶将淀粉水解为长短不一的短链糊精和少量的还原糖而使淀粉对碘呈蓝紫色特异反应逐渐消失的特性,通过显色消失的速度来衡量酶活力大小。
2 结果与讨论
2.1 菌株的分离筛选
通过加入可溶性淀粉的固体培养基进行菌株的初步筛选,能在筛选平板上生长,喷洒卢戈氏碘液后产生透明圈的为筛选的目的菌株[5]。通过平板的初步筛选,在平板中共筛选出18株淀粉酶产生菌。将初筛得到的18株菌株进行复筛,培养后测定各菌株的水解透明圈直径(d0)及菌落的直径(d1),并取d0与d1的比值作为衡量该菌株产淀粉酶的能力。据此从初筛的18株菌株中选出3株水解透明圈较大的菌株为实验菌株,将其命名为Jz1、Jz2、Jz3,其d0/d1平均值分别为3.40、3.75、4.67。菌株Jz1、Jz2、Jz3的水解透明圈分别如图1、图2、图3所示。

图1 菌株Jz1的水解透明圈

图2 菌株Jz2的水解透明圈

图3 菌株Jz3的水解透明圈
2.2 菌株的鉴定[7]
对Jz1、Jz2、Jz3进行菌落形态、芽孢及鞭毛观察及革兰氏染色。其鉴定结果如表1所示。
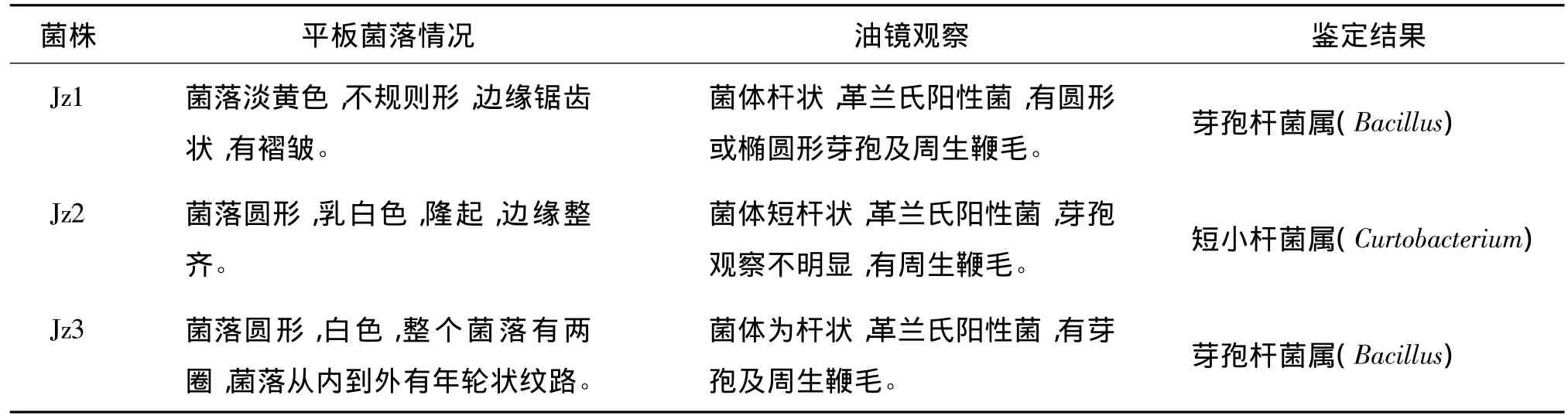
表1 菌株鉴定结果
2.3 淀粉酶活力的检测
将Jz1、Jz2、Jz3三株菌株接入液体培养基中进行发酵后,取发酵液于4℃,5 000 r/min,离心10 min,取上清液测酶活力。采用YoungJ.Y00改良法[8-10]进行酶活力测定,分别测定对照样品及3株菌株在OD620nm的光密度值。按酶活力计算公式:
酶活力(U/mL)=(R0-R)/R0×50×D(式中R0、R分别为对照液、反应液的光密度;D为酶的稀释倍数)。
根据公式计算得出3株菌株的酶活力分别为47.29 U/mL、48.48 U/mL、49.74 U/mL。其中酶活最高的为Jz3,其次是Jz2,最低是Jz1,这与d0/d1的测定结果相一致。
3 结论
(1)从原宜州市大米厂及罗城银汉淀粉总厂周边环境的土壤中,经多次分离筛选,获得Jz1、Jz2、Jz3三株产淀粉酶能力较强的菌株,经测定其淀粉酶活力分别为47.29 U/mL、48.48 U/mL、49.74 U/mL。
(2)经形态特征及染色等初步鉴定,菌株Jz1和Jz3为芽孢杆菌属(Bacillus),菌株Jz2为短小杆菌属(Curtobacterium)。
(3)实验中筛选到的三株菌株具有较高的初始酶活力,可以通过优化菌株的培养基及产酶条件提高菌株的产酶能力,并对菌株的酶学性质进行深入的研究。由于此三株菌株都是从自然界获得的野生菌株,后续实验还可以通过诱变及分子改造等技术方法改良菌种,进一步提高其产酶能力。
[1]谷军.淀粉酶的生产与应用[J].生物技术,1994,4(3):1-5.
[2]张丽苹,徐岩,金建中.酸性α-淀粉酶的研究与应用[J].酿酒科技,2002,29(3):4-15.
[3]张树政.酶制剂工业[M].北京:科学出版社,1998.
[4]居乃琥.酶工程研究和酶工程产业的新进展(Ⅱ)——国内外酶制剂工业的现状、发展趋势和对策建议[J].食品与发酵工业,2000,26 (4):38-43.
[5]张双民.土壤中淀粉酶高产菌株的分离及产酶条件的优化[J].土壤肥料,2006,(2):59-61.
[6]张强,刘成君,蒋芳,等.耐高温α-淀粉酶产生菌的分离鉴定及发酵条件与酶性质研究[J].食品与发酵工业,2005,31(2):34-37.
[7]BUCHANAN RE,GIBBONSNE.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984.
[8]朱何东,陈远钊,常峰,等.高温淀粉酶产生菌的筛选及酶学性质研究[J].酿酒科技,2006,(5):30-32.
[9]天津轻工业学院,大连轻工业学院,无锡轻工业学院,等.工业发酵分析[M].北京:轻工业出版社,1980.
[10]徐颖.高产α-淀粉酶产生菌的筛选鉴定及其酶学性质研究[D].四川:四川大学,2007.
[责任编辑刘景平]
The isolation of am ylase-producing bacterial strains
LU Fu-zhi,QIAN Feng,YANG Qin,LAO Bin
(Departerment of Chem istry and Life Science,Hechi University,Yizhou,Guangxi546300,China)
Three bacterial strains Jz1、Jz2、Jz3 show high amylase activity,which were achieved from the soil near the rice and starch factories.The bacteria strains Jz1 and Jz3 are Bacillus after preliminary identification,while the bacterial strain Jz2 is Curtobacterium.The amylase activities of the three bacterial strains are 47.29 U/mL,48.48 U/mL and 49.74 U/mL respectively,determined by YoungJ.Y00modifiedmethod.They will be well applied in the future.
amylase;screening;identification
book=0,ebook=75
Q939.97
A
1672-9021(2012)02-0026-03
卢福芝(1984-),女,广西北流人,河池学院化学与生命科学系助教,主要研究方向:微生物及分子生物学。
河池学院青年科研基金资助课题(2011A-N004)。
2012-03-01
