不同温度型小麦K+吸收动力学特征及其盐胁迫效应
2012-08-31张纪涛王林权
张纪涛,韩 坤,王林权* ,李 翠
(1西北农林科技大学资源环境学院,陕西杨凌712100;2农业部西北植物营养与农业环境重点实验室,陕西杨凌712100;3山西省农业科学院现代农业研究中心,山西太原030031;4西北农林科技大学园艺学院,陕西杨凌712100)
盐渍化是影响农业生产的主要非生物胁迫因素之一。盐胁迫主要通过渗透胁迫、离子毒害和营养失衡等抑制植物生长或导致植物死亡,这些危害均与植物对Na+等盐分离子的吸收累积有关[1-3]。K+是植物必需的大量元素,也是植物体内含量最多的阳离子,对植物的渗透调节、体内营养物质转运、光合作用等许多生理生化反应起重要的作用。植物根系对K+的吸收可以分为两种机制:由根细胞膜上的转运载体介导的高亲和吸收途径(外界K+浓度在0~1mmol/L)和由离子通道等介导的低亲和吸收途径(1~50mmol/L),其中高亲和吸收过程符合米氏方程,而低亲和吸收过程符合线性关系[4-5]。
K+、Na+理化性质相似,Na+可以竞争 K+的根系吸收转运位点,影响K+的吸收和植物体内K+的含量,在细胞内可以竞争K+的结合位点,影响代谢过程[6]。植物细胞内高的K+/Na+比值,是评价植物耐盐性的重要指标,植物维持K+/Na+比主要依赖于定位于细胞膜和液泡膜上的转运系统,包括K+、Na+的选择性和非选择性转运系统。关于Na+对K+吸收的影响主要有以下几种报道:Rubio等[7]小麦试验表明,在较低的Na+浓度范围内(μmol/L水平),Na+刺激K+吸收;同样K+也刺激Na+的吸收;但高浓度 Na+(>10~100mmol/L)抑制 K+吸收。Rains和Epstein[8]在大麦上的研究发现,高亲和K+吸收系统不为Na+抑制,而低亲和K+吸收系统则被Na+抑制。但Niu等[9]认为K+高亲和吸收系统和低亲和吸收系统都受Na+胁迫的调控,外部高浓度Na+或者低浓度K+都会促进高亲和系统而抑制低亲和系统的吸收。
张嵩午等[10]根据冬小麦灌浆结实期冠层温度,将小麦分为冷型、暖型和中间型三种。研究[11-13]表明,不同温度型小麦在光合能力、氮素营养和抗旱性等方面存在很大差异;赵旭等的试验研究表明,不同温度型小麦幼苗的耐盐能力差异显著,主要是由于Na+和 K+吸收能力的差异所致[14-15]。李青松进一步研究了Na+的吸收动力学特征,表明不同温度型小麦间Na+的吸收差异显著[16],但对其K+的吸收动力学特征未见报道。为进一步明确不同温度型小麦的K+吸收特征,以及盐胁迫对K+吸收动力学特征的影响,本试验通过吸收动力学方法和药理学方法研究了不同温度型小麦K+吸收动力学特征,这对揭示不同温度型小麦钾营养特征和耐盐性差异性的内在机制具有重要的理论意义。
1 材料与方法
1.1 材料培养
供试小麦品种为NR9405(暖型)、小偃六号(中间型)、RB6和陕229(冷型)4个温度型。挑选大小一致、饱满的种子用10%的次氯酸钠(NaClO)消毒10 min,再用无菌水冲洗干净,并浸种12~24 h,然后将吸胀种子均匀播种于倒置的塑料筐底部,塑料筐底正好浸没于水中,在ZPW-350型智能植物培养箱内黑暗催芽,设置温度为25℃,湿度为80%。待种子萌发后,更改培养温度为昼25℃/夜22℃,光照为7430/0 Lx,湿度50%,发芽后7d更换为1/4的Hoagland营养液继续培养,3d后更换为1/2 Hoagland营养液。发芽后每天用微型气泵(银湖牌,SP-780型,中山市日胜电器制品有限公司生产)通气,上午下午各1h,取14d苗龄的长势良好、均匀一致的幼苗,用于试验材料。
1.2 试验内容与方法
将选取的小麦幼苗,去掉胚乳,用0.2 mmol/L CaSO4的溶液把根冲洗干净,转移到缺钾营养液中。营养液组成如下:5mmol/L Ca(NO3)2、2mmol/L MgSO4、5mmol/L Ca(H2PO4)2+ 阿农微量元素配方[17],饥饿处理48 h 。
1.2.1 K+吸收动力学研究 试验K+浓度梯度设置0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0、14.0、15.0、20.0、30.0、40.0、50.0 mmol/L 29个K+浓度,KCl作为K+源,支持电解质溶液为0.2 mmol/L的CaSO4。每瓶[100 mL的聚酯(PET)棕色塑料瓶]加入100 mL处理液,放置5株幼苗,使根系全部浸入到处理液中,用脱脂棉和瓶塞固定于棕色塑料瓶中,并用parafilm封口膜密封培养,密封后称取瓶总重(W0)。培养条件设置为:温度25℃/22℃,光照5000 Lx,湿度50%;准确培养24 h后测定相关指标。吸收结束后称取瓶总重(W1),然后马上取出幼苗,将幼苗根系与地上部分分开,75℃烘干48 h后称取根干重(Root dry weight,RDW)。剩余吸收液中K+浓度(C1)用日立AA320型原子吸收分光光度计测定。每个处理重复3~4次。
1.2.2 Na+对K+高亲和吸收动力学特征的影响
试验 K+浓度梯度设置 0、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7 、0.8、0.9 和 1.0 mmol/L 12 个水平;Na+的浓度设为0、50和100 mmol/L 3个浓度水平;支持电解质溶液为0.2 mmol/L CaSO4,为抑制低亲和系统的参与,加特异性低亲和系统抑制剂TEA[18](四乙基氯化铵,使用浓度为1.0 mmol/L)。幼苗处理、培养条件同1.2.1所述,处理6 h后用与1.2.1中相同的方法测定相关数据。
1.2.3 Na+对K+低亲和吸收动力学特征的影响试验 K+浓度梯度设置 1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、13.0、15.0、20.0、25.0、30.0、35.0、40.0、45.0、50.0 mmol/L 20 个水平;Na+的浓度设为0、100和150 mmol/L 3个浓度水平;支持电解质溶液为0.2 mmol/L CaSO4,为抑制高亲和系统的参与,加高亲和系统抑制剂NEM[4](C6H7NO2,N-乙基顺丁烯二酰亚胺,N-Ethylmaleimide;使用浓度为0.5mmol/L)。幼苗处理、培养条件同高亲和吸收过程,处理48 h后用1.2.1中方法测定相关数据。
1.2.4 Na+对 K+累积的影响 试验设0、0.5、1、5、15mmol/L 5 个 K+浓度和 0、50、100、150 mmol/L 4个Na+浓度,共20个处理组合。以1/2 Hoagland营养液为基液,调节处理液pH在6.5~6.8。培养方法与条件同1.1,每培养2d更换一次培养液,4d后取出幼苗测定地上部组织K+含量。每个处理重复4次。
1.3 数据处理
参数计算:1)K+实际吸收速率为

式中:C0是指处理液初始K+浓度;C1为吸收结束时剩余吸收液中K+浓度;V1指吸收结束后剩余吸收液体积,V1=V0-(W0-W1)/ρ水。
2)使用 Oringin 8.0 根据 Nielsen 等[19-20]的方法进行K+高亲和吸收米氏方程的拟合,同时得到Imax(最大吸收速率)、Km(亲和系数,吸收速率为Imax的1/2时介质K+浓度,反映植物根系对离子的亲和力)、Cmin(K+吸收补偿点,吸收速率为0时的介质中K+浓度,反映植物的耐低钾能力)值。根据式2)和3)分别进行高亲和与低亲和吸收动力学方程拟合与相关吸收特征值的计算。

文中所有数据使用Excel 2007进行计算处理,Oringin 8.0拟合并作图。
2 结果与分析
2.1 不同温度型小麦K+吸收动力学特征
由图1可以看出,随介质中K+浓度的增加,不同温度型小麦幼苗K+吸收速率逐渐增加,在0~1 mmol/L的浓度范围内,吸收速率与介质K+浓度的关系符合米氏方程。从表1可以看出,冷型小麦陕229和RB6的最大吸收速率(Imax)为42~44 μmol/(h·g),RDW;暖型小麦NR9405和中间型小麦小偃六号为33~36 μmol/(h·g),RDW。这说明,供试的冷型小麦单位根干物质K+转运载体数量或转运容量高于暖型小麦。
亲和系数(Km)表示根细胞膜上转运载体与K+的亲和性,该值越小,说明转运体与离子的亲和能力越大,选择吸收性能力越强。本研究表明,冷型小麦陕229和RB6的Km值为0.43 mmol/L;暖型小麦NR9405和中间型小偃六号为0.33~0.36 mmol/L。可见,暖型小麦幼苗根系高亲和载体与K+亲和性高于冷型小麦。
在1~50 mmol/L浓度范围内,四种小麦的Imax值在183~253 μmol/(g·h),RDW 之间,品种间差异较大,依次表现为:小偃六号<陕229<NR9405<RB6。小偃六号与陕229的Km值较小,在20 mmol/L左右,而NR9405和RB6较高在30 mmol/L左右。

图1 不同温度型小麦K+吸收动力学曲线Fig.1 K+absorption kinetics curves of wheat genotypes with different canopy temperatures
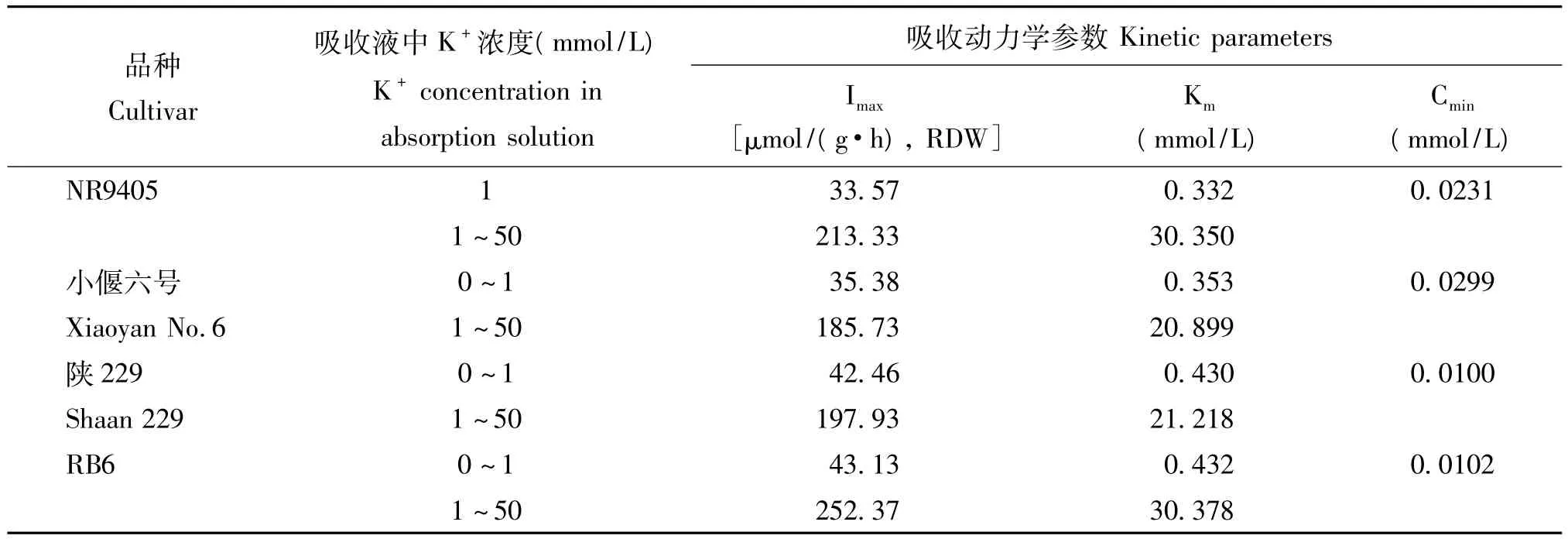
表1 不同温度型小麦幼苗K+吸收动力学参数Table 1 K+absorption kinetics parameters of wheat genotypes with different canopy temperature types
2.2 Na+对不同温度型小麦K+高亲和吸收的影响
在0~100mmol/L的Na+条件下,吸收动力学过程符合米氏方程,说明盐胁迫不改变高亲和吸收系统的基本特征(图2)。
由表1和表2可见,抑制低亲和吸收系统后,非盐条件下小偃六号和NR9405的Imax值分别为43.016和44.189 μmol/(h·g),RDW;两种冷型小麦陕229和RB6的Imax值均达到60 μmol/(h·g),RDW以上,显著高于暖型小麦NR9405和中间型小麦小偃六号。这说明,抑制低亲和吸收途径有利于增加4种小麦的K+的高亲和转运载体数量或转运容量。
抑制低亲和吸收系统后,两种冷型小麦Km值显著增加,均达到0.6 mmol/L以上,而小偃六号和NR9405的 Km值几乎没有变化,为 0.35~0.37mmol/L。说明暖型小麦NR9405和中间型小偃六号的K+高亲和转运载体对K+的亲和性不受低亲和吸收系统的影响,而冷型小麦的K+高亲和吸收系统受低亲和吸收系统影响。
由图2和表2可见,50~100mmol/L的Na+降低了高亲和K+的吸收速率,但对不同品种的影响程度不同。50 mmol/L的Na+对暖型小麦NR9405的Imax影响最大,降低达29%;陕229降幅仅为12%;100mmol/L Na+对小偃六号的Imax影响最小,降幅为37%,对RB6的Imax影响最大,降幅达60%。

图2 Na+对不同温度型小麦K+高亲和吸收的影响Fig.2 Effect of Na+on K+high affinity absorption of wheat genotypes with different canopy temperatures

表2 Na+对不同温度型小麦K+高亲和吸收动力学特征参数的影响Table 2 Effect of Na+on K+high affinity absorption kinetics character parameters
50~100 mmol/L的 Na+胁迫对暖型小麦NR9405和中间型小麦小偃六号的Km值影响较小,Km值在0.34~0.38mmol/L之间。而100 mmol/L的Na+则降低了冷型小麦的Km值,降低程度达33% ~42%。这表明,盐分离子的存在,影响了根系K+高亲和转运载体的选择性和亲和性,不同温度型小麦的反应不同。NR9405和小偃六号的K+高亲和载体对K+的亲和性受盐胁迫影响较小,而盐胁迫可以提高冷型小麦对K+的亲和性。
2.3 Na+对不同温度型小麦K+低亲和吸收的影响
2.3.1 高亲和吸收途径对不同温度型小麦K+低亲和吸收动力学特征的影响 由图3和表3可以看出,在非盐胁迫条件下,K+吸收速率与介质K+浓度变化的关系符合米氏方程。抑制高亲和吸收系统后,4种小麦的 Imax值在 314 ~440 μmol/(h·g),RDW之间,而Km值在29~55 mmol/L之间,均显著高于未抑制高亲和吸收系统的测定值(见表1)。说明抑制高亲和吸收系统提高4种小麦的K+低亲和吸收途径的载体表达或转运容量,但降低了其对K+的亲和性。
2.3.2 Na+对不同温度型小麦K+高亲和吸收动力学特征的影响 使用Origin进行曲线拟合结果表明,在100~150 mmol/L Na+存在下的四种小麦的K+低亲和吸收过程不符合米氏方程,只能用线性描述(图3)。这说明,Na+的存在改变了小麦K+的低亲和运输蛋白及其吸收方式。
在100~150 mmol/LNa+处理下,在一定的K+浓度范围内(约1~3 mmol/L内),K+吸收速率表现为负值,说明K+的外流速率大于吸收速率。这可能由于加入了高亲和吸收系统的抑制剂,导致高亲和吸收减少或消失所致。

图3 Na+对不同温度型小麦K+低亲和吸收的影响Fig.3 Effect of Na+on K+low affinityabsorption of wheat genotypes with different canopy temperatures
2.4 Na+对不同温度型小麦地上部K+、Na+离子吸收的影响
吸收动力学研究表明,NR9405的高亲和吸收系统对K+的亲和力高,且不受低亲和吸收系统和盐胁迫的影响,而冷型小麦则相反。为进一步验证盐胁迫对不同温度型小麦K+吸收累积的影响,研究了盐胁迫对暖型小麦NR9405和冷型小麦RB6地上部钾离子含量的影响,结果如图4所示。随盐浓度(0~150mmol/L)的增加,两种小麦地上部K+含量逐渐降低,说明在各K+浓度下Na+均抑制不同温度型小麦K+的地上部累积。但在各盐浓度下NR9405的K+含量均高于RB6,说明NR9405耐盐性强的一个重要原因是盐胁迫下能吸收累积更多的K+,这可能与其高亲和吸收系统在盐胁迫下的高亲和力和高稳定性有关。
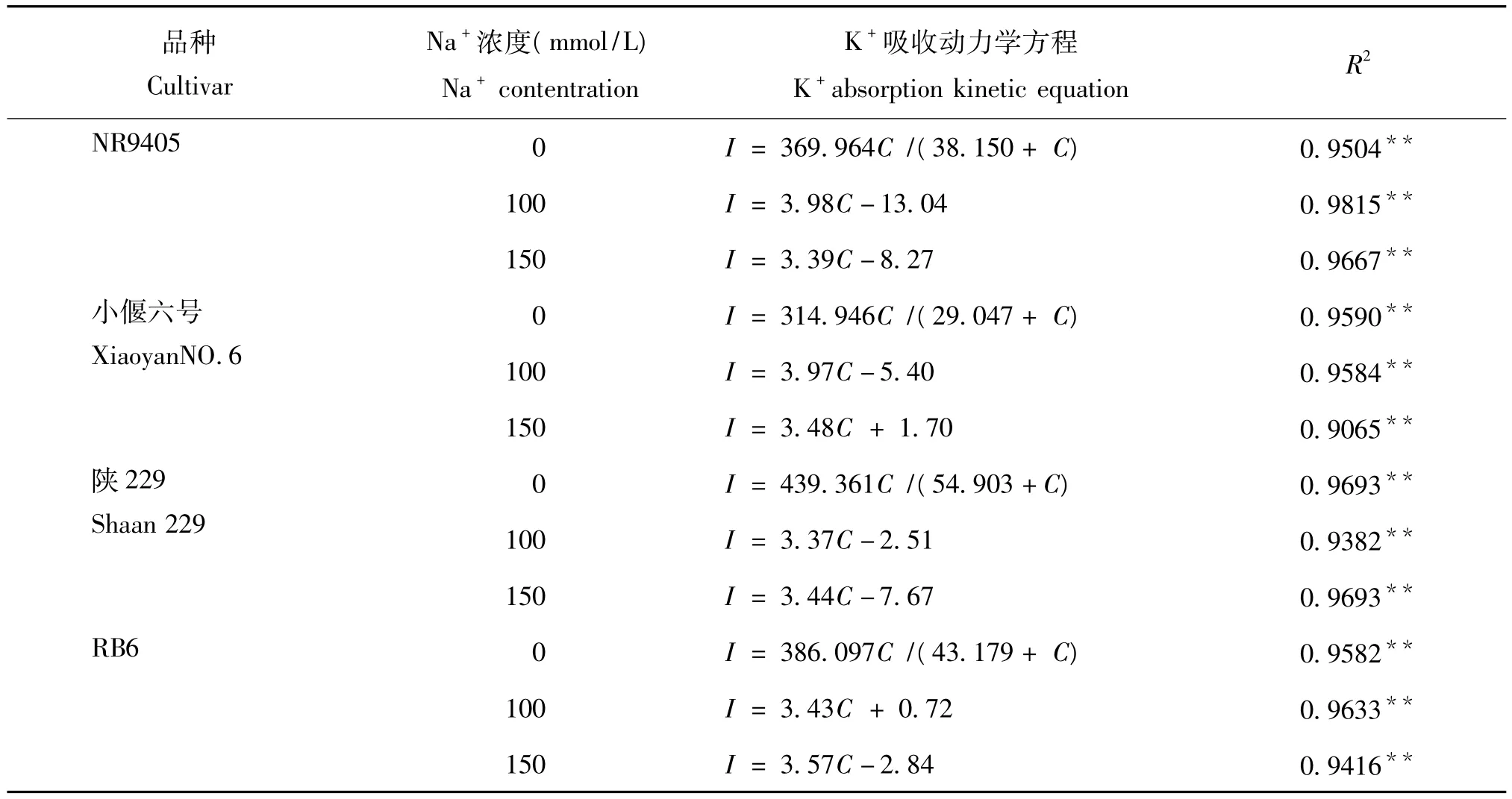
表3 Na+对不同温度型小麦K+低亲和吸收动力学特征参数的影响Table 3 Effect of Na+on the parameters of K+low affinity absorption kinetics

图4 Na+对不同温度型小麦地上部K+含量的影响Fig.4 Effect of Na+on K+content of shoot of wheat genotypes with different canopy temperatures
3 讨论
吸收动力学方法是评价植物养分吸收能力的经典方法,自从Esptein等提出该方法以来,已被广泛应用。Kochian等[4]研究证明,植物对K+吸收的曲线分为饱和与直线两部分,分别对应于高亲和吸收途径和低亲和吸收途径。但也有研究认为,植物K+吸收是具有饱和现象的双重吸收过程[17]。本试验通过对不同温度型小麦完整植株的K+吸收研究表明,在0~1和1~50 mmol/L的K+浓度范围内,4种小麦K+吸收均具有饱和现象,即符合米氏方程,具饱和现象的双重吸收过程;Na+的存在没有改变K+高亲和吸收过程的基本特征,但影响了K+低亲和吸收(1~50 mmol/L)方式,使得其由饱和吸收过程变成了直线吸收特征。Na+和K+两种离子吸收的相互竞争关系一直是耐盐研究的热点,有研究证明,Na+对高、低亲和 K+吸收均有一定的影响。Kronzucker等的研究表明,50~100 mmol/L的Na+降低了大麦对0.1 mmol/L[K+]ext的 K+吸收积累[21],Fu等在拟南芥上的研究也表明,0.1 ~100 mmol/L NaCl降低 0.02 mmol/L K+的吸收[22],Martinez-cordero的研究证明K+高亲和途径可以部分被Na+竞争[23]。Kronzucher等试验证明 100 mmol/L的Na+存在降低了低亲和K+的跨膜进入,并引起了低亲和范围内K+的外流,K+的净流入下降了20% ~60%[24];Kochian等在玉米上的研究也表明Na+能降低低亲和 K+吸收[25]。本试验结果也表明,Na+对K+高亲和吸收和低亲和吸收均有抑制效应。尤其在低钾条件(约1~3 mmol/L)下,K+的低亲和吸收速率为负值,一方面可能是由于盐胁迫下Na+通过非选择性阳离子通道(Non-selective cation channel,NSCC)等低亲和K+吸收途径进入细胞质,引起细胞膜去极化,刺激K+通过外整流型K+通道(K+outward rectifying channels,KORC)和非电压依赖型NSCC(Voltage independent NSCC,Vi-NSCC)流出细胞质,以维持细胞质内的电荷平衡[26];另一方面是由于抑制了高亲和吸收系统所致。Na+对K+吸收的影响具有基因型差异,暖型小麦的高亲和系统不受Na+影响。
吸收动力学参数可以定量反应和评价植物对养分的吸收能力,但研究方法不同,取得的参数值存在一定差异。本试验结果显示,苗龄14 d的小麦幼苗K+高亲和吸收的 Imax值在 33 ~43 μmol/(h·g),RDW,而Km值在0.33~0.43 mmol/L之间。抑制低亲和吸收系统后,4种小麦的高亲和系统Imax值均增大,且冷型小麦的Km值增高,但对NR9405和小偃六号的Km影响不大。冷型小麦陕229和RB6具有相对高的Imax和Km值,比较适合于高浓度的养分条件;暖型小麦和小偃六号相对具有较低的Imax和Km值,较适合低的养分状况[27]。暖型小麦NR9405和小偃六号幼苗的Km值低于两种冷型小麦,且其不受低亲和吸收系统和50~100 mmol/L盐胁迫的影响,说明在盐胁迫环境中NR9405和小偃六号根系K+吸收能力高于冷型小麦,与赵旭等[14]的研究结论一致。关于植物K+低亲和吸收能力的评价研究较少,缺少相应的评价参数。本试验研究结果表明,在非盐环境中,4种小麦基因型的吸收动力学过程也符合米氏方程,但是在盐胁迫下失去了饱和吸收动力学特征,说明其运输蛋白可能在盐胁迫下发生改变,吸收容量增加,而选择性减小,钠可能通过低亲和吸收系统进入根细胞内。有关机理尚有待进一步研究。
不同温度型小麦幼苗K+两条途径吸收转运对盐胁迫响应不同。从试验结果可以看出,对于K+高亲和系统,0~100 mmol/L的Na+浓度下NR9405和小偃六号的Km值和Imax值变化幅度不大;而两种冷型小麦在0~50 mmol/L的Na+范围内Km值略有增加,在100 mmol/LNa+条件下,显著降低了Km和Imax值,这说明冷型小麦对Na+胁迫响应的反应较暖型小麦敏感。从NR9405和RB6两种小麦盐胁迫下地上部K+离子累积量来看,NR9405地上部K+累积能力强,进一步说明NR9405耐盐性强的原因可能是其高亲和动力学系统在盐胁迫下比较稳定,有利于K+吸收和累积。这说明盐胁迫下,高亲和吸收系统的稳定性是暖型小麦选择性吸收K+能力较高的重要因素之一。在植物抗盐育种中其可作为一个抗盐能力优劣的选择指标。
4 结论
1)在0~50 mmol/L的K+浓度范围内,K+吸收可以分为0~1和1~50 mmol/L两个具有饱和特征的吸收过程。
2)暖型小麦NR9405和小偃六号的高亲和性运输系统Km小而稳定,不受盐胁迫和低亲和系统的影响。
3)抑制低亲和系统后增加了4种小麦的高亲和转运载体数量,但降低了冷型小麦对K+的亲和力;抑制高亲和吸收,有利于增加低亲和吸收的转运容量,但却降低了对K+的亲和性。
4)高亲和与低亲和K+吸收系统均受盐胁迫的抑制。
[1]Zhu J K.Plant salt tolerance[J].Trends Plant Sci.,2001,6(2):66-71.
[2]Munns R,Tester M.Mechanisms of salinity tolerance[J].Plant Biol.,2008,59(1):651 -681.
[3]马翠兰,刘星辉,王湘平.盐胁迫下柚实生苗生长、矿质营养及离子吸收特性研究[J].植物营养与肥料学报,2004,10(3):319-323.
Ma C L,Liu X H,Wang X P.Study on the growth and characteristics of mineral nutrition and ion absorption of pomelo seedlings under slat stress[J].Plant Nutr.Fert.Sci.,2004,10(3):319-323.
[4]Kochian L V,Lucas W J.Potassium transport in corn roots:I.Resolution of kinetics into a saturable and linear component[J].Plant Physiol.,1982,70(6):1723 -1731.
[5]吴平,印莉萍,张立平.植物营养分子生理学[M].北京:科学出版社,2001.164-165.
Wu P,Yin L P,Zhang L P.Plant nutritional molecular physiology[M].Beijing:Science Press,2001.164-165.
[6]Maathuis F J M,Amtmann A.K+nutrition and Na+toxicity:the basis of cellular K+/Na+ratios[J].Ann.Bot.,1999,84(2):123-133.
[7]Rubio F,Gassmann W,Schroeder J I.Sodium-driven potassium uptake by the plant potassium transporter HKT1 and mutations conferring salt tolerance[J].Science,1995,270(5242):1660-1663.
[8]Rains D W,Epstein E.Sodium absorption by barley roots:role of the dual mechanisms of alkali cation transport[J].Plant Physiol.,1967,42(3):314 -318.
[9]Niu X,Bressan R A,Hasegawa P Met al.Ion homeostasis in NaCl stress environments[J].Plant Physiol.,1995,109(3):735-742.
[10]张嵩午.小麦温型现象研究[J].应用生态学报,1997,8(5):471-474.
Zhang S W.Temperature type phenomenon of wheat[J].Chin.J.App1.Eco1.,1997,8(5):471-474.
[11]冯佰利,张宾,高小丽,等.抗旱小麦的冷温特征及其生理特性分析[J].作物学报,2004,30(12):1215-1219.
Feng B L,Zhang B,Gao X Let al.Analysis on lower canopy temperature and physiological characteristics of drought resistant wheat[J].Acta Agron.Sin.,2004,30(12):1215 -1219.
[12]周春菊,张嵩午,王林权.不同施肥条件下冷、暖型小麦旗叶光合生理特性的研究[J].西北植物学报,2006,26(12):251-256.
Zhou C J,Zhang S W,Wang L Q.Photosynthetic and physiological characters of the flag leaves in cold and warm types of wheat in different fertilization modes[J].Acta Bot.Bor-Occid.Sin.,2006,26(12):251-256.
[13]周春菊,张嵩午,王林权,等.冷型小麦氮素吸收积累特性的研究[J].植物营养与肥料学报,2006,12(2):162-168.
Zhou C J,Zhang S W,Wang L Qet al.Studies on nitrogen uptake and accumulation of cold type wheat[J].Plant Nutr.Fert.Sci.,2006,12(2):162 -168.
[14]赵旭,王林权,周春菊,等.盐胁迫对四种基因型冬小麦幼苗Na+、K+吸收和累积的影响[J].生态学报,2007,27(1):205-213.
Zhan X,Wang L Q,Zhou C Jet al.Effects of salt stress on the absorption and accumulation of Na+and K+in seedlings of four winter wheat(Tritium aestivum)genotypes [J].Acta Ecol.Sin.,2007,27(1):205 -213.
[15]赵旭,王林权,周春菊,等.盐胁迫对不同基因型冬小麦发芽和出苗的影响[J].干旱地区农业研究,2005,23(4):108-112.
Zhao X,Wang L Q,Zhou C Jet al.Effects of salt stress on germination and emergence of different winter wheat genotypes[J].Agric.Res.Arid Areas,2005,23(4):108 -112.
[16]李青松,王俪梅,汪德勇,等.不同基因型冬小麦Na+吸收动力学特征及其耐盐性[J].土壤学报,2010,47(1):145-152.
Li Q S,Wang L M,Wang D Yet al.Dynamics of sodium uptake of winter wheats different in genotype and their salt tolerance[J].Acta Pedol.Sin.,2010,47(1):145 -152.
[17]毛达如.植物营养研究方法(第二版)[M].北京:中国农业大学出版社,2005.335-337.Mao D R.Plant nutrition research method(Second edition)[M].Beijing:China Agricultural University Press,2005.335-337.
[18]孙小茗.钾离子跨细胞膜吸收过程受铵影响的机理探讨[D].江苏:扬州大学硕士学位论文,2006.25-31.
Sun X M.Studies on mechanism of effect ofon K+transport path across membrane[D].Jiangsu:MS thesis,Yangzhou University,2006.25-31.
[19]Nielsen N E.Differences among genotypes of corn in the kinetics of P uptake[J].Agron.J.,1978,70(5):695 -698.
[20]蒋廷惠,郑绍建,石锦芹,等.植物吸收养分动力学研究中的几个问题[J].植物营养与肥料学报,1995,1(2):11-17.
Jiang T H,Zheng S J,Shi J Qet al.Several considerations in kinetic research on nutrients uptake by plants[J].Plant Nutr.Fert.Sci.,1995,1(2):11 -17.
[21]Kronzucher H J,Szczerba M W,Moazamigoudarzi Met al.The cytosolic Na+∶K+ratio does not explain salinity induced growth impairment in barley:a dual-tracer study using42K+and24Na+[J].Plant Cell Environ.,2006,29(12):2228 -2237.
[22]Fu H H,Luan S.AtKUP1:a dual-affinity K+transporter from arabidopsis[J].Plant Cell,1998,10(1):63 -74.
[23]Martínez C M A,Vicente M,Francisco R.High-affinity K+uptake in pepper plants [J].J.Exp.Bot.,2005,56(416):1553-1562.
[24]Kronzucher H J,Szczerba M W,Schulze L Met al.Non-reciprocal interactions between K+and Na+ions in barley(Hordeum vulgareL.) [J].J.Exp.Bot.,2008,59(10):2793 -2801.
[25]Kochian L V,Jiao X Z,Lucas W J.Potassium transport in corn roots:IV.Characterization of the linear component[J].Plant Physiol.,1985,79(3):771 -776.
[26]Zepeda-Jazo I,Shabala S,Chen Z H,Pottosin I I.Na+– K+transport in roots under salt strees [J].Plant Sign.Behav,2008,3(6):401-403
[27]赵学强,介晓磊,李有田,等.不同基因型小麦钾离子吸收动力学分析[J].植物营养与肥料学报,2006,12(3):307-312.
Zhao X Q,Jie X L,Li Y Tet al.Study on potassium uptake kinetics by different genotype wheat [J].Plant Nutr.Fert.Sci.,2006,12(3):307 -312.
