石榴皮鞣质对大鼠乙醇性胃黏膜损伤的保护作用研究
2012-08-29邱红梅赖舒尚京川周岐新重庆医科大学药学院药理教研室重庆市生物化学与分子药理学重点实验室重庆40006重庆医科大学药物分析教研室重庆40006
邱红梅,赖舒,尚京川,周岐新#(.重庆医科大学药学院药理教研室/重庆市生物化学与分子药理学重点实验室,重庆 40006;重庆医科大学药物分析教研室,重庆 40006)
石榴皮是石榴科植物石榴(Punica granatunL)的干燥果皮,其主要成分为石榴皮鞣质,占10.4%~21.3%。石榴皮性温,味涩,入肺、肾、结肠经,具有生津止渴、涩肠、止血等功效[1,2]。有研究证明,石榴皮的提取物对多种原因引起的消化系统溃疡有保护作用。石榴皮提取物可抑制大鼠幽门结扎型胃溃疡的形成[3];也对大鼠阿司匹林和乙醇诱导的实验性胃黏膜损伤和结肠炎有保护作用[4],但其作用机制尚未见报道。为此,本研究采用丙酮提取和乙酸乙酯萃取法获得石榴皮鞣质,观察其对大鼠乙醇性胃黏膜损伤的保护作用并对其作用机制进行研究。
1 仪器与材料
1.1 仪器
SZ297型自动三重纯水蒸馏器(上海亚荣生化仪器厂);保温干燥箱(重庆实验设备厂);A2000S型电子分析天平(德国Sartorius公司);721型分光光度计(上海第三分析仪器厂);SN-695型智能γ-计数器(上海核福光电仪器有限公司);-70℃低温冰箱(德国Forma Scientic公司);3K30型低温离心机(德国Sigma公司);UV265紫外-可见分光光度计(日本岛津公司);BH-2型光学显微镜(日本Olympus公司);CM-2000B型生物医学图像分析系统(北京航天航空大学)。
1.2 试药
干燥石榴皮(批号:070911),购自徐州医药有限公司中药饮片厂,由重庆医科大学化学教研室尚京川教授参照丙酮提取、醋酸乙酯萃取法从石榴皮中提取鞣质,总鞣质含量为73%[5];枸橼酸铋钾(丽珠集团丽珠制药厂,批号:070906);一氧化氮(NO)、丙二醛(MDA)测试盒(南京建成生物工程研究所);多聚赖氨酸、兔抗一氧化氮合酶(NOS)1多克隆抗体、兔抗NOS2多克隆抗体、兔抗NOS3多克隆抗体、即用型SABC免疫组化试剂盒(武汉博士德生物工程公司)。
1.3 动物
清洁级SD大鼠,♀♂兼半,体重180~230g,由重庆医科大学动物实验中心提供(动物使用合格证号:SCXK(渝)20020001)。
2 方法
2.1 复制模型和分组、给药
实验分为6组,即正常(等容生理盐水)、模型(等容生理盐水)、枸橼酸铋钾(100mg·kg-1)和石榴皮鞣质高、中、低剂量(500、150、50mg·kg-1)组。ig给药,给药体积为0.01mL·g-1,给药2h后除正常组外其余各组均ig无水乙醇1.5mL/只以复制幽门结扎型胃溃疡大鼠模型。
2.2 观察指标
2.2.1 胃黏膜溃疡指数的观察 ig无水乙醇1h后,处死大鼠,打开腹腔并结扎贲门和幽门,向胃腔内注入1%甲醛溶液2mL后,取出胃并立即浸泡于1%甲醛中5min,然后用清水漂洗胃体,10min后按照Main and Whittle方法[4]直接测量胃部溃疡面积,观察并记录溃疡得分数:溃疡长度为≤1、1~2、2~3mm时分数分别为1、2、3。将记录总分除以10得溃疡指数,并按下列公式计算溃疡抑制率:溃疡抑制率=(模型组溃疡指数-给药组溃疡指数)/模型组溃疡指数×100%。
2.2.2 胃黏膜病理形态学的观察 ig无水乙醇1h后,处死大鼠,打开腹腔并结扎贲门和幽门,向胃腔内注入1%甲醛溶液2mL后,取出胃,从胃窦至胃体取下一条状胃组织,置于10%福尔马林液中固定6~8h,乙醇梯度脱水,常规石蜡包埋切片(切片厚约4μm),HE染色,光镜下进行组织形态学观察。保存切片供免疫组化分析用。
2.2.3 胃黏膜NO和MDA含量的检测 将“2.2.2”项下取完条状组织后余下鼠胃,于冰浴上用滤纸吸干,迅速刮取胃黏膜,于-70℃贮藏,备用。称重,用冰生理盐水制成10%胃黏膜组织匀浆。4℃下2000r·min-1离心8min,取上清液,按试剂盒说明书进行NO、MDA测定。
2.2.4 胃黏膜神经元型(n)NOS、内皮型(e)NOS表达的检测 取石蜡切片常规脱蜡脱水;切片滴加3%H2O2液,室温孵育10min,灭活内源性过氧化物酶;蒸馏水冲洗,PBS浸泡5min;将切片浸入0.01mol·L-1枸橼酸盐缓冲液(pH 6.0)中,电炉加热至沸腾后断电,间隔10min,反复上述操作2次,冷却;PBS冲洗3min×3次;滴加抗原修复液Ⅰ于切片上,室温10min后PBS冲洗3min×3次;滴加正常山羊血清封闭液,室温20min,甩去多余液体,不洗;分别滴加兔抗NOS1多克隆抗体、兔抗NOS2多克隆抗体(稀释度为1∶100),4℃过夜;PBS冲洗5min×5次;滴加生物素化山羊抗鼠IgG,37℃孵育20min;PBS冲洗5min×3次;滴加试剂SABC,37℃孵育20min;PBS冲洗5min×4次;滴加DAB在室温下显色,镜下控制反应时间,出现棕黄色颗粒时即用蒸馏水冲洗终止反应;50℃条件下脱水,用二甲苯透明,中性树胶封片;光镜下观察nNOS、eNOS蛋白分布;采用生物医学图像分析系统分析,每张切片取2个视野,在10×20倍视野下测面积阳性积分光密度,并以其代表nNOS、eNOS蛋白含量。
2.3 统计学方法
3 结果
3.1 胃黏膜溃疡指数与溃疡抑制率
与模型组比较,石榴皮鞣质高、中剂量组大鼠胃溃疡指数显著降低(P<0.01),溃疡抑制率显著增加(P<0.01)。石榴皮鞣质对模型大鼠胃黏膜的影响见表1、图1。
表1 石榴皮鞣质对模型大鼠胃黏膜的影响(±s,n=8)Tab 1 Effects of tannins from P.granatum on gastric mucosa in model rats(±s,n=8)
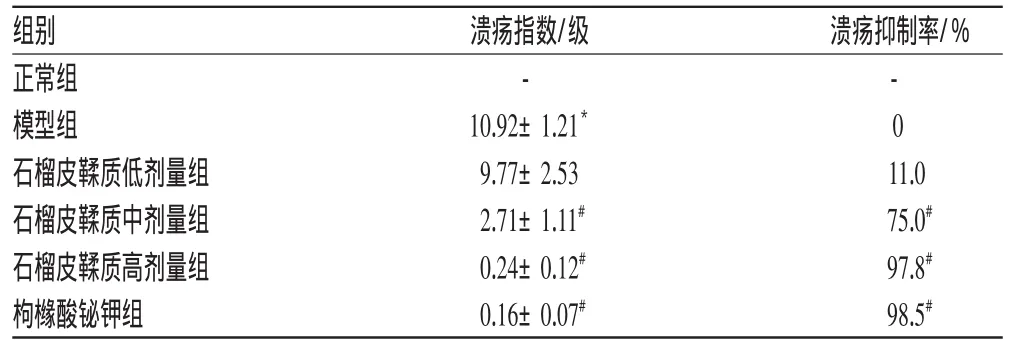
表1 石榴皮鞣质对模型大鼠胃黏膜的影响(±s,n=8)Tab 1 Effects of tannins from P.granatum on gastric mucosa in model rats(±s,n=8)
与正常组比较:*P<0.01;与模型组比较:#P<0.01vs.normal group:*P<0.01;vs.model group:#P<0.01
溃疡抑制率/%组别正常组模型组石榴皮鞣质低剂量组石榴皮鞣质中剂量组石榴皮鞣质高剂量组枸橼酸铋钾组溃疡指数/级-10.92±1.21*9.77±2.532.71±1.11#0.24±0.12#0.16±0.07#- 011.075.0#97.8#98.5#
3.2 胃黏膜病理组织切片观察
HE染色后,光镜下观察可见正常组大鼠胃黏膜层厚薄均匀,组织结构层次清楚,上皮完整,连续性好,腺体排列整齐,无充血现象;模型组大鼠乙醇所致胃黏膜损伤虽未累及黏膜肌层,但可见黏膜灶状糜烂出血,上皮细胞受损破坏,黏液腺脱落,上皮与固有层分离,腺体结构破坏甚至凝固性坏死,核固缩,固有层毛细血管扩张充血,且见中性粒细胞、少量淋巴细胞、嗜酸性粒细胞和浆细胞等急、慢性炎症细胞浸润;而枸橼酸铋钾和石榴皮鞣质高剂量组大鼠胃黏膜未见明显损伤,上皮细胞偶有损伤亦较轻微,仅见毛细血管扩张充血、炎性分泌物、少量坏死组织和纤维蛋白。石榴皮鞣质对模型大鼠损伤性胃黏膜病理形态学影响见图2。
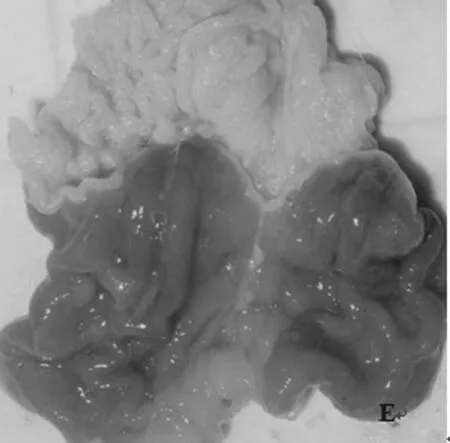
图1 石榴皮鞣质对模型大鼠胃黏膜的影响A.模型组;B.石榴皮鞣质低剂量组;C.石榴皮鞣质中剂量组;D.石榴皮鞣质高剂量组;E.枸橼酸铋钾组Fig 1 Effects of tannins from P.granatum on gastric mucosa in model ratsA.model group;B.tannins from P.granatum low-dose group;C.tannins from P.granatum medium-dose group;D.tannins from P.granatum high-dose group;E.colloidal bismuth subcitrate group
3.3 胃黏膜MDA、NO含量检测
与正常组比较,模型组MDA含量显著升高,NO含量显著降低(P<0.01)。与模型组比较,石榴皮鞣质高、中剂量组MDA含量显著降低,NO含量显著升高(P<0.01或P<0.05)。石榴皮鞣质对模型大鼠胃黏膜NO和MDA含量的影响见表2。
3.4 胃黏膜nNOS、eNOS表达水平分析
免疫组化分析显示,正常组nNOS、eNOS在胃组织广泛分布。与正常组比较,模型组nNOS、eNOS在胃组织的分布与正常大鼠一致,但表达量均显著降低(P<0.01或P<0.05)。与模型组比较,石榴皮鞣质高、中、低剂量组nNOS、eNOS在胃黏膜的表达有减弱趋势,但无显著性差异。石榴皮鞣质对模型大鼠胃黏膜nNOS、eNOS表达的影响见表3。

图2 石榴皮鞣质对模型大鼠损伤性胃黏膜病理形态学影响(HE染色,200×)A:正常组;B:模型组;C:石榴皮鞣质高剂量组;D:枸橼酸铋钾组Fig 2Effect of pathomorphology of tannins from P.granatum on gastric mucosa in model rats(HE staining,200×)A.normal group;B.model group;C.tannins from P.granatum highdose group;D.colloidal bismuth subcitrate group
表2 石榴皮鞣质对模型大鼠胃黏膜NO和MDA含量的影响(±s,n=8)Tab 2Effects of tannins from P.granatum on the contents of NO and MDAin gastric mucosa in rats(±s,n=8)
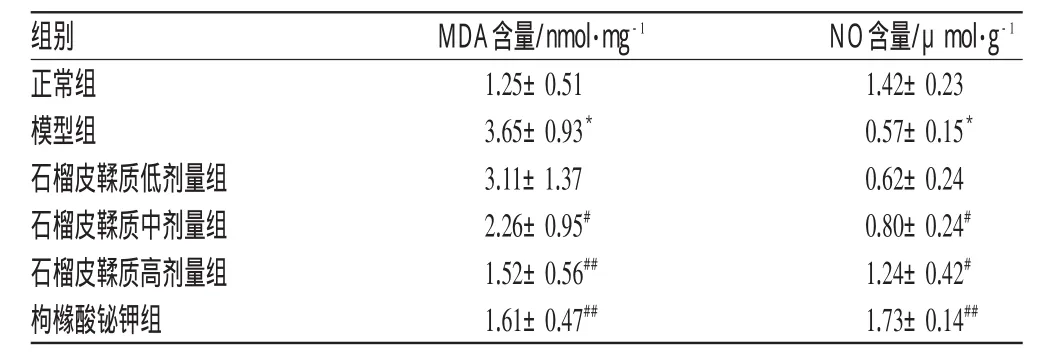
表2 石榴皮鞣质对模型大鼠胃黏膜NO和MDA含量的影响(±s,n=8)Tab 2Effects of tannins from P.granatum on the contents of NO and MDAin gastric mucosa in rats(±s,n=8)
与正常组比较:*P<0.01;与模型组比较:#P<0.05,##P<0.01vs.normal group:*P<0.01;vs.model group:#P<0.05,##P<0.01
NO 含量/μmo l·g-1 1.42±0.230.57±0.15*0.62±0.240.80±0.24#1.24±0.42#1.73±0.14##组别正常组模型组石榴皮鞣质低剂量组石榴皮鞣质中剂量组石榴皮鞣质高剂量组枸橼酸铋钾组M D A 含量/n mo l·mg-1 1.25±0.513.65±0.93*3.11±1.372.26±0.95#1.52±0.56##1.61±0.47##
表3 石榴皮鞣质对模型大鼠胃黏膜nNOS、eNOS表达的影响(±s,n=8)Tab 3 Effects of tannins from P.granatum on nNOS and eNOS expression in gastric mucosa in rats(±s,n=8)

表3 石榴皮鞣质对模型大鼠胃黏膜nNOS、eNOS表达的影响(±s,n=8)Tab 3 Effects of tannins from P.granatum on nNOS and eNOS expression in gastric mucosa in rats(±s,n=8)
与正常组比较:*P<0.05,**P<0.01vs.normal group:*P<0.05,**P<0.01
组别正常组模型组石榴皮鞣质低剂量组石榴皮鞣质中剂量组石榴皮鞣质高剂量组n NO S光密度/μm2 0.79±0.110.45±0.09**0.39±0.040.56±0.050.58±0.05e NO S光密度/μm2 0.59±0.080.37±0.04*0.36±0.050.43±0.070.49±0.03
4 讨论
胃溃疡是一种严重危害人类健康的常见病、多发病,酒精性胃黏膜损伤是常见的发病原因之一。本研究采用ig无水乙醇复制酒精性胃溃疡模型。结果表明,预先给予石榴皮鞣质能显著减轻乙醇引起的胃黏膜损伤,提示石榴皮鞣质是防治酒精性胃黏膜损伤的有效候选药物。
胃肠黏膜在化学物质、缺血或细胞能量不足等情况下可产生大量的氧自由基,氧自由基在整体水平和细胞水平都可以引起胃黏膜或黏膜细胞的脂质过氧化,导致胃黏膜血流障碍,引发胃黏膜损伤[6]。本研究表明,乙醇损伤性胃黏膜组织中MDA含量明显升高,提示脂质过氧化反应参与了大鼠乙醇性胃黏膜损伤的病理、生理过程。预先ig石榴皮鞣质可明显抑制模型大鼠胃黏膜MDA含量升高,提示其减少自由基生成、降低抗脂质过氧化反应可能与其胃黏膜保护作用密切相关。
NO是胃肠道非胆碱能非肾上腺素能神经所释放的一种神经介质和信使分子,由NOS催化生成。正常分泌的NO可能通过增加胃黏膜血流量[7],维持胃黏膜上皮的完整性,参与黏膜损伤后的保护与修复[7,8],抑制炎性细胞的趋化和黏附[9~12]等途径发挥胃黏膜保护作用。国内、外研究报道,NOS的抑制剂NG-硝基-L-精氨酸可加重酒精所致的胃黏膜损伤,提出胃黏膜NO含量的下降与胃溃疡的发生有直接关系[13~16]。本研究表明,乙醇性急性胃黏膜损伤模型大鼠的胃黏膜组织内NO含量明显降低,预先给予石榴皮鞣质能显著阻遏NO水平下降,提示胃黏膜组织内NO含量降低可能参与了模型大鼠乙醇性急性胃黏膜损伤的病理过程,而石榴皮鞣质的抗损伤作用与其阻遏NO水平下降有关。
在此基础上,笔者进一步研究了石榴皮鞣质阻遏NO水平下降的机制。机体内NO含量的高低主要是由NOS调控的。胃黏膜的NOS主要分为两大类,即依赖Ca2+的固有型NOS(cNOS,包括nNOS和eNOS)和不依赖Ca2+的诱导型NOS(iNOS)。cNOS主要分布于神经元和内皮细胞,具有稳定的活性,持续释放少量NO而发挥保护胃黏膜的作用。有报道称,水拘禁应激性胃溃疡的发生与胃黏膜nNOS和eNOS的过度抑制密切相关。本研究表明,与正常大鼠胃黏膜比较,乙醇损伤性胃黏膜组织内nNOS和eNOS的分布无明显差异,但其表达显著降低,提示胃黏膜nNOS和eNOS的变化参与了乙醇性胃黏膜损伤;预先给予石榴皮鞣质有阻遏nNOS和eNOS的表达下降的趋势,但未见显著性差异。
综上所述,本研究证明石榴皮鞣质具有防治乙醇性胃损伤作用,此作用可能与降低抗脂质过氧化反应、阻遏胃黏膜nNOS和eNOS的表达下降,调控NO含量在正常水平有关。
[1] 杨丽平,杨永红.石榴皮的研究进展[J].云南中医中药杂志,2004,25(3):45.
[2] Jurenka JS.Therapeutic applications of pomegranate(Punica granatumL.):A Review[J].Altern Med Rev,2008,13(2):128.
[3] 邱红梅,赖 舒,尚京川,等.石榴皮提取物对大鼠幽门结扎所致胃损伤的保护作用研究[J].中国药房,2011,22(7):594.
[4] Ajaikumar KB,Asheef M.The inhibition of gastric mucosal injury byPunica granatumL.(pomegranate)methanolic extract[J].J Ethnopharmacol,2005,96(1-2):171.
[5] Noda Y,Kaneyuki T,Mori A,et al.Antioxidant activities of pomegranate fruit extract and its anthocyanidins:delphinidin,cyanidin,and pelargonidin[J].J Agric Food Chem,2002,50(1):166.
[6] Mocord JM.Radical explanations for old observations[J].Gastroenterology,1987,92(6):2025.
[7] Sugata H,Ueno T,Shimosegawa T,et al.Direct detection of nitric oxide and its roles in maintaining gastric mucosal integrity following ethanol-induced injury in rats[J].Free Radic Res,2003,37(2):159.
[8] 于 肖,吴大正.吴茱萸水提物对乙醇造成的大鼠胃损伤的保护作用[J].中国中药杂志,2006,31(21):1801.
[9] Tedgui A,Mallat Z.Anti-inflammatory mechanisms in the vascular wall[J].Circulation Research,2001,88(9):877.
[10] Gonzalez W,Fontaine V,Pueyo ME,et al.Molecular plasticity of vascular wall during N(G)-nitro-L-argmine methyl ester-induced hypertension:modulation of proinflammatory signals[J].Hypertension,2000,36(1):103.
[11] Barrachina MD,Panes J,Esplugues JV.Role of nitric oxide in gastrointestinal inflammatory and ulcerative diseases:perspective for drugs development[J].Curr Pharm Des,2001,7(1):3.
[12] Iwata A,Sai S,Nitta Y,et al.Liposome-mediated gene transfection of endothelial nitric oxide synthase reduces endothelial activation and leukocyte infiltration in transplanted hearts[J].Circulation,2001,103(22):2753.
[13] Masuda E,Kawano S,Nagano K,et al.Endogenous nitric oxide modulates ethanol-induced gastric mucosal injury in rats[J].Gastroenterology,1995,108(1):58.
[14] Nishida K,Ohta Y,Ishiguro I.Role of gastric mucosa constitutive and inducible nitric oxide synthases in the development of stress-induced gastric mucosal lesion in rats[J].Biochem Biophys Res Commun,1997,236(2):275.
[15]Rios ER,Rocha NF,Venâncio ET,et al.Mechanisms involved in the gastro-protective activity of esculin on acute gastric lesions in mice[J].Chem Biol Interact,2010,188(1):246.
[16] Wang L,Zhou Y,Peng J,et al.Role of endogenous nitric oxide synthase inhibitor in gastric mucosal injury[J].Can J Physiol Pharmacol,2008,86(3):97.
