nHA/PCL复合材料组分配比对成骨细胞骨相关基因表达的影响研究
2012-08-28唐俊龙王朝元
唐俊龙,王朝元,刘 介
(中南民族大学 生命科学学院,湖北 武汉 430074)
1 引言
骨包括有机相(非胶原蛋白和胶原)和无机相,羟基磷灰石(HA)是骨无机相的主要成分,约占干骨组织的45%。用HA来做骨植入材料不仅生物相容性高、机械性能好、化学性能稳定,还能明显的促进骨的生长,故长期以来作为生物活性材料。但纯HA因脆性大、抗疲劳性强度不高、难以降解[1]等缺点限制了临床应用。聚已内酯(PCL)是线性的脂肪聚酯,具有良好的生物降解性和相容性[2],但其强度低难以满足骨植入材料的要求。因此,我们制成纳米羟基磷灰石/聚已内酯(nHA/PCL)复合材料,它结合了两种材料的优点,具有良好的生物相容性并能促进成骨细胞的增殖[3],有望成为一种具有临床前景的新颖骨替换材料。李家峰,万美蓉[4]等的研究显示人骨髓间质干细胞经nHA/PCL过纳米羟基磷灰石/聚已内酯复合物诱导后其骨相关基因mRNA的表达上调。说明HA的加入可以提高惰性材料的生物活性,nHA/PCL可以预期,纳米羟基磷灰石/聚已内酯复合物具有良好的体内成骨作用。
本文集中探讨不同配比纳米羟基磷灰石/聚已内酯(nHA∶PCL=0∶100、nHA∶PCL1=40∶60、nHA∶PCL2=60∶40)对成骨细胞骨相关基因表达的影响,能从分子水平了解HA在复合材料中的作用和影响成骨细胞的分子机理,为其临床应用提供理论依据。
2 实验部分
2.1 试剂和仪器
nHA/PCL复合材料(华东理工大学生物材料研究所),小鼠成骨细胞株(MC3T3-E1,上海细胞生物研究所),DMEM培养基(Hyclone),新生牛血清(杭州四季清)、青霉素(BIOSHARP)、链霉素(BIOSHARP),反转录试剂盒(Fermentas),胰蛋白酶(Amresco),二甲基亚砜(Amresco),ALP试剂盒(南京建成生物科技公司),Trizol(Invitrogen),PCR 引物(武汉 博越 技术 有限 公司),反转录试剂盒(Fermentas)。CO2培养箱(HF90/240型,利康生物医疗科技控股集团),倒置显微镜(Motic AE21型,重庆光学仪器),普通PCR仪(Biometra,德国),凝胶成像分析仪 (JS-380A,上海培清科技)。
2.2 原代小鼠颅骨成骨细胞(PMO)培养
将新生昆明种小鼠头颅剪碎,0.25%胰酶消化后,加入5mL培养基(含10%新生牛血清、100U/mL青霉素和100μg/mL链霉素),1500r/min离心5min沉淀细胞,弃上清,加培养基,转入培养瓶中于37℃、5%CO2饱和度条件下培养。
2.3 nHA/PCL复合材料的制备
nHA和PCL按0∶100;40∶60;60∶40不同比例混匀,PCL在15MPa压力下3min形成片状。用砂纸打磨材料片表面并漂洗干净,湿热灭菌后备用。
2.4 不同配比nHA/PCL复合物对骨相关基因表达
将细胞以2×105个/cm2浓度接种于培养皿中的nHA/PCL片上,并以同样浓度的细胞接种于普通玻璃培养瓶中作为空白对照。静置2h,让细胞贴壁。每皿加入含10%新生牛血清的DMEM培养基将材料片浸没,置培养皿于37℃、5%CO2培养箱中继续培养,每3~4d换1次培养基,收集培养2、6、12d的细胞。Trizol法提取总RNA,用反转录试剂盒将RNA反转成为cDNA,以cDNA为模板,用骨相关基因引物(表1)进行普通PCR。PCR反应条件:94℃,3min;94℃,30s,60℃,30s,68℃,90s,30个循环;68℃,5min。以 GAPDH 为内参基因,通过2%琼脂糖凝胶电泳来确定骨相关基因的表达差异。用SensiAnsys软件对目标基因与GAPDH灰度比来计算表达量。

表1 骨相关基因PCR扩增的引物序列
3 结果与分析
3.1 不同材料对骨相关基因表达的影响
3.1.1 不同材料对成骨细胞OP基因表达的影响
不同材料片对成骨细胞OP基因mRNA表达的影响见图1。由图1可见,经2、6、12d,nHA/PCL1和nHA/PCL2材料片在PMO细胞的上生长的成骨细胞的OP基因表达量高于对照和PCL材料片上的OP基因表达量或者接近,而PCL材料片上生长的细胞OP基因表达量要低于对照组(图1a)。在 MC3T3-E1细胞的OP基因系中也有相同趋势(图1b)。

图1 nHA/PCL and PCL对PMO和MC3T3-E1细胞OP表达的影响
3.1.2 不同材料对成骨细胞ON基因表达的影响
不同材料片对成骨细胞ON基因表达的影响见图2。由图2可见,nHA/PCL1和nHA/PCL2材料片在PMO细胞ON基因表达量均高于对照和PCL材料片上的ON基因表达量,而PCL材料片上生长的细胞ON基因表达量要低于对照组(图2a)。在MC3T3-E1细胞的ON基因系中也有相同也出现了相似的趋势(图2b)。
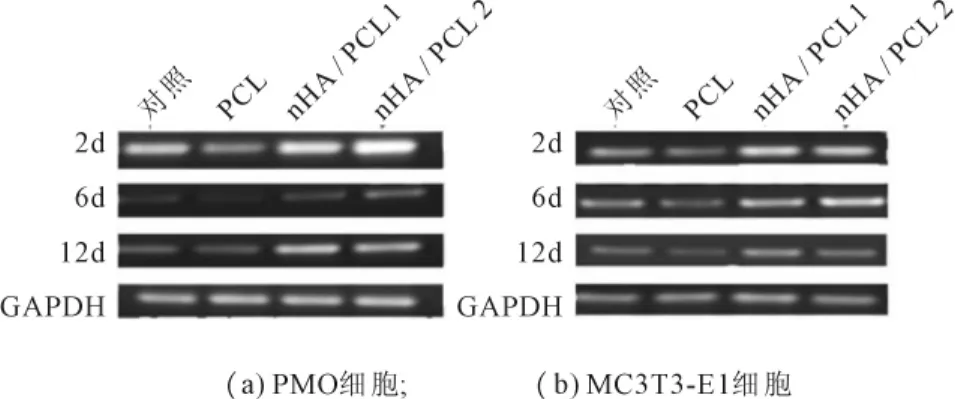
图2 nHA/PCL and PCL对PMO和MC3T3-E1细胞ON表达的影响
3.1.3 不同材料对成骨细胞OC基因表达的影响
不同材料片对成骨细胞OC基因表达的影响见图3。经2、6、12d,OC基因的表达变化不大。2、6、12d,nHA/PCL1和nHA/PCL2材料片上生长的成骨细胞的OC基因表达量高于对照和PCL材料片上的成骨细胞OC基因表达量。PCL材料片上生长的细胞OC基因表达量要低于或近似于对照组。

图3 nHA/PCL and PCL对PMO和MC3T3-E1细胞OC表达的影响
3.1.4 不同材料对成骨细胞ALP基因表达的影响
不同材料对成骨细胞ALP基因表达的影响见图4。由图4可见,经2、6、12d,ALP基因的表达量逐步降低。12d,nHA/PCL1和nHA/PCL2材料片上生长的细胞的ALP基因表达量比对照的ALP基因表达量要低于或近似于对照组。

图4 nHA/PCL and PCL对PMO和MC3T3-E1细胞ALP基因表达的影响
4 结语
本文以成骨细胞样细胞系(MC3T3-E1)和原代小鼠成骨细胞(PMO)这两种成骨细胞作为材料研究的模式细胞,前者具有成骨细胞的基本生物学特性,包括碱性磷酸酶活性、Ⅰ-型胶原合成和基质矿化等;后者则更接近体内细胞活性,以此对比相同材料对不同成骨细胞的影响差异。
成骨细胞在骨形成过程中经历分裂增殖、分化成熟和基质钙化3个阶段[5]。其中碱性磷酸酶(ALP)是一种膜结合蛋白,可水解有机磷酸酯为基质提供足够的磷酸浓度使钙盐沉积于基质上,它在分化早期大量表达,在骨基质成熟过程中起重要作用,是成骨细胞分化的早期标志。骨钙素(OC)是由成骨细胞合成和分泌的一种非胶原蛋白,它是构成成骨细胞胞外基质成分之一,能维持矿化速度,抑制异常羟基磷灰石的形成。骨连蛋白(ON)能促进细胞外基质蛋白之间的相互作用。骨桥蛋白(OPN)广泛分布于多种组织和细胞,是一种非胶原骨基质糖蛋白,介导细胞与细胞、细胞与基质之间的相互作用,同时调节细胞的粘附、迁移、增殖、分化等过程。这些蛋白在成骨细胞分化成熟和基质钙化过程中均有重要作用,其对应的基因统称为骨相关基因。
实验结果表明:nHA/PCL1、nHA/PCL2在一定程度上促进了OC、ON、OPN的表达,而对ALP的表达有较低的抑制作用,在MC3T3-E1和PMO细胞上表现无差别。说明nHA/PCL复合材料具有良好的细胞相容性和促成骨细胞活性,在惰性材料中加入一定比例的HA等材料,可提高材料的生物活性,与前人研究结果[5]一致。以此材料为基础,可进一步优化设计,开发出新型的具有临床应用前景的骨修复材料。
[1]唐文胜,蒋电明.羟基磷灰石及其复合材料在骨修复中的作用及研究进展[J].中华创伤骨科杂志,2003,5(4):370~373.
[2]Causa F,Netti P A,Ambrosio L,et al.Poly-epsiloncaprolactone/hydroxyapatite composites for bone regeneration:in vitro characterization and human osteoblast response[J].J Biomed Mater Res A,2006(76):51~62.
[3]王朝元,李 俊,刘 介.nHA/PCL复合材料对成骨细胞增殖的影响[J].中南民族大学学报:自然科学版,2011,30(2):51~53.
[4]李家锋,万美蓉,管海虹,等.不同配比纳米羟基磷灰石/聚己内酯复合材料细胞相容性的研究[J].中国美容医学,2011,20(2):243~246.
[5]Owen T A,Aronow M,Shalhoub V,et al Progressive development of the rat osteoblast phenotype in vitro:reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extra cellular matrix[J].J Cell Physio,11990,143(3):420.
[6]叶 玲,苏 勤,周学东.纳米羟磷灰石/聚酰胺66对成骨细胞生物学作用的实验研究[J].华西口腔医学杂志,2005,23(2):142~144.
[7]苏佳灿,李 明,禹宝庆,等.纳米羟基磷灰石/聚己内酯复合生物活性多孑L支架研究[J].无机材料学报.2009,24(3):485~490.
[8]陈建海,黄春霞,陈志良.聚已内酯材料的生物相容性于毒理学研究[J].生物医学工程学杂志.2000,17(4):380~382.
[9]Hsw F Y,Chueh S C,Wang Y J.Microshperes of hydroxyapatite/reconstitutend collagc as supports for osteoblast cell growth[J].Biomaterials,1999(20):1931~1936.
[10]Wang X J,Li Y B.Development of biomineticnano-hydroxyapatite/poly(hexamethylethyleneadipamide)composites[J].Biomaterials,2002(23):4787~4791.
[12]Rohner D,Hutmaeher DW,See P,et al.Individually CAD 一CAM technique designedbioresorbable 3-dimensional Polycaprolactone frame work for experimental reconstruction of craniofacial defeets in the pig[J].M KG,2002,6(3):162~167
[13]Jayarama Reddy Venugopal,Sharon Low,Aw Tar Choon.Nanobioengineered Electrospun Composite Nanofibers and Osteoblasts for Bone Regenera[J].Artif Organs,2008,32(5):388~397.
