葡萄溃疡病菌原生质体的制备与再生条件的优化
2012-08-27燕继晔李兴红
张 玮, 燕继晔, 郭 霞, 李兴红
(北京市农林科学院植物保护环境保护研究所,北京 100097)
葡萄溃疡病菌原生质体的制备与再生条件的优化
张 玮, 燕继晔, 郭 霞, 李兴红*
(北京市农林科学院植物保护环境保护研究所,北京 100097)
对葡萄溃疡病菌菌丝摇培时间、酶解时间、渗透压稳定剂种类及再生培养基类型进行了探索和优化,建立了葡萄溃疡病菌稳定、高效的原生质体制备体系。以SR培养基作为再生培养基时,原生质体再生率达到最高,为32.2%。该研究为建立葡萄溃疡病菌高效、稳定的遗传转化体系,开展其致病机理的研究奠定了基础。`
葡萄溃疡病菌; 原生质体; 制备与再生条件
葡萄座腔菌科真菌葡萄溃疡病菌(Botryosphaeriaspp.)可侵染葡萄果实、枝干等部位,其所引起的葡萄溃疡病可造成葡萄果梗干枯、果实干缩或掉粒、枝干溃疡、树势减弱等症状,严重时会导致植株整株死亡。截至目前,已发现葡萄座腔菌科的15种真菌能引起葡萄溃疡病,在美国、墨西哥、法国、意大利、南非、智利等14个国家的葡萄产区均已发生,并造成了不同程度的损失。2009年,李兴红等在我国浙江省首次发现并报道了由病原菌Botryosphaeria dothidea引起的葡萄溃疡病[1],同年,燕继晔和李兴红在湖南、湖北和浙江田间发现并鉴定了引起该病害的另一新种B.rhodina[2]。随后,李兴红课题组又于2010年在山东省和河北省等地分离了葡萄溃疡病的另一种病原菌B.obtusa[3]。目前,该病害严重影响了葡萄的食用价值和经济效益,成为阻碍葡萄产业健康、良性发展的重要威胁之一。
生产上对葡萄溃疡病目前尚无有效的防治方法,对该病原菌的研究主要集中在生物学性状方面,致病机理研究较少,因此,为了有效地防治该病害,需对其进行分子遗传学和分子生物学方面的相关研究,鉴定一系列控制该病原菌致病性或致病力的基因,进一步鉴定、研究基因的功能,从而对该病原菌致病机理有较为深入的了解。建立丝状真菌高效遗传转化体系的方法通常有两种,一种是PEG(polyethylene glycol聚乙二醇)介导的原生质体转化,另外一种是通过农杆菌介导的转化(Agrobacteriumtumefaciens-mediated transformation,ATMT)[4-8]。PEG介导的原生质体转化是最常用的丝状真菌转化方法,其关键技术就是制备大量的、可再生的原生质体[9]。目前,尚无关于葡萄溃疡病菌(Botryosphaeriaspp.)原生质体制备和再生的相关报道。本研究首次优化了葡萄溃疡病菌原生质体制备及再生条件,建立了适宜该病原菌的原生质体制备及再生体系,将为下一步建立该病原菌的高效遗传转化体系奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株
葡萄溃疡病菌[Botryosphaeriarhodina(Berk.et Curt.)Arx]菌株JZB310113由本实验室分离,纯化并单孢分离保存于PDA斜面。
1.1.2 试剂
酸水解干酪素(casein acids hydrolysate)、酶水解干酪素(casein enzymatic hydrolysate)、崩溃酶(driselase)、蜗牛酶(snailase)购自美国Sigma公司;山梨醇(sorbitol)购自美国Amresco公司;酵母提取物(yeast extract)购自英国OXOID公司;琼脂粉购自TaKaRa公司;NaCl、KCl、蔗糖等其他常规生化试剂均购自北京化学试剂公司。
1.1.3 培养基
PDA培养基:马铃薯200g煮沸20~30min后,4层纱布过滤;2%葡萄糖;1.8%琼脂粉;加水定容至1 000mL。CM液体培养基:0.6%酵母粉;0.3%酸水解干酪素;0.3%酶水解干酪素;1%蔗糖。STC:1.2mol/L 山梨醇,10mmol/L Tris-Cl(pH 8.0),50mmol/L CaCl2。SR 固 体 再生 培 养基:0.1%酵母提取物;0.1%酶水解干酪素;1mol/L蔗糖;0.7%琼脂粉。
1.2 试验方法
1.2.1 原生质体的制备
原生质体产量计算方法:以1g菌丝裂解产生的原生质体个数定义为原生质体产量。用3层擦镜纸过滤收集原生质体,4℃2 000g离心15min,弃上清,5mL STC溶液重悬沉淀,4℃2 000g离心15min,弃上清后将沉淀溶于1mL STC溶液中,利用血球计数板计算原生质体产量。
(1)菌丝摇培时间对原生质体产量的影响
将葡萄溃疡病菌JZB310113菌株接种于PDA培养基上,28℃培养36h,在菌落表面滴加2~3mL的无菌水,用涂菌环将菌丝打断,接种到装有150mL液体CM培养基的500mL三角瓶中,28℃120r/min振荡培养20~32h,每隔4h收集菌丝进行酶解,收集原生质体,镜检统计原生质体产量。
(2)酶解时间对原生质体产量的影响
用灭菌的3层擦镜纸过滤收集菌丝,收集到的菌丝用渗透压稳定剂冲洗后转入50mL离心管中,按每克菌丝2mL酶液(崩溃酶和蜗牛酶的浓度均为20mg/mL)的比例加入细胞壁酶溶液,28℃120r/min恒温振荡2~6h,每小时镜检并计算原生质体产量。
(3)渗透压稳定剂种类及浓度对原生质体产量的影响
在相同的酶解时间条件下,分别以0.7mol/L的KCl、NaCl、山梨醇、蔗糖4种溶液作为渗透压稳定剂洗涤酶解产物,计算葡萄溃疡病菌原生质体产量。确定适合的渗透压稳定剂。
1.2.2 原生质体再生
(1)培养基种类对原生质体再生的影响
制备的原生质体用渗透压稳定剂稀释至1×104个/mL,各取0.1mL分别涂布在SR和PDA两种再生培养基平板上,28℃培养1~3d至平板表面长出小菌落为止。同时,取0.1mL原生质体溶液,加入1mL无菌水,室温静置裂解30min后涂布到再生培养基平板作为对照,重复3次。计算原生质体在上述两种培养基上的再生率。
原生质体再生率(%)=
[(原生质体再生的小菌落数量-对照小菌落数量)
/原生质体数量]×100;
(2)酶解时间对原生质体再生的影响
比较在不同酶解时间条件下,原生质体在SR固体再生培养基上的再生率,确定适合葡萄溃疡病菌原生质体再生的最适酶解时间。
2 结果与分析
2.1 原生质体的制备
2.1.1 菌丝摇培时间对原生质体产量的影响
结果表明,摇培时间为24h时,原生质体的产量最大,达到6.217×108个/mL(如图1所示)。摇培24h的JZB310113菌株,生长旺盛,菌丝量比较多,且容易酶解,适合原生质体的大量制备。摇培时间过短,产生的新菌丝量不足;摇培时间过长,菌丝体老化,细胞壁纤维素含量过高,不容易被崩溃酶崩溃,因此原生质体的产量有所下降。
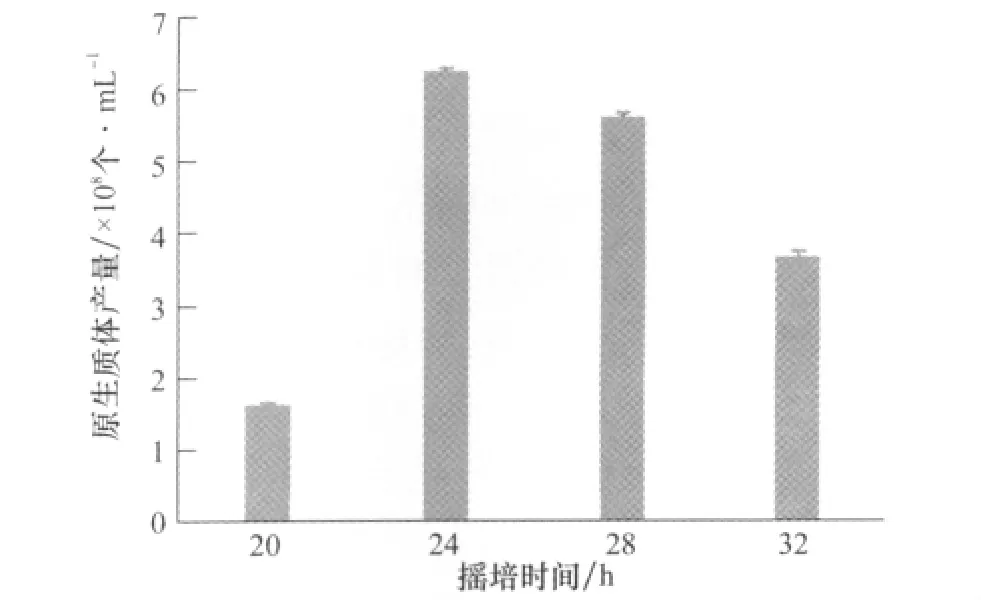
图1 菌丝摇培时间对原生质体产量的影响
2.1.2 酶解时间对原生质体产量的影响
结果如图2,酶解开始后随着时间的积累,原生质体的产量增加,当酶解时间为4h时,原生质体产量达到最大,为5.008×108个/mL,随着酶解时间的继续延长,原生质体的产量有所下降,可能是由于酶解时间过长,细胞壁酶对细胞膜系统的破坏造成的[10-11]。
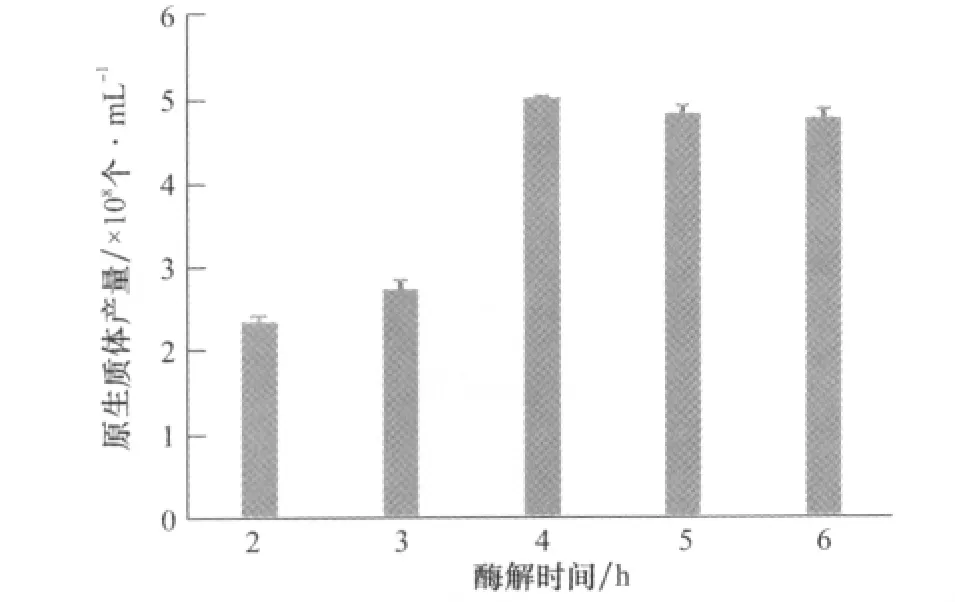
图2 酶解时间对原生质体产量的影响
2.1.3 渗透压稳定剂种类对原生质体产量的影响
渗透压稳定剂是原生质体稳定形成的重要因素之一,能够维持原生质体内外渗透压平衡,防止原生质体破裂,从而影响原生质体产生的数量和质量[12]。本研究选用4种不同的渗透压稳定剂进行原生质体制备试验。结果表明,采用NaCl作为渗透压稳定剂,得到的原生质体量最大,达到8.008×108个/mL(如图3)。
2.1.4 渗透压稳定剂浓度对原生质体产量的影响
渗透压稳定剂的工作浓度是原生质体形成稳定的另一重要因素,影响原生质体产生的数量和质量。试验比较了不同浓度NaCl对原生质体产量的影响。结果如图4,以0.7mol/L NaCl作为渗透压稳定剂,可以获得大量的适于转化的原生质体。这可能是因为0.7mol/L NaCl可以与葡萄溃疡病菌细胞液形成等渗溶液,在内外压力一致的情况下,菌丝保持其生理状态的稳定,原生质体可以顺利而完整地释放出来[13-14]。

图3 渗透压稳定剂对原生质体产量的影响

图4 NaCl浓度对原生质体产量的影响
2.2 原生质体的再生
收集原生质体,用STC洗涤后,显微镜下观察,可以看到呈圆球形的原生质体,大小不一,直径为4.97~19.49μm,平均大小为13.25μm(图5)。

图5 JZB310113原生质体的形态
2.2.1 培养基种类对原生质体再生的影响
葡萄溃疡病菌原生质体在SR和PDA培养基上的再生率分别为32.2%和19.8%,由此可见原生质体在SR培养基上的再生率明显高于在PDA培养基上的再生率,因此SR培养基为该菌适合的再生培养基。
2.2.2 酶解时间对原生质体再生的影响
裂解酶对质膜系统会有一定程度的破坏,因此酶解时间的长短也会严重影响原生质体的再生[13]。研究发现,在酶解时间2~4h时,原生质体在SR上的再生情况基本一致,5h时出现明显下降(图6)。酶解时间为2h或3h时,原生质体产量较4h时低,综合考虑以4h作为JZB310113菌株的最佳酶解时间。

图6 酶解时间对原生质体产量的影响
3 结论
通过对葡萄溃疡病菌菌丝的摇培时间、细胞壁降解酶的工作浓度、酶解时间、渗透压稳定剂种类和浓度及再生培养基等方面的研究,确定了葡萄溃疡病菌原生质体形成及再生的最适宜条件:将PDA平板上培养36h的葡萄溃疡病菌菌丝接种到装有100mL CM液体培养基的500mL三角瓶中,28℃120r/min培养24h,3层滤纸过滤收集菌丝,经0.7mol/L的 NaCl充分渗透后,每克菌丝用2mL崩溃酶和蜗牛酶(浓度均为20mg/mL)的混合液酶解4h,酶解液在4℃条件下2 000r/min离心5min,调节至合适浓度后,涂布在再生培养基SR上。上述研究为葡萄溃疡病菌稳定、高效遗传转化体系的建立及该病菌致病机理的研究奠定了基础。
4 讨论
适用于遗传转化的原生质体的制备,是建立植物病原真菌遗传转化体系的基础。据报道,原生质体的形成与再生受多种因素的影响,包括菌株生长的培养基、菌龄、摇培时间、细胞壁降解酶的种类和浓度、酶解时间、渗透压稳定剂及其浓度,还有菌株本身遗传特性等多种因素的影响[15]。
由于丝状真菌细胞壁的组成成分主要为几丁质,不同微生物细胞壁几丁质含量存在较大的差别,因此酶解不同微生物细胞壁所需要酶的种类也不同。为摸索葡萄溃疡病破壁合适的酶,作者选用了崩溃酶、纤维素酶和蜗牛酶进行酶解效果研究,结果表明,崩溃酶加蜗牛酶的效果最好(数据尚未发表)这可能是因为混合酶相互配合使用增加了脱壁效果[16]。
再生培养基的成分对原生质体的再生影响显著,特别是培养基中的碳源会影响微生物原生质体的再生率。培养基中添加适量的某些营养因子可有效提高再生率,常用的有酵母膏、蛋白质、氨基酸、水解酪蛋白、琥珀酸钠等。这些物质可作为细胞壁合成的前体物质,也可通过生理代谢或转化成细胞壁的前体物质或促进代谢、加速细胞壁合成[17],从而为细胞壁的再生提供材料保障。
[1]Li X H,Yan J Y,Kong F F,et al.Botryosphaeriadothideacausing canker of grapevine newly reported in China[J].Plant Pathology,2010,59(6):1170.
[2]Yan J Y,Li X H.Occurrence of grapevine trunk disease caused byBotryosphaeriarhodinain China[J].Plant Disease,2011,95(2):219.
[3]Yan J Y,Peng Y L,Xie Y,et al.First report of grapevine trunk disease caused byBotryosphaeriaobtusain China[J].Plant Disease,2011,95(5):616.
[4]De Groot M J A,Bundock P,Hooykaas P J J,et al.Agrobacteriumtumefaciens-mediated transformation of filamentous fungi[J].Nature Biotechnology,1998,16:839-842.
[5]Ruiz-Díez B.Strategies for the transformation of filamentous fungi[J].Journal of Applied Microbiology,2002,92(2):189-195.
[6]刘限,郭培磊,高增贵,等.木霉菌REMI转化体对番茄灰霉病的防治及其机理的研究[J].植物保护,2008,34(5):80-85.
[7]李伶俐,严红,李兴红,等.甘蓝枯萎病菌原生质体的制备与再生条件的优化[J].中国农学通报,2011,27(10):203-207.
[8]莫静燕,陈献忠,王正祥.地衣芽孢杆菌原生质体的制备、再生及转化研究[J].生物技术,2009,19(5):75-77.
[9]Riach M B R,Kinghorn J R.Genetic transformation and vector developments in filamentous fungi[M]∥Fungal Genetics:principles and practice(C.J.Bos,ed.)Marcel Dekker,New York,1996:209-233.
[10]Keller W A,Melchers G.The effect of high pH and calcium on tobacco leaf protoplast fusion[J].Zeitschrift für Naturforschung C,1973,28:737-741.
[11]Kwon Y C,Suh H S,Chung G S.Protoplast culture and fusion in cruciferae.3;Plant regeneration from protoplast fusion betweenBrassicanapusandBrassicacampestris[J].Research Reports of the Rural Development Administration Biotechnolo-gy,1989,31(4):6-10.
[12]张志光,李东屏,邹寿长,等.丝状真菌原生质体技术的研究(Ⅷ)——渗透压稳定剂对原生质体的影响[J].湖南师范大学自然科学学报,1998,21(2):67-71.
[13]祝子坪,李娜,贺建东.渗透压稳定剂对桑黄菌原生质体分离与再生的影响[J].食用菌,2009,31(5):25-26.
[14]孙剑秋,周东坡.微生物原生质体技术[J].微生物学通报,2002,37(7):9-11.
[15]陈宏伟,陈安徽,王陶蛹,等.蛹虫草无性型原生质体制备条件的研究[J].徐州工程学院学报,2008,23(4):22-26.
[16]杨迎青,李明海,杨媚,等.水稻纹枯病菌原生质体制备与再生条件的优化[J].华中农业大学学报,2010,29(5):546-551.
[17]梁平彦.产黄青霉(Penicilliumchrysogenum)两株营养缺陷型原生质体的形成和再生因素的研究[J].植物生理学报,1981,7(1):1-9.
Development of a method for protoplast preparation and regeneration ofBotryosphaeriarhodina
Zhang Wei, Yan Jiye, Guo Xia, Li Xinghong
(InstituteofPlantandEnvironmentProtection,BeijingAcademyofAgricultureand ForestrySciences,Beijing100097,China)
The culture time of mycelium,the enzymolysis time,the type of osmotic stabilizer and the regeneration medium were optimized in this study.An efficient method for protoplast preparation and regeneration ofBotryosphaeriarhodinawas obtained.While SR medium was chosen as the regeneration medium,the regeneration rate of protoplast reached the highest,up to the maximum of 32.2%.This study provided powerful support for genetic transformation and transformant pathogenicity analysis inBotryosphaeriaspp.
Botryosphaeriaspp.; protoplast; preparation and regeneration
S 436.631;Q 813.11
A
10.3969/j.issn.0529-1542.2012.05.005
2011-12-26
2012-02-18
国家葡萄产业技术体系(CARS-30)
* 通信作者010-51503434;E-mail:lxh1962@yahoo.com.cn
