淮阴苜蓿SSR指纹图谱的构建
2012-08-20魏臻武武自念屠德鹏李伟民
张 栋,魏臻武,武自念,屠德鹏,李伟民
(1.扬州大学动物科学与技术学院,扬州大学草业科学研究所,江苏 扬州225009;2.农业部全国草业产品质量监督检验测试中心,北京100125)
淮阴苜蓿(Medicago sativa Huaiyin)是我国江淮地区已登记的地方品种,迄今已有200多年栽培历史,经过多年栽培驯化已形成一个能适应江淮流域的地方苜蓿品种[1]。淮阴苜蓿因其生长发育快、再生性好、干物质产量高、越夏率高而成为江淮流域优良苜蓿地方品种。近年来,随着江淮地区畜牧业的快速发展,苜蓿需求量增大,但适应江淮地区的苜蓿资源有限,难以满足需求。
分子标记技术的发展带动了DNA指纹图谱技术的快速发展,使其在农作物品种鉴定、种子纯度检测和品种亲缘关系等方面得到大量应用。SSR标记作为第二代分子标记相对于其他分子标记具有检测快捷、简便、稳定的特点,并且覆盖整个基因组,呈现多基因、共显性遗传[2-5],已被广泛用于玉米(Zea mays)[6]、大豆(Glycine max)[7]、水稻(Oryza sativa)[8]、小麦(Triticum aestivum)[9]等作物的指纹图谱的构建及遗传多样性分析。SSR标记在苜蓿遗传多样性分析、遗传结构分析、指纹图谱的构建等研究中也得到了广泛应用[10-12]。群体的取样策略是影响遗传多样性分析与构建SSR指纹图谱的关键因素,杨晓莉等[13]采用单株取样(每品种10个单株)策略,发现利用随机扩增多态性DNA标记(Random Amplifield Polymorphic DNA,RAPD)分子标记难以区分甘肃苜蓿品种(群)。鉴于此,进一步研究确定苜蓿遗传多样性分析的取样数量,对利用分子标记进行苜蓿遗传多样性分析、品种鉴定及指纹图谱的构建等具有理论价值和实际指导意义。
本研究采用不同的取样策略,利用SSR分子标记研究淮阴苜蓿遗传多样性,确定最佳取样数,在此基础上利用筛选的SSR引物构建淮阴苜蓿的指纹图谱,并采用15份供试紫花苜蓿材料进行检测,以实现对淮阴苜蓿品种的鉴定,为后续开发利用淮阴苜蓿提供重要的理论基础。
1 材料与方法
1.1 试验材料 试验材料为地方紫花苜蓿品种——淮阴苜蓿及国内外育成的紫花苜蓿品种(表1)。
试验材料淮阴苜蓿种子由全国畜牧总站种质资源中期库提供,共计384粒种子。于2010年10月用育苗盘进行育苗,7d后移栽至扬州大学草业科学试验基地;其余15份材料采用3行条播,行距0.7m。
1.2 试验方法
1.2.1 DNA的提取 采用改良CTAB法[14]对320株淮阴苜蓿单株基因组DNA进行提取,对于其余15份供试苜蓿材料,每份材料每株采取1~2片鲜叶,共随机采取60株的叶片混合,采用同样的方法提取基因组DNA,用0.8%琼脂糖凝胶和紫外分光光度计分别对其质量和浓度进行检测,提取的DNA溶解于100μL TE后放入4℃冰箱备用。

表1 试验苜蓿品种及来源Table 1 Alfalfa varieties list and source in this study
1.2.2 DNA混合样的制备 DNA混合样设置A、B、C、D、E、F 6个处理,每个处理设置8个重复,6个处理分别为10、20、30、40、50、60株淮阴苜蓿单株DNA随机等量混合。
1.2.3 SSR扩增反应体系与凝胶电泳及银染 反应体系为10μL(每孔添加量):PCR体系含0.24μL dNTP(10μmol·L-1),3μL Primer(10μmol·μL-1),0.16μL Tap polymerase(1U),1.5μL 10×buffer(1 μmol·L-1),3μL DNA模板(20~90ng·μL-1),0.9 μL Mg2+(20mmol·L-1),1.2μL ddH2O。
PCR扩增程序:94℃预变性3min,95℃变性1min,55℃退火1.5min,72℃延伸1min,共循环35次,最后72℃保温8min,4℃保存。
PCR扩增产物中加入1μL溴酚蓝缓冲液(Loading buffer),扩增产物用8%聚丙烯酰胺凝胶(PAGE)检测,恒压180V,电泳1.5h,银染观察并照相保存。
1.2.4 引物来源 选用130对蒺藜苜蓿(M.truncatula)SSR 引 物[14-15],由 上 海 生 物 工 程 有 限 公 司 合成。
1.2.5 谱带记录及数据分析 SSR扩增谱带采用Quantity one统计软件进行统计,引物扩增片段按分子量大小排列,记录易于辨认的多态性位点,有带记为1,无带记为0,建立0、1统计表。

式中,i为基因型,Pi为某一基因型在群体中出现的频率。
用SPSS 19.0对不同处理的Stoddart指数和Simpson指数进行SNK显著性检验,用于分析不同处理的遗传差异并进行比较。
2 结果与分析
2.1 SSR引物的筛选 选用平均分布在蒺藜苜蓿8条染色体上的130对SSR引物,对淮阴苜蓿及其余15份苜蓿材料进行多态性分析,选取扩增条带好、条带差异明显、重复性好、信号强、背景清晰的7对引物(表2),这7对引物分别分布于蒺藜苜蓿4号连锁群、1号连锁群、3号连锁群、2号连锁群、8号连锁群、7号连锁群和5号连锁群。在淮阴苜蓿及其余15份苜蓿材料共检测出41个多态性条带,每对引物检测到4~9个数目不等的多态性条带,平均为5.86个,片段大小为80~560bp。
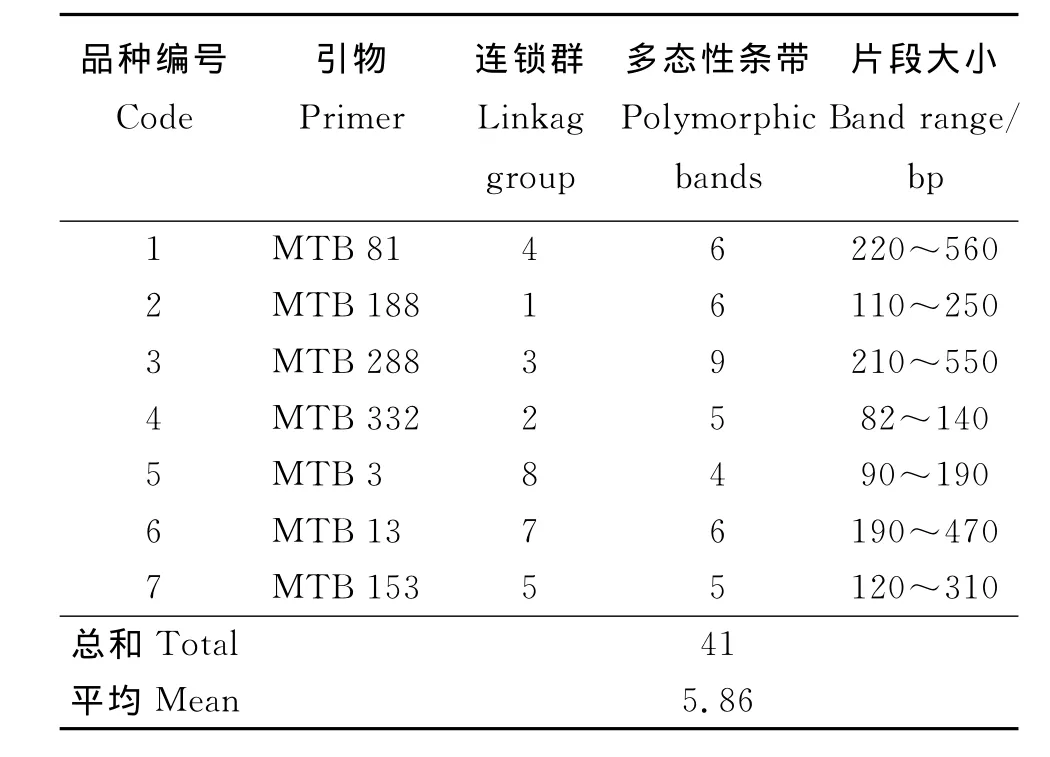
表2 苜蓿DNA中SSR检测的等位基因Table 2 Alleles of alfalfa DNA decteted by SSR
2.2 取样策略分析 选用筛选的前4对SSR引物对淮阴苜蓿DNA混合样的6个处理进行扩增、电泳(图1,图2),根据SSR标记数据计算各个处理遗传参数Stoddart指数和Simpson指数。处理A、B、C、D、E、F的Stoddart指数分别为22.36、13.49、7.78、5.28、4.42、4.00;Simpson指数分别为0.95、0.92、0.86、0.77、0.75、0.73。Stoddart指数:其中B与C之间差异不显著;C、D、E、F之间差异不显著(P>0.05);A与B、C、D、E、F之间差异显著(P<0.05);B与D、E、F之间差异显著。Simpson指数:其中A、B之间无显著差异;D、E、F之间无显著差异;A、B与D、E、F之间差异显著;C与 A、B、D、E、F之间差异显著(表3)。随着淮阴苜蓿取样数的增大,遗传多样性指数变化幅度逐渐减小,说明取样数越大越能代表淮阴苜蓿群体,取样数为40、50、60时,Stoddart指数、Simpson指数差异都不显著,但从实验工作量方面考虑,40株是最佳取样策略。
2.3 淮阴苜蓿的鉴定及SSR指纹图谱的构建
试验选用 MTB 3、MTB 13和 MTB 153三个筛选出的多态性好的引物用于淮阴苜蓿的鉴定及SSR指纹图谱的构建。引物 MTB 3、MTB 13和MTB 153检测出清晰的条带和多态性带数分别为6和3个、5和3个、6和3个,结果表明,单一的引物均不能区分淮阴苜蓿与其余15份苜蓿品种。为了提高鉴别能力,先用引物 MTB 3、MTB 13和 MTB 153分别对淮阴苜蓿及15份供试材料进行扩增,再将每种材料的3种扩增产物分别等量混合[18],然后对淮阴苜蓿品种进行鉴定,发现可以明确地对淮阴苜蓿进行区分(图3)。因此,这3对SSR引物可以应用于淮阴苜蓿的鉴定。

图1 引物MTB 81在淮阴苜蓿10~30株单株DNA混合体系的电泳图Fig.1 Electrophoretogram of 10-30individual plant DNA mixture system by primer MTB81
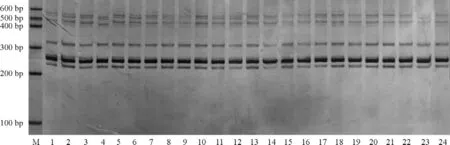
图2 引物MTB 81在淮阴苜蓿40~60株单株DNA混合体系电泳图Fig.2 Electrophoretogram of 40-60individual plant DNA mixture by primer MTB81

表3 不同处理群遗传多样性指数Table 3 Genetic diversity index of different treatments
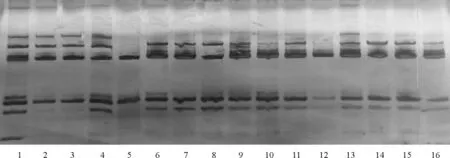
图3 淮阴苜蓿鉴定电泳图Fig.1 Indentification electrophoretogram of Huaiyin alfalfa
3 讨论
3.1 淮阴苜蓿取样策略分析 样本大小的确定可以为苜蓿群体分化和遗传多样性分析提供更加可靠的 数 据 信 息。Herrmann 等[19]、Sardaro等[20]和Kolliker等[21]分别在红三叶(Trifolium pratense)、百脉根(Lotus cornioulatus)与黑麦草(Lolium perenne)的遗传多样性研究中发现40、10和30株是合理的取样策略。在苜蓿上,Jenczewski等[22]利用RAPD标记分析不同紫花苜蓿品种的遗传分化采用样本大小为20株。班霆等[23]发现,取样策略为20株与40和60株的DNA混合样聚类分析结果不一样。以上研究表明,取样策略的不同会导致物种遗传多样性的显著差异,取样量过小难以保证研究结果的可靠性,取样量过大又会造成大量的人力资源浪费。因此,在研究不同物种的遗传多样性前,应首先进行取样策略的研究。Labombarda等[24]与Doris等[25]在研究紫花苜蓿的遗传多样性时认为,40株是一个最佳取样策略,但他们仅分析了10、20、40和60取样数之间的差异。为进一步确定最佳的取样策略,本研究深入分析了30、40和50株之间的差异,结果表明,30株不能代表整个群体,也得出40株是最佳的取样策略;造成遗传多样性分析过程中取样策略的差异可能是由紫花苜蓿的异花授粉和四倍体特性所引起的,取样量太小对苜蓿群体而言不具有代表性,随着取样量的增加,对苜蓿种质的遗传多样性的分析更加准确。
3.2 SSR指纹图谱的构建 SSR分子标记技术是从DNA分子水平检测基因组的遗传位点,基因组DNA序列不同,就能产生不同的指纹图谱。在粳稻的研究中发现利用15个多态性SSR就可以区分59个日本粳稻育成品种[26]。在大麦(Hordeum sativum)中利用4对SSR引物组成的3个不同组合可区分24个大麦品种,错误率为千分之一[27]。同时SSR标记技术也被广泛用于苜蓿的遗传多样性分析[28]和指纹图谱的构建[12]。本研究利用SSR标记技术对构建淮阴苜蓿品种指纹图谱进行了探讨,发现利用单一的引物不能很好地把淮阴苜蓿与其他苜蓿材料区分开,这与魏臻武[12]利用SSR、ISSR和RAPD技术构建苜蓿基因组DNA指纹图谱的试验结果一致。本试验从130对引物中筛选扩增带型稳定、多态性强、重复好的3对引物,根据概率论的数理统计原理[29],计算出在9个位点上出现完全相同的概率为1.95×10-3。因此,在全国苜蓿品种中出现完全相同的指纹图谱概率很低,但是为了鉴定淮阴苜蓿指纹图的可靠性,本试验对淮阴苜蓿及其余15份苜蓿均进行了鉴定。同时,为了提高鉴别能力,将3对引物扩增的产物混合在一起进行品种鉴定,结果证明了淮阴苜蓿指纹图谱的可靠性。但是,构建淮阴苜蓿指纹图谱所使用的3对SSR引物的多态性条带都只有3个,因此,在实际应用中如果发现和淮阴苜蓿相同的指纹图谱,应该进一步筛选新的SSR引物补充该研究构建的淮阴苜蓿指纹图谱。
4 结论
1)对130对蒺藜苜蓿SSR引物在淮阴苜蓿及其余15份苜蓿材料进行扩增筛选,共得到7对扩增条带好、条带差异明显、重复性好、信号强、背景清晰的SSR引物,用于淮阴苜蓿取样策略的分析及构建淮阴苜蓿SSR指纹图谱。
2)用筛选的4对SSR引物对淮阴苜蓿的6个DNA混合样的处理进行扩增,结果表明,40株DNA混合样在进行淮阴苜蓿遗传多样性分析时是最佳的取样量。
3)选用 MTB 3、MTB 13和 MTB 153这3对SSR引物所构建的淮阴苜蓿指纹图谱,可以应用于对淮阴苜蓿品种的鉴定。
[1] 姚爱兴,梁祖铎,王槐三.淮阴苜蓿主要种质特性研究[J].草业科学,1990,7(6):25-29.
[2] Akkaya M S,Bhagwat A A,et al.Cregan P B.Length polymorphisms of simple sequence repeat DNA in soybean[J].Genetics,1992,132:1131-1139.
[3] Brouwer M S,Plaschke J,Konig S,et al.Abundance variability and chromosomal location of microsatellites in wheat[J].Molecular Genome Genetics,1995,246:327-333.
[4] Gustavo.DNA Markers[M].New York:Wiley-vch Press,1998.
[5] 贾继增.分子标记种质资源鉴定和分子标记育种[J].中国农业科学,1996,29(4):1-10.
[6] 盖树鹏,王日新,黄进勇,等.山东省玉米骨干自交系和杂交种的SSR指纹图谱构建[J].中国农学通报,2011(24):40-44.
[7] 高运来,朱荣胜,刘春燕,等.黑龙江部分大豆品种分子ID的构建[J].作物学报,2009,35(2):211-218.
[8] 程保山,万志兵,洪德林,等.35个粳稻品种SSR指纹图谱的构建及遗传相似性分析[J].南京农业大学学报,2007,30(3):1-8.
[9] 李根英,夏先春,何中虎,等.小麦指纹图谱数据库的建立及SSR分子标记试剂盒的研发[J].作物学报,2006,32(12):1771-1778.
[10] Sandrine F,Joelle R,Pierre B,et al.Genetic diversity among alfalfa (Medicago sativa)cultivars coming from a breeding program,using SSR markers[J].Theoretical and Applied Genetics,2005,111:1420-1429.
[11] Falahti-anbaran M,Habashi A A,Esfahany M,et al.Population genetic structure based on SSR markers in alfalfa (Medicago sativa L.)from various regions contiguous to the centres of origin of the species[J].Genetics,2007,86(1):59-63.
[12] 魏臻武.利用SSR、ISSR和RAPD技术构建苜蓿基因组DNA指纹图谱[J].草业学报,2004,13(3):62-67.
[13] 杨晓莉,陈丽,班霆,等.甘肃省苜蓿种质资源遗传多样性 RAPD 分 析 [J].草 地 学 报,2008,16(2):129-134.
[14] 屠德鹏,魏臻武,武自念,等.蒺藜苜蓿EST-SSRs分布特征及标记的开发[J].草业科学,2011,28(5):746-752.
[15] Jeong-Hwan M,Dong-Jin K,Hong-Kyu C,et al.Distribution of microsatellites in the genome of Medicago truncatula:A resource of genetic markers that integrate genetic and physical maps[J].Genetics,2006,172:2541-2555.
[16] 张丽芳,魏臻武,杨占花,等.蒺藜苜蓿SSR反应体系优化及在一年生苜蓿种质鉴定中的应用[J].草地学报,2007,15(5):429-436.
[17] 杨占花,魏臻武,雷艳芳,等.两类SSR对苜蓿属种质遗传多样性和亲缘关系的比较研究[J].草地学报,2008(6):559-565.
[18] 全志武,汪静,潘磊,等.10个藕莲品种SSR指纹图谱的构建与品种鉴别[J].中国蔬菜,2008(3):15-17.
[19] Herrmann D,Boller B,Widmer F,et al.Optimization of bulked AFLP analysis and its application for exploring diversity of natural and cultivated populations of red clover[J].Genome,2005,48:474-486.
[20] Sardaro M L S,Atallah M,Tavakol E,et al.Diversity for AFLP and SSR in natural populations of Lotus corniculatus L.from Italy[J].Crop Science,2008,48:1080-1089.
[21] Kolliker R,Stadelmann F J,Reidy B,et al.Genetic variability of forage grass cultivars:A comparison of Festuca pratensis Huds,Lolium perenne L,and Dactylis glomerata L.[J].Euphytica,1999,106:261-270.
[22] Jenczewski E,Prosperi J M,Ronfort J.Differentiation between natural and cultivated populations of Medicago sativa (Leguminosae)from Spain:Analysis with random amplified polymorphic DNA (RAPD)markers and comparison to allozymes[J].Molecular Ecology,1999,8:1317-1330.
[23] 班霆,韩鹏,刘翔,等.苜蓿遗传多样性的取样数目——RAPD和SSR群体标记法[J].生命科学研究,2009,13(2):158-162.
[24] Labombarda P,Pupilli F,Arcioni S,et al.Optimal population size for RFLP-assisted cultivar identification in alfalfa(Medicago sativa L.)[J].Agronomie,2000,20:233-240.
[25] Doris H,Sandrine F,Bernadtte J,et al.Sample size for diversity studies in tetraploid alfalfa (Medicago sativa L.)based on codominantly coded SSR markers[J].Euphytica,2010,171;441-446.
[26] Russell J R,Fuller J D,Macaulay M,et al.Direct comparison of levels of genetic variation among barley accessions detected by RFLPs,AFLPs,SSRs and RAPDs[J].Theoretical and Applied Genetics,1997,95:714-722.
[27] Russell J R,Fuller J D,Young G,et al.Discrimination between barley genotypes using microsatellite markers[J].Genome,1997,40:442-450.
[28] Flajoulot S,Ronfort J,Baudouin P,et al.Genetic diversity among alfalfa(Medicago sativa L.)cultivars coming from a breeding program,using SSR markers[J].Theoretical and Applied Genetics,2005,111:1420-1429.
[29] 吴渝生,杨文鹏,郑用琏,等.3个玉米杂交种和亲SSR指纹图谱的构建[J].作物学报,2003,29(4):496-500.
