热习服对高温力竭运动大鼠体液调节激素及下丘脑抗利尿激素合成的影响
2012-08-20董柔封文平曾凡星陈宜威
董柔 封文平 曾凡星 陈宜威
1西南林业大学体育部(云南昆明650224)2北京体育大学 3国家体育总局体育科学研究所
运动对体内水分、电解质及其调节激素(主要有醛固酮、心钠素、抗利尿激素)产生重要的影响。运动过程中伴随大量的水分和电解质的丢失,血浆激素水平发生改变[1,2]。 在高温环境下运动,由于高温和运动双重因素的影响,机体上述变化更明显。热习服是提高机体在高温环境下运动能力的有效手段。热习服后,机体排汗能力增强,汗液中的电解质浓度更低,身体核心温度升高更慢,但关于体液调节激素变化的报道较少。洪长青等[3]指出单纯运动应激与单纯热应激不能获得运动热应激的适应,只有运动应激与热应激的联合刺激才可以获得有效的运动热应激适应。所以本实验以运动热应激作为热习服的手段,经过热习服后再进行高温力竭运动,探讨力竭运动后大鼠血清体液调节激素的变化以及对下丘脑AVP合成的影响。
1 材料和方法
1.1 实验动物和分组
SPF级成年雄性Wistar大鼠28只,购于北京维通利华实验动物有限公司,生产许可证号:SCXK(京)2006-0009,体重 180~200 g。室温 25℃,湿度50%,自由饮水进食。所有动物适应性饲养2天后,进行坡度0、速度16m/min、时间30min的适应性跑台训练2次,淘汰不运动的大鼠。剩余24只大鼠随机分为空白对照组(A组)、高温力竭组(B组)、热习服后高温力竭组(C组),每组8只。动物使用许可证号:SYXK(京 2006-0017)。
1.2 实验方案
实验在国家体育总局体育科学研究所综合环境运动实验室进行,设备为天津市森罗科技发展有限公司的CTDY-200型高温高湿低氧训练系统。空白对照组无任何处理,第15天直接处死取材。高温力竭组在温度38℃、湿度50%环境下,以速度20 m/min、坡度0进行运动到力竭。热习服后高温力竭组连续在温度38℃、湿度50%环境下以速度18 m/min、坡度0训练14天,第15天同高温力竭组作相同处理。动物力竭判断标准:连续施加机械刺激后大鼠不能继续跑动,下跑台后腹部触地并呈严重的“甲鱼状”。
每日记录大鼠肛温和体重。通过测试热习服后高温力竭组大鼠训练后肛温判断大鼠是否热习服,根据预试验,发现在训练第14天,训练后大鼠肛温与训练前无差异,说明已习服。
1.3 取材
以3%戊巴比妥钠按0.1ml/100g体重的剂量进行腹腔注射麻醉,腹主动脉取血,其中1 ml注入有肝素的抗凝管,静置1~2小时后,常温下3000转/分离心15分钟分离血浆,随即测试血浆渗透压;剩余血液注入玻璃试管,静置1~2小时后,常温下3000转/分离心15分钟分离血清,-80℃冰箱保存待测。取血后迅速断头,取下丘脑,用铝箔纸包好、标记后放入液氮急冻暂存,随后放置于-80℃低温冰箱保存待测。
1.4 实验仪器和试剂
MULTISKAN MK3全自动多功能酶标仪:美国Thermo公司;Wellwash 4 Mk 2半自动洗板机:美国Thermo公司;Model2020型渗透压仪:美国Advanced公司;Line-gene荧光定量PCR检测系统:杭州博日科技有限公司;DYY-7C型电泳仪:北京六一仪器厂;DYCP-31D型水平式电泳槽:北京宾达英创科技有限公司;DSI-905钠钾氯钙pH分析仪:中国上海。其他仪器如磁力搅拌器、恒温振荡器、分光光度计、培养箱等均为国产。
Tris、APS、SDS、TEMED、Tween-20、 丙烯酰胺、甘氨酸、甲叉双丙烯酰胺、丽春红等购自Sigma公司,AVP抗体购自Cell Signaling公司,内参、二抗购自Santa Cruz公司,其余常规化学试剂均为国产。
1.5 测试指标与方法
测试各组大鼠实验前体重和B组、C组力竭后即刻体重。将数字体温计插入大鼠肛门6.5 cm测得核心温度[4]。用冰点渗透压计测试含有离子血浆的冰点并折算为渗透压。通过测定血清Na+、K+离子电极电位值,计算血清Na+、K+离子浓度。取-80℃冰箱保存待测血清,融化后放置至室温,采用酶联免疫法检测血清抗利尿激素(ADH)、心钠素(ANP)、醛固酮(ALD)浓度,严格按照Elisa试剂盒(购于RB公司)说明操作。
采用荧光定量PCR法测定大鼠下丘脑ADH mRNA表达:采用Primer premier 5及oligo 6生物软件合成ADH基因及β-actin基因引物,其中β-actin为内参。ADH扩增片段长度 154 bp,上游:5’-AGCCCGAGTGTCGAGAGGT -3’, 下 游 :5’ -TAGACCCGGGGCTTGGCAGA-3’;β-actin 扩增片段 长 度 383 bp, 上 游 :5’-CACTATTGGCAACGAGCGGTTC-3’, 下游:5’-ACTTGCGGTGCACGATGGAG-3。北京尚柏抽提试剂盒获取下丘脑总RNA,逆转录获取cDNA后行PCR扩增。PCR反应条件:95℃预变性 2min,95℃变性 20 s,58℃退火 25 s,72℃延伸 30 s,45个循环,最后 95℃延伸 20 s,反应完毕后,行琼脂糖凝胶电泳,采用凝胶图像分析系统对电泳条带进行密度扫描。
1.6统计学分析
采用SPSS16.0软件处理实验结果,结果以均数±标准差()表示。组间比较采用单因素方差分析(One-Way ANOVA),先检验数据方差是否齐性,若方差齐性,则采用LSD检验方法;若方差不齐,则采用Tamhane’s T2检验方法。实验前后肛温和体重对比采用配对样本t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 力竭运动时间
热习服后高温力竭组大鼠力竭运动时间(75.20±15.39min)显著长于高温力竭组大鼠(27.67±4.80min),P<0.01。
2.2 体重(表1)
高温力竭组和热习服后高温力竭组大鼠体重较实验前均显著降低(P<0.01),热习服后高温力竭组大鼠体重丢失百分比显著高于高温力竭组 (P<0.01)。
2.3 肛温(表2)
高温力竭组和热习服后高温力竭组大鼠实验后肛温显著高于实验前(P<0.01)。
2.4 血浆渗透压和血清激素(表3)
高温力竭组大鼠血浆渗透压与空白对照组相比差异有统计学意义(P<0.05),热习服后高温力竭组大鼠血浆渗透压显著高于空白对照组和高温力竭组(P<0.01)。高温力竭组和热习服后高温力竭组ADH浓度显著高于空白对照组(P<0.05),同时热习服后高温力竭组显著低于高温力竭组(P<0.05)。高温力竭组和热习服后高温力竭组ALD浓度显著高于空白对照组(P<0.01)。高温力竭组和热习服后高温力竭组ANP浓度显著低于空白对照组(P<0.05)。

表3 各组大鼠血浆渗透压(Posm)及血清激素浓度比较
2.5 Na+、K+浓度(表4)
高温力竭组大鼠Na+浓度高于空白对照组 (P<0.05),热习服后高温力竭组显著高于空白对照组和高温力竭组(P<0.01)。高温力竭组和热习服后高温力竭组大鼠Na+/K+与空白对照组相比差异有统计学意义(P<0.05)。
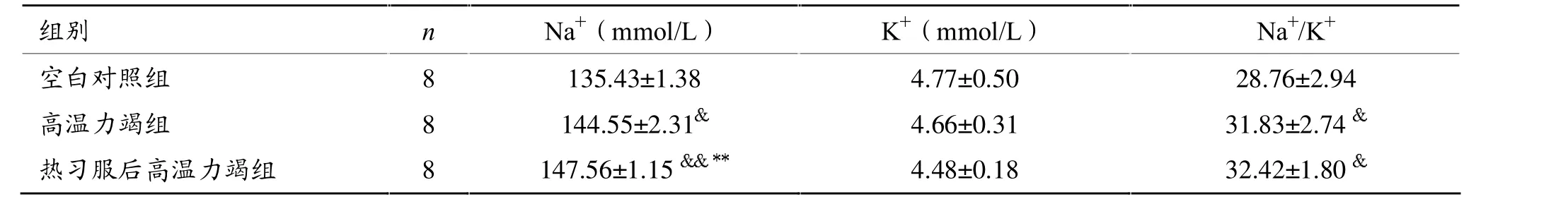
表4 各组大鼠血清Na+、K+浓度比较
2.6 下丘脑ADH mRNA表达(表5)
高温力竭组大鼠下丘脑ADH mRNA表达显著高于空白对照组(P<0.01),热习服后高温力竭组大鼠下丘脑ADH mRNA表达与空白对照组相比差异有统计学意义(P<0.05)。

表5 各组大鼠下丘脑ADH m RNA表达比较
3 讨论
有报道指出,大鼠经过高温预处理24 h之后运动,耐力与对照组相比明显提高,运动时间显著延长,提示大鼠运动能力得到提高[5]。本实验结果中,热习服之后再进行高温力竭运动,大鼠运动时间明显延长,表明热习服能提高大鼠在热环境下的耐疲劳能力。
机体运动时肌肉产热增加,高温环境下运动,高温和运动两种效应叠加使核心温度显著上升[6]。多项研究[7,8]表明,体温持续升高与高温环境下运动能力下降相关。Hasegawa等[9]研究发现,运动时水分丢失是影响体温升高的重要诱因之一。其他研究[10]表明,当运动员丢失相当于其体重1%的体液时,其正常生理功能就会改变。本实验结果中,B组和C组大鼠进行高温力竭运动后,体温均升高且达到极限,说明体温升高是限制其继续运动的重要因素。C组大鼠体重丢失明显高于B组,C组大鼠经过热习服,机体能更好散热,在散热的同时,体液大量丢失;同时C组大鼠运动时间明显延长,运动中大量汗液丢失,上述两个因素导致C组大鼠体液大量丢失。
ADH是体内调节水平衡的一个重要激素,具有促进水重吸收的作用。运动中ADH的分泌主要受血浆渗透压、循环血量变化和动脉血压变化的调节[11-13]。运动中,机体大量出汗、脱水,血浆渗透压增高,刺激下丘脑的渗透压感受器,引起ADH分泌增加,血浆ADH水平升高与血浆渗透压浓度升高成正比。高温力竭运动后,B组和C组大鼠水分大量丢失,血浆渗透压增高,导致两组大鼠血清ADH浓度升高。虽然C组大鼠经过热习服,在高温环境下运动时间较长,体重丢失比B组大鼠更明显,血浆渗透压升高也更明显,但C组大鼠血浆ADH浓度低于B组。可能是热习服后机体产生适应,不需要产生更多的ADH进行调节,下丘脑渗透压感受器的“调定点”发生改变。
运动可导致血浆 ALD 显著增加[14,15]。 中等强度长时间运动时,醛固酮的增加幅度较短时间大强度运动时大,说明醛固酮受运动时间影响较大,醛固酮的这种变化与血浆 ANP 相反[16,17]。 钱令嘉等[18]观测了不同热应激和热习服水平的正常大鼠血浆ALD和体液Na+、K+浓度的变化,认为血浆ALD在热环境中调控肾脏对 Na+、K+的排泌,ALD 分泌也受 Na+、K+浓度的影响。本研究结果显示,B组和C组大鼠血清Na+/K+均升高,但两组之间无显著性差异,同时两组血清ALD浓度升高,两组之间也无显著性差异,说明,高温环境下运动,ALD分泌增加,肾脏重吸收Na+增加,进而引起水重吸收增加,维持水平衡。其他研究[19,20]也得出了相似的结论。
本实验结果表明,高温力竭和热习服后高温力竭组大鼠血清ANP水平下降较明显,可能由于ANP抑制ADH和ALD的作用。由于运动负荷和热负荷的刺激,机体需降低ANP的抑制作用,导致ANP分泌降低以适应高温环境和运动的需要,减少Na+和水的排出,减少了对ALD和ADH释放的抑制作用。此外,还与机体体液大量丢失,血浆容量减少导致心房充盈不足,对心房肌细胞的牵拉减少,使心房肌细胞释放ANP减少有关。本实验中,热习服大鼠和未热习服大鼠血清ANP浓度无差异,推测在高温环境中运动,机体自身产热及高温热辐射导致热量在体内持续积累,使产热率大于散热率,体温不断上升并接近体温调定点上限,机体严重脱水,血容量下降,心房肌分泌ANP减少。通过14天的热习服,C组大鼠机体逐渐适应了血浆容量减少的刺激,分泌ANP逐渐增多,同时本实验中,血清ADH浓度降低,ADH分泌减少,不需要ANP的抵抗作用,所以ANP分泌相应减少,最终导致热习服未对血清ANP浓度产生明显影响。
本研究结果表明,高温力竭组大鼠下丘脑ADH mRNA表达比空白对照组高。这是由于高温力竭运动后脱水严重,导致血容量降低,血清渗透压浓度升高,渗透压感受器及动脉压力感受器发放持续信号刺激下丘脑分泌ADH。热习服后高温力竭组大鼠下丘脑ADH mRNA表达与高温力竭组相比有降低趋势,说明热习服后再在高温环境下运动,机体水合状态保持较高水平,不足以动员下丘脑ADH mRNA高表达,下丘脑渗透压感受器的“调定点”发生改变,血浆渗透压升高未刺激下丘脑ADH mRNA表达上调。
4 小结
热习服明显提高大鼠在高温环境下的运动能力。经过热习服后,血液中抗利尿激素浓度降低,下丘脑渗透压感受器“调定点”上移,血浆渗透压变化与下丘脑分泌ADH不一致。
[1] Montain SJ,Laird JE,Latzka WA,et al.Aldosterone and vasopressin responses in the heat:hydration level and exercise intensity effects.Med Sci Sports Exerc,1997,29(5):661-668.
[2] AziziM,Iturrioz X,Blanchard A,et al.reciprocal regulation of plasma apelin and vasopressin by osmotic stimuli.JAm Soc Nephrol,2008,19(5):1015-1024.
[3]洪长青,严翊,谢敏豪.热应激与运动.北京体育大学学报,2004,(4):496-498.
[4] Hubbard RW,Mager M,Bowers WD,et al.Effect of lowpotassium diet on rat exercise hyperthermia and heatstroke mortality.JAppl Physiol,1981,51(l):8-13.
[5]杨锡让,傅浩坚.运动生理学进展.北京:北京体育大学出版社,2000:360-361.
[6] Cheuvront SN,Kenefick RW,Montain SJ,et al.Mechanisms of aerobic performance impairmentwith heat stress and dehydration.JAppl Physiol,2010,109(6):1989-1995.
[7] Foster-powerll K,Holt SH,Brand-Miller JC.International table of glycemic index and glycemix load values.Am J Clin Nutr,2002,76(l):5-56.
[8] Fuller A,Carter RN,Mitchell D.Brain and abdominal temperatures at fatigue in rats exercise in the heat.J Appl Physiol,1998,84(3):833-877.
[9] Hasegawa H,Takatori T,Komura T,etal.Wearing a cooling jacket during exercise reduces thermal strain and improves endurance exercise performance in a warm environment.J Strength Cond Res,2005,19(1):122-128.
[10] Donaldson K,Stone V,Seaton A,et al.Ambient particle inhalation and the cardiovascular system:potentialmechanisms.Environ Health Perspect,2001,109(4):523-527.
[11] Montain SJ,Laird JE,Latzka WA.Aldosterone and vasopressin responses in the heat:hydration level and exercise intensity effects.Med Sci Sports Exerc,1997,29(5):661-668.
[12] Kraemer WJ,Ratamess NA.Hormonal responses and adaptations to resistance exercise and training.Sports Med,2005,35(4):339-361.
[13] Fallo F.Renin-angiotensin-aldosterone system and physical exercise.Sports Med Phys Fitness,1993,33 (3):306-312.
[14] Mueller PJ.Influence of sedentary versus physically active conditions on regulation of plasma renin activity and vasopressin.Am J Physiol Regul Integr Comp Physiol,2008,295(3):727-732.
[15] Roy BD,Green HJ,Burnett M,et al.Prolonged exercise following diuretic-induced hypohydration effects on fluid and electrolyte hormones.Horm Metab Res,2001,33(9):540-547.
[16] Takeda N,Manabe I,Uchino Y,et al.Cardiac fibroblasts are essential for the adaptive response of themurine heart to pressure overload.JClin Invest,2010,120 (1):254-265.
[17] Schmidt W,Brabant G,Kroger C,et al.Atrial natriuretic peptide during and after maximal and submaximal exercise under normoxic and hypoxic conditions.Eur J Appl Physiol Occup Physiol,1990,61(5-6):398-407.
[18]钱令嘉,程素琦.肾Na,K-ATP酶在热环境中的变化及其调节作用.中国应用生理学杂志,1989,5 (4):349-353.
[19] Yoshida T,Shin-ya H,Nakai S,et al.Genomic and nongenomic effects of aldosterone on the individual variation of the sweat Na+concentration during exercise in trained athletes.Eur JAppl Physiol,2006,98(5):466-471.
[20] Sunderland C,Nevill ME.High-intensity intermittent running and field hockey skill performance in the heat.J Sports Sci,2005,23(5):531-540.
