草菇工厂化液体菌种制作与出菇试验*
2012-08-08陈多扬张一帆邵满超周振辉黄龙花胡惠萍杨小兵
陈多扬,张一帆, 邵满超 , 周振辉,黄龙花,胡惠萍,杨小兵
(1.广东粤微食用菌技术有限公司,广东 广州 510663;2.广东省微生物研究所,广东 广州 510070)
草菇Volvariella volvacea(Bull:Fr.)Sing,是盛产于我国南方的喜温、喜湿腐生食用真菌。 草菇栽培起源于我国,至今已有300多年的历史,经历了堆式栽培、层架立体栽培(塑料大棚或蘑菇房)、泡沫房熟料栽培等方式,其灭菌方式都采用一次发酵(堆制)或二次灭菌(堆制加巴氏灭菌)等方式。草菇生产中,传统的室外稻草生料堆式栽培,虽有设备简单、成本低等优点,但产量低且不稳定,生物学效率平均只有7%左右;以稻草为主料,二次发酵床架式栽培草菇的生物学效率一般为10%~20%,比室外堆栽提高2倍~3倍,但对于大面积栽培,培养料发酵处理需要花大量的劳动力;广东等地推广的室内巴氏消毒处理栽培法,一般以棉籽壳、废棉为主料,栽培草菇的生物学效率在25%~35%,但生产成本高、病虫害多、稳定性差[1-3]。至今为止,不同的地理区域,形成了不同的草菇栽培模式,但因其特有的种性和生态习性使得这些人工栽培模式的产量低且不稳定,仍然没有形成一个产业化、规范化的栽培模式。食用菌液体菌种的优势在于缩短生产周期,便于接种,提高成品率[4]。为适应新形势下的食用菌大规模工厂化栽培的需求,笔者对草菇液体菌种配方、发酵天数以及播种方式对出菇效果的影响进行研究探索,以期得到草菇从母种到工厂化栽培出菇全程的最优配方、流程及方法,为草菇液体菌种的制作和工厂化生产提供依据,并为食用菌栽培同行提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株
草菇V203,广东省微生物研究所食用菌研究发展中心选育菌种。
1.1.2 培养基
母种培养基:葡萄糖20 g、蛋白胨2 g、酵母膏2 g、磷酸二氢钾0.46 g、磷酸氢二钾1 g、硫酸镁0.5 g、琼脂20 g,蒸馏水1000 mL,pH8.3。固体原种培养基:棉籽壳85%、麦麸10%、生石灰5%。
液体培养基:蛋白胨2 g、酵母膏2 g、葡萄糖20.2 g、硫酸镁0.5 g、磷酸二氢钾1 g、磷酸氢二钾1 g,蒸馏水1000 mL,pH8.3。
查阅文献资料和平时生产积累的配方[5-7],获得5种目前常见报道的液体栽培种培养基,配方1:马铃薯200 g、葡萄糖20 g、蛋白胨10 g、硫酸镁1.5 g、磷酸二氢钾3 g、维生素 B1少量,蒸馏水1000 mL,pH 8.3;配方2:葡萄糖10 g、蛋白胨10 g、柠檬酸铵1 g、硫酸镁1 g、磷酸二氢钾2 g、维生素B1少量,蒸馏水1000 mL,pH8.3;配方3:葡萄糖20.2 g、蛋白胨2 g、酵母膏2 g、硫酸镁0.5 g、磷酸二氢钾1 g、磷酸氢二钾1 g,蒸馏水1000 mL,pH8.3;配方4:马铃薯200 g、葡萄糖20 g、麦麸15 g、硫酸镁1.5 g、磷酸二氢钾3 g、维生素B1少量,蒸馏水 1000 mL,pH8.3; 配方 5:马铃薯 50 g、蔗糖 20 g、麦麸40 g、蛋白胨5 g、硫酸镁1.5 g、磷酸二氢钾 2 g,蒸馏水1000 mL,pH8.3。
固体栽培种:废棉95%、石灰5%。
出菇栽培料:废棉95%、石灰5%。
1.2 方法
1.2.1 液体菌种的培养
将斜面菌种接入500 mL的三角瓶中(每瓶装培养基250 mL),每瓶接种10块~20块左右绿豆大小的菌块。每种处理做3个重复。32℃、200 r·min-1恒温摇床发酵6 d(发酵终点及发酵天数实验除外)。
1.2.2 液体栽培种培养基的筛选
参照张胜友的香菇液体培养基的筛选法[1],将V203接种在上述5个不同配方液体培养基,每个配方做3个重复,相同的条件下摇床发酵,通过观察记录液体菌种的菌丝萌发的速度、菌液澄清度、菌丝球大小和数量以及杂菌污染等情况,从而确定各配方的优劣。
1.2.3 液体菌种发酵时间的确定
采用上述获得的最佳液体培养基配方进行摇床发酵,从接种后72 h后开始取样,每隔24 h取1次,每次取发酵液50 mL,用pH计(pHB5便携式pH计)测定其pH值后,将发酵液在40目分样筛上清洗过滤收集菌丝,烘干后称取重量并记录,每次做3个重复,取平均值。
1.2.4 栽培出菇
试验栽培出菇地点为 “南方食用菌优良新品种繁育示范基地”草菇高温菇房,该基地菇房为工厂化全自动化控温、控湿菇房,栽培模式为筐式栽培,全程采用电脑系统自动控制温度、湿度、光照及通风。具体参数如下[5-9]:
温度:在养菌阶段32℃~35℃,子实体形成和出菇阶段 30℃~32℃。
湿度:在养菌阶段温度自然,子实体形成和出菇阶段90%~95%。
光照:在养菌阶段不需光照,子实体形成和出菇阶段光照为76.5 lx~98 lx。
通风:在养菌阶段通风为每隔24 h通风3次,每次5 min,子实体形成和出菇阶段每隔24 h通风48次,每次10 min。
1.2.5 液体种不同播种方法对出菇的影响试验
以传统的接种方法作对照,采用3种不同的创新接种方法,在接种量及栽培条件一致的情况下,观察记录其菌丝旺盛程度、出菇周期和出菇量的差异,每种方法做3个重复,取平均值。接种方法为:① 固体种和液体种混合进行撒播;②灭菌的棉籽壳和液体种混匀后撒播;③液体种直接洒栽培料上后和料混匀;④固体菌种碎匀后撒播 (对照)。
1.2.6 不同发酵天数的液体菌种对出菇的影响试验
以上述发酵终点确定的结果为标准,取与其发酵天数前后相差1 d~2 d的液体菌种进行相同条件下的栽培出菇,并以固体栽培种作为对照。观察记录其菌丝旺盛程度、出菇周期和出菇量的差异,每个处理做3个重复,取平均值。
2 结果与分析
2.1 草菇液体培养基不同配方的筛选
草菇液体培养基不同配方的菌丝生长情况见表1。
从表1中可以看出,草菇在5种液体种培养基配方中均可生长。而其中配方3和配方4效果较好,菌丝萌发快,菌丝球多而均匀,更适用于工厂化栽培出菇;配方1次之;而配方2和配方5则较差,菌丝量少且极不均匀。从培养基成分来看,配方3较为简单方便经济,且其生长快、生长较旺盛、菌丝球多而均匀。因此将配方3确定为草菇工厂化栽培种的最佳液体种配方。

表1 草菇液体培养基不同配方的菌丝生长情况
2.2 草菇液体种发酵终点的确定
草菇液体种发酵终点试验结果见图1。
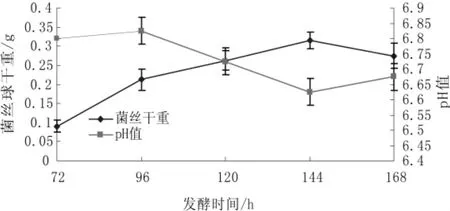
图1 草菇液体发种发酵终点试验
从图1可以看出,发酵72 h~168 h,随着时间的变化生物量迅速增加,过了144 h后有下降的现象,这可能是由草菇菌丝体自溶引起的。同时也对pH变化做了测定,随着时间的增加pH有所下降,但到了168 h有回升的迹象。因此发酵144 h后,生物量达到最大值,为最佳发酵时间。
2.3 液体种不同播种方法对出菇的影响试验
草菇液体种不同播种方法出菇试验结果见表2。

表2 草菇液体种不同播种方法出菇试验
从表2结果可以知道,方法①菌丝生长较旺,但出菇并不理想;方法②的菌丝生长最弱,但产量却比方法①高,同时方法③的产量最高,为570.5 g·筐-1,但其菌丝旺盛程度也不及方法②。因此菌丝的旺盛程度与出菇效果并无必然关系,而方法③最适于工厂化栽培种液体菌种的播种,且方法简便快捷。
2.4 不同发酵天数的液体菌种对出菇的影响试验
不同发酵天数的液体菌种的出菇效果分析见表3。
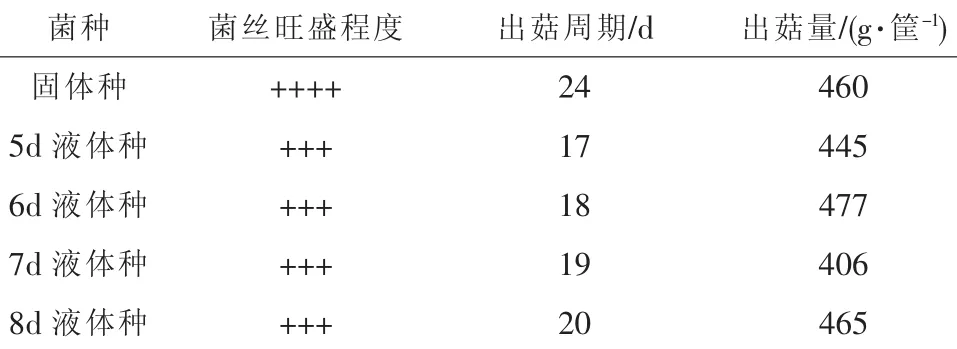
表3 不同发酵天数的液体菌种的出菇效果
从表3可以看出,固体种在栽培料上的菌丝生长较旺盛,而液体菌种的菌丝相对差一些,但出菇量并不比固体种差,而且出菇周期大大缩短。其中,液体菌种中以发酵6 d的出菇效果最好。
3 讨论
通过本研究,发现草菇液体培养基的最优配方为葡萄糖20.2 g、蛋白胨2.0 g、酵母膏2.0 g、硫酸镁0.5 g、磷酸二氢钾 1.0 g、磷酸氢二钾1.0 g,蒸馏水 1000 mL,pH8.3,以该配方做液体菌种的发酵,菌丝萌发快,菌丝球多而均匀,适用于工厂化栽培的需求。以栽培出菇效果为依据,得到最适发酵天数为6 d,发酵时间短则菌丝量不足,发酵时间太长又会出现菌丝自溶现象或易污染,这些都将影响栽培出菇效果。最好的液体种播种方法为直接将液体菌种洒在栽培料面并混匀,该方法不仅出菇产量高,栽培周期短,且简单快捷。这些结果与前人试验结果存在差异,可能由全自动化控制和作坊式栽培差异引起。
同时,实验表明,应用液体种进行草菇工厂化栽培,不仅大大缩短栽培周期,而且产量稳定,不易受污染,栽培不受季节和地域的限制,可进行周年栽培,应用液体种进行草菇工厂化栽培必将是未来发展的趋势。关于草菇工厂化栽培的其它参数,有待进一步试验探索。
[1]张胜友.中国液体菌种生产新技术[J].武汉:华中科技大学出版社,2010.
[2]王德源,刘可春.杏鲍菇液体菌种制作及应用[J].陕西农业科学,2006(3):48-49.
[3]王磊,张志光.草菇液体发酵摇瓶试验初探[J].中国食用菌,1994(2):43-44.
[4]杜姝莲,全卫丰,刘广建.草菇液体菌种最佳生长因子试验[J].食用菌,2004(1):16-18.
[5]蔡德华,杨立红,徐海英.食用菌液体菌种制种工艺的研究[J].当代生态农业,2003(Z1):33-36.
[6]张萍,蒋小满.不同营养条件对草菇液体培养的影响[J].江苏农业科学,2005(5):97-99.
[7]陈静,王淑军.草菇Ⅴ93液态发酵条件的初步探讨[J].淮海工学院学报:自然科学版,2005,14(2):63-66.
[8]丁米田,李灿.食用菌液体菌种摇瓶培养操作技术要点[J].现代农业科学,2009,16(4):11-14.
[9]宫志远,于淑芳.PH对五种珍稀食用菌菌丝生长的影响[J].食用菌学报,2002,9(1):40-43.
