HPLC 法测定人血浆中比阿培南的浓度及其药动学研究
2012-08-07王宝龙兰婷李明华李穆琼张俊娜李晓晔丁莉坤第四军医大学药学系化学教研室西安7003第四军医大学西京医院药剂科西安7003
王宝龙,兰婷,李明华,李穆琼,张俊娜,李晓晔#,丁莉坤(.第四军医大学药学系化学教研室,西安7003;.第四军医大学西京医院药剂科,西安 7003)
比阿培南是一种碳青霉稀类合成抗生素[1],对革兰阴性及革兰阳性需氧菌和厌氧菌等均具有超广谱强效抗菌作用[2],且较少发生其他β-内酰胺类抗生素常见的细菌耐药性问题[3];在临床上常用于治疗成人腹腔、下呼吸道和尿路感染,成为近些年来临床上治疗细菌感染常用药物。因此,本文参考相关文献[4~6]建立一种高效、稳定、方便、快捷的检测血浆中比阿培南的方法,并测定其药动学参数,为临床合理用药提供参考。
1 材料
1.1 仪器
1200型高效液相色谱仪,包括G1312A二元泵、G1314B紫外检测器、工作站(美国Agilent公司);TGL-16G高速离心机(上海安亭科学仪器厂);SartoriusBT25S电子分析天平(德国赛多利斯公司)。
1.2 试药
注射用比阿培南(山东兖州希尔康泰制药有限公司,规格:每支0.3 g,批号:080228);比阿培南对照品(山东兖州希尔康泰制药有限公司,批号:080228,含量:99.6%);内标:5-羟基吲哚乙酸标准品(中国食品药品检定研究院,批号:140737-200501,含量:97.8%);0.9%氯化钠注射液(安徽双鹤药业有限公司,批号:080 815-2M,规格:100 mL);甲醇为色谱纯,冰乙酸为分析纯。
2 方法
2.1 受试者选择
30名健康受试者,男、女各半,年龄(34.2±3.1)岁,身高(168.5±7.1)cm,体重(63.2±6.1)kg;试验前经病史询问、体检、胸透、心电图、血及尿常规、血生化检查,各项指标均正常,受试者无药物过敏史和药物依赖史,无精神病史及其他慢性病史。受试前2周及试验期间未服用任何其他药物,受试期间禁烟、酒及其他含咖啡因、茶碱等饮料,避免剧烈运动。所有受试者自愿参加试验并签署知情同意书,试验方案经第四军医大学西京医院医学伦理委员会批准。
2.2 给药方法
30名健康受试者,随机分配为低、中、高(150、300、600 mg)3个单剂量组,每组10例,男、女各半。试验前进清淡晚餐后禁食12 h,于试验当日用0.9%氯化钠注射液分别溶解注射用比阿培南150、300、600 mg,静脉滴注1.0 h。其中,300 mg剂量组的受试者在第1次给药后进行多次给药试验,给药剂量均为300 mg/次(方法同单剂量),q12h,连续给药5 d。
2.3 试验溶液的配制
2.3.1 对照品溶液:准确称取比阿培南对照品10 mg,置于10 mL容量瓶中,并用混合溶液(水∶甲醇=97∶3)定容至刻度线,得浓度为1.0 mg·mL-1的贮备液。再用混合溶液依次稀释成浓度为100 、10 、1 μg·mL-1的比阿培南对照品溶液。
2.3.2 内标溶液:准确称取5-羟基吲哚乙酸标准品10 mg于10 mL棕色容量瓶,以混合溶液(水∶甲醇=97∶3)定容至刻度线,振摇得浓度为1.0 mg·mL-1的5-羟基吲哚乙酸溶液。再用上述混合液稀释至浓度为0.1 mg·mL-1的内标溶液。
2.4 血样采集
2.4.1 单剂量给药样品采集:于给药前0 h,开始给药后15、30、45 min及1.0、1.5、2、2.5、3、3.5、4、7 h时由侧前臂静脉取血5 mL/人,置无菌肝素抗凝的试管中,离心分离出血浆置无菌试管中,于-20℃保存。
2.4.2 多剂量给药样品采集:于第2、3、4、5天早晨给药前及第5天早晨给药后30 min及1.0、1.25、1.5、2、2.5、3、3.5、4、5、7、9、11 h时采集血样,样品处理方法同单剂量给药。
2.5 血药浓度测定
2.5.1 色谱条件:色谱柱为Agilent Zorbax Bonus-RP(250 mm×4.6 mm,5µm);流动相为甲醇(A)-0.3%醋酸水溶液(B,梯度洗脱程序:0~4.2 min,98%;4.21~10 min,35%;10.01~15 min,98%);流速为1.0 mL·min-1;进样量为20 μL;柱温为35℃;检测波长为300 nm。
2.5.2 血浆样品处理:精密吸取血浆200 μL,加入内标溶液20 μL,涡旋10 s,加7%硫酸锌水溶液100 μL ,涡旋3 min,离心(16 000 r·min-1)5 min,定量吸取上清液200 μL,取20 μL进样分析。
2.5.3 专属性考察:采用“2.5.1”项下色谱条件,分别考察了空白血浆、血浆中加入内标及给药后受试者的血浆样品色谱图,结果,比阿培南的保留时间约为4.1 min,峰形良好。高效液相色谱图见图1。

图1 高效液相色谱图A.空白血浆;B.空白血浆+内标;C.给药后受试者血浆样品+内标;1.5-羟基吲哚乙酸;2.比阿培南Fig 1 HPLC ChromatogramsA.blank plasma B.blank plasma+internal standard;C.plasma sample after administration+internal standard;1.5-hydroxyindoleacetic acid;2.biapenem
2.5.4 标准曲线的制备:精密吸取空白血浆200 μL,分别加入浓度为0.001、0.01、0.01、0.1、0.1、0.1、1.0 mg·mL-1的标准溶液40、10、20、6、20、40、10 μL,配制成血浆样品浓度为 0.2、0.5、1.0、3.0、10.0、20.0、50.0 μg·mL-1,按“2.5.2”项下方法操作,记录色谱。以比阿培南浓度(X)为横坐标,比阿培南与内标峰面积之比(Y)为纵坐标,用加权最小二乘法进行回归运算,求得回归方程为:Y=0.000 461 9X-0.005 603 1(r=0.999 9),结果表明比阿培南血药浓度在0.2~50 μg·mL-1范围内线性关系良好,定量下限为0.2 μg·mL。
2.5.5 稳定性试验:精密吸取空白血浆200 μL,加入0.01、1.0 mg·mL-1的比阿培南对照品溶液10、8 μL,配制成含比阿培南浓度为0.5、40.0 μg·mL-1的血浆样品,置-20 ℃冰箱中保存。分别在0、6、12、18、24 h及2、3、4 d室温解冻,按“2.5.2”项下方法操作,代入当天标准曲线测定比阿培南浓度,结果表明样品在-20℃放置3 d内稳定。再取同样浓度的样品,置-20℃冰箱中保存12 h后取出,经过3次反复冻融,每次6 h,按“2.5.2”项下方法操作,结果表明,经过反复冻融后,样品浓度下降。
2.5.6 精密度试验:精密吸取空白血浆200 μL,加入0.01、0.1、1.0 mg·mL-1的比阿培南对照品溶液10、10、8 μL,配制成含比阿培南浓度分别为0.5、5.0、40.0 μg·mL-1的血浆样品各5份,按“2.5.2”项下方法操作,连续测定3 d。以当日标准曲线计算样品浓度,求得日内和日间精密度,结果见表1。
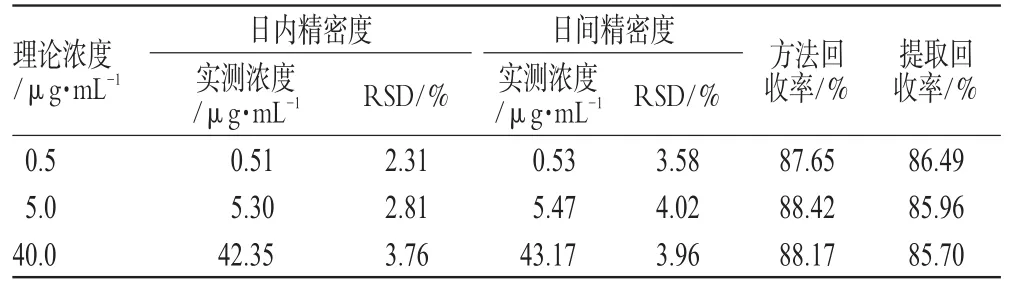
表1 精密度及回收率试验结果Tab 1 Results of precision and recovery tests
2.5.7 提取回收率试验:精密吸取空白血浆200 μL,按“2.5.6”项下方法加入比阿培南对照品溶液,配制成含比阿培南浓度为0.5、5.0、40.0 μg·mL-1的血浆样品各5份。按“2.5.2”项下方法操作,计算比阿培南与内标的色谱面积之比(fs)。另取空白血浆200 μL,按“2.5.2”项下方法操作,取血浆上清液200 μL,再如上述方法加入比阿培南对照品溶液,精密配制成含比阿培南浓度为0.5、5.0、40.0 μg·mL-1的溶液5份,测定峰面积,计算比阿培南与内标的色谱峰面积比(fr)。按fs/fr×100%计算,结果该方法的提取率高于85%,详见表1。
2.5.8 方法回收率试验:精密吸取空白血浆200 μL,按“2.5.6”项下方法加入比阿培南对照品溶液,配制成含比阿培南浓度为0.5、5.0、40.0 μg·mL-1的血浆样品各5份。按“2.5.2”项下方法操作,进样并测定峰面积,计算比阿培南与内标的色谱峰面积比(fr),将所得结果代入当日标准曲线中,即得实测浓度,以实测浓度除以理论浓度,即得方法回收率,结果见表1。
3 结果
3.1 血药浓度测试结果
受试者血浆样品按“2.5.2”项下方法操作,每批样品测定之前均制备随行标准曲线,并在测定时随机分配含比阿培南浓度为0.5、5、40 μg·mL-1的质控样品,计算样品和质控样品的浓度,根据质控样品的测定结果决定当日数据的取舍。30名受试者的平均药-时曲线见图2。
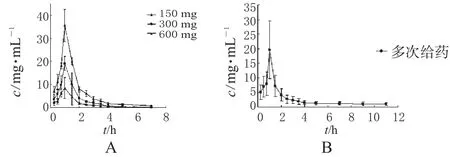
图2 健康受试者静脉滴注比阿培南后的平均血-时曲线A.单剂量;B.多剂量Fig 2 Mean plasma concentration-time curves of biapenemin healthy volunteers after intravenous dripping of biapenemA.single dose;B.multiple dose
3.2 药动学研究
以受试者的经时血药浓度计算其药动学参数,结果表明,比阿培南在人体内的药动学呈二室模型。30名健康受试者静脉滴注比阿培南后的各项药动学参数见表2。
表2 受试者静脉滴注比阿培南后的药动学参数(±s )Tab 2 Pharmacokinetic parameters of biapenemin healthy volunteers after intravenous dripping(±s )

表2 受试者静脉滴注比阿培南后的药动学参数(±s )Tab 2 Pharmacokinetic parameters of biapenemin healthy volunteers after intravenous dripping(±s )
药动学参数 单剂量给药高中t1/2/h tmax/h cmax/mg·L-1 AUC0~12 h/mg·h·L-1 AUC0~∞/mg·h·L-1低1.13±0.16 1.02±0.21 9.04±4.24 18.17±3.86 20.42±4.69 1.06±0.10 1.10±0.31 17.64±4.55 36.44±7.68 37.21±7.63 1.11±0.12 1.05±0.27 35.10±4.23 70.24±8.91 72.40±9.03多剂量给药1.07±1.35 1.04±0.60 19.61±3.68 32.47±3.90 33.36±3.80
4 讨论
目前,国内、外文献报道的有关本药的血药浓度测定方法较多,但效果不好。本试验在初期选用流动相时,尝试过不同比例的甲醇(乙腈)∶水、甲醇(乙腈)∶磷酸盐缓冲液、甲醇(乙腈):冰乙酸等多种流动相,由于比阿培南的强亲水性,最终确定使用亲水性Agilent Zorbax Bonus-RP柱(250 mm×4.6 mm,5µm),采用梯度洗脱的方式,先将有机相的比例调整至2%,等比阿培南在洗脱后,再加大有机相的比例,使内标在9.6 min洗脱,经比较表明,在本试验条件下,比阿培南与血浆内源性杂质、内标均能很好地分离,分离度高。
在沉淀样品过程中,采用多种常用的血浆沉淀剂进行沉淀,如乙腈[4]、高氯酸[5]、三氯乙酸、冰乙酸、硫酸铵、硫酸锌、甲醇,提取率试验结果表明,采用7%硫酸锌水溶液沉淀时,能同时将比阿培南与内标一同提出,血浆杂质蛋白不影响测定,且提取率高。
本试验随机选取30名受试者进行随机分组测试,从各组的药动学参数看,各剂量组内、各剂量组之间无显著性个体差异,不同年龄、身高、体重、性别之间也无显著性个体差异。
[1]张 菁,邢亮彬.注射用比阿培南的含量测定方法研究[J].中国药业,2006,15(1):19.
[2]陈 卫.注射用比阿培南细菌内毒素的检查方法[J].药学与临床研究,2007,15(5):427.
[3]艾迪杰·巴亚斯.HPLC法测定人血浆中比阿培南的浓度[J].中国药房,2009,20(32):2 517.
[4]周 颖,许俊羽,赵 侠,等.中国健康受试者单剂量静脉注射比阿培南的药代动力学[J].中国临床药理学杂志,2010,2(4):255.
[5]金小平,孟丽丽.比阿培南的人体药动学[J].中国医院药学杂志,2009,29(10):817.
[6]刘 一,赵立波,荆 珊,等.注射用比阿培南单剂量及多剂量静脉滴注给药的人体药动学研究[J].中国药房,2011,22(10):899.
