蓝莓果渣中熊果苷提取工艺的研究1)
2012-08-07王玉洁陈敏张扬贾琢赵玉红
王玉洁,陈敏,张扬,贾琢,赵玉红
(东北林业大学林学院食品科学系,哈尔滨 150040)
蓝莓(Vaccinium uliginosum)为杜鹃花科(Ericaceae)越橘属(Vacciniumspp.)多年生落叶或常绿灌木,俗称蓝莓[1],大量生长在我国东北地区。蓝莓果实中除了常规的糖、酸和 VC外,富含 VE、VA、VB、SOD、熊果苷、蛋白质、花青苷、膳食纤维以及丰富的K、Fe、Zn、Ca等矿物质元素[2]。熊果苷(arbutin),又名熊果甙、熊果素、熊果叶甙、熊果酚甙或杨梅甙,化学名称分别为4-羟基苯-α-D-吡喃葡萄糖苷和4-羟基苯-β-D-吡喃葡萄糖苷[3-5],具有抗炎、抑菌,镇咳、祛痰、平喘,美白去色素和利尿作用[6-7]。超声波是一种弹性机械波,利用超声振动能量,可以改变物质组织结构、状态、功能及加速这些改变的过程。若将其运用在固液萃取过程中,则可使细胞周围和细胞内产生环流,从而提高细胞壁和细胞膜的通透性,起到强化萃取过程、有利于细胞内有效成分浸出的作用[8]。超声法在植物有效成分提取中,已经被较广泛的应用[9-12]。目前市售熊果苷均为化学合成,而蓝莓果渣中含有重要数量的熊果苷,且对于蓝莓果渣中熊果苷的提取研究尚未见报道。因此,本研究以蓝莓果渣为原料,采用超声波辅助提取法提取蓝莓果渣中熊果苷,确定适宜的提取条件,为蓝莓果渣的深度开发和综合利用提供依据。
1 材料与方法
1.1 原料
蓝莓果渣:由哈尔滨本色生物科技有限公司提供,为生产饮料后的果渣,-40℃冰箱保存备用。
1.2 试剂
熊果苷标准品:黑龙江格睿思科技开发有限公司;乙醇、盐酸等均为分析纯。
1.3 仪器
超声波破碎仪,哈尔滨市松花江医疗器械厂;恒温水浴锅,上海一恒科技有限公司;酸度计,北京哈纳科仪科技有限司;紫外可见分光光度计,深圳市怡华新电子有限公司;电热恒温干燥箱,上海跃进医疗器械厂;电子天平,沈阳龙腾电子秤量仪器公司。
1.4 试验方法
1.4.1 工艺流程。蓝莓果渣→解冻→干燥→粉碎→40目过筛→加入提取液→超声波辅助提取→过滤→稀释、定容→测吸光值。
1.4.2 熊果苷最大吸收波长的测定。精密称取干燥至恒重的熊果苷标准品,置于25mL容量瓶中(棕色瓶),加入少量蒸馏水,振荡使其充分溶解,定容至25mL,摇匀。对熊果苷标准品溶液进行测定。
1.4.3 熊果苷的提取。称取2g蓝莓果渣粉,按1∶20(g/mL)的料液比加入酸性乙醇提取液,用超声波破碎仪辅助提取。超声波辅助提取条件定为:频率30kHz。超声波辅助提取40min后过滤得到熊果苷提取液,用紫外可见光分光光度计在最大吸收波长下测定吸光值,因吸光值与熊果苷含量成正比例关系,所以,以吸光值为考察指标,确定提取效果。
1.4.4 超声波辅助提取蓝莓果渣中熊果苷
1.4.4.1 乙醇浓度对蓝莓果渣熊果苷提取率的影响。分别称取蓝莓果渣粉2g,用0.1%的盐酸乙醇溶液提取,乙醇浓度分别为30%,40%,50%,60%,70%,料液比为1∶20,超声波功率为200W,超声控温为不超过50℃,超声30min后冷却,对提取液进行抽滤,然后将提取液稀释10倍,用紫外可见分光光度计测吸光值。
1.4.4.2 料液比对蓝莓果渣熊果苷提取率的影响。分别称取蓝莓果渣粉2g,用0.1%的盐酸乙醇溶液提取,乙醇浓度为60%,料液比分别为1∶10,1∶15,1∶20,1∶25,1∶30,超声功率为200W,超声控温为不超过50℃,超声30min后冷却,对提取液进行抽滤,然后将提取液稀释10倍,用紫外分光光度计分别测吸光值。
1.4.4.3 超声时间对蓝莓果渣熊果苷提取率的影响。分别称取蓝莓果渣粉2g,用0.1%的盐酸乙醇溶液提取,乙醇浓度为60%,料液比为1∶15,超声功率为200W,超声控温不超过50℃,超声时间分别为20min,30min,40min,50min,60min。冷却后对提取液进行抽滤,然后将提取液稀释10倍,用紫外分光光度计分别测吸光值。
1.4.4.4 超声功率对蓝莓果渣熊果苷提取率的影响。分别称取蓝莓果渣粉2g,用0.1%的盐酸乙醇溶液提取,乙醇浓度为60%,料液比为1∶15,超声控温不超过50℃,超声功率分别为200W、300W、400W、500W、600W,超声40min后冷却,对提取液进行抽滤,然后将提取液稀释10倍,用紫外分光光度计分别测吸光值。
1.4.4.5 正交试验

表1 正交试验因素水平表L9(34)
2 结果与分析
2.1 最大吸收波长的确定

图1 熊果苷标准品最大吸收波长扫描图
对熊果苷标准品在波长范围为190~900nm进行全波长扫描,得到4个最大吸收波长,结果如图1所示,最大吸收波长分别为。峰1:365.00nm;峰2:296.00 nm;峰3:259.00nm;峰4:235.00nm。
根据方法1.4.3对原料粗提后,用提取液进行全光谱扫描,结果如图2所示:

图2 蓝莓果渣提取液全光谱扫描图
从图2可以看出,蓝莓果渣提取液的全波长扫描图有2个峰,峰1为541nm,吸收值较低;峰2为236nm,吸收值较高。根据文献[13]和标准品全波长扫描图谱,确定熊果苷最大吸收波长为235.00nm。以下实验均在235nm条件下进行。
2.2 超声波辅助提取蓝莓果渣中熊果苷实验结果
2.2.1 乙醇浓度对蓝莓果渣中熊果苷提取效果的影响

图3 乙醇浓度对提取效果的影响
由图3可知,吸光值随乙醇浓度的增加而升高,超过60%后,吸光度降低。所以在相同条件下提取,最佳乙醇浓度为60%,此时吸光值最高,即提取效果最好。
2.2.2 料液比对蓝莓果渣熊果苷提取效果的影响

图4 料液比(g/mL)对提取效果的影响
由图4可知,料液比在1∶10~1∶15时,吸光值随料液比的增大而增大,当料液比在1∶15~1∶30时,吸光值又随着料液比的增大而逐渐减小。所以,料液比在1∶15时,吸光值最大,即提取效果最好。但实际考虑到减少溶剂用量,降低浓缩负荷,提取效果等方面考虑,用量不宜过大,料液比在1∶10~1∶15即可。
2.2.3 超声时间对蓝莓果渣熊果苷提取效果的影响
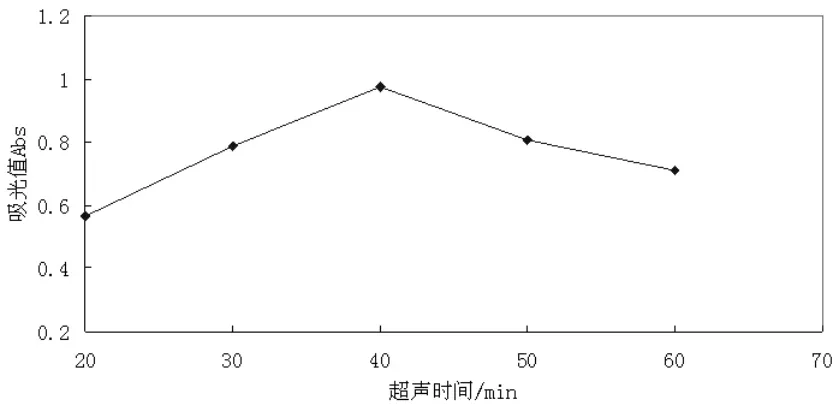
图5 超声时间对提取效果的影响
由图5可知,超声时间在20~40min时,吸光值随超声时间的增加而增大,当超声时间超过40min后,吸光值又随超声时间的增加而减小。随着时间的延长,熊果苷溶出增加,但是其并不稳定,时间过长,会因发生氧化反应而有所分解,导致吸光度值下降。所以,超声时间在40min,吸光值最大,即提取效果最好。
2.2.4 超声功率对蓝莓果渣熊果苷提取效果的影响。超声功率对提取效果有明显的影响,且该条件易控制,在实际生产中应用性较强[14],本实验选择超声功率对蓝莓果渣熊果苷提取效果进行研究,结果如图6所示。
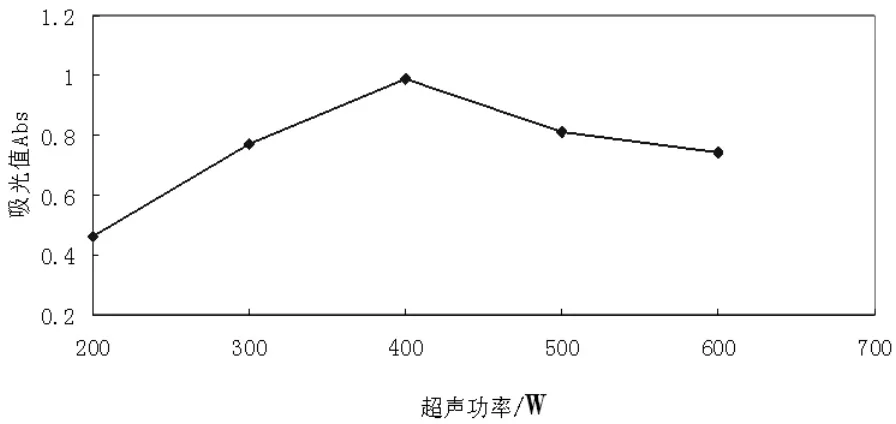
图6 超声功率对提取效果的影响
由图6可知,超声功率在200~400W时,吸光值随超声功率的增加而增大,当超声功率超过400W后,吸光值又随超声功率的增加而减小,原因可能是功率过大时会在提取时间内产生并聚集大量的热量,破坏熊果苷的结构,使其热分解,从而降低熊果苷的提取效果,且超声功率越大,耗能越多,从成本考虑应尽可能在保证提取效果的情况下降低超声功率。所以,选择超声功率为300~400W最佳。
2.2.5 正交试验结果。由于提取效果受到乙醇浓度、料液比、超声时间和超声功率4个因素影响,为确定更适宜的提取条件,采用4因素3水平正交试验L9(34)对超声波辅助提取蓝莓果渣中熊果苷的工艺条件进行优化,具体结果见表2。
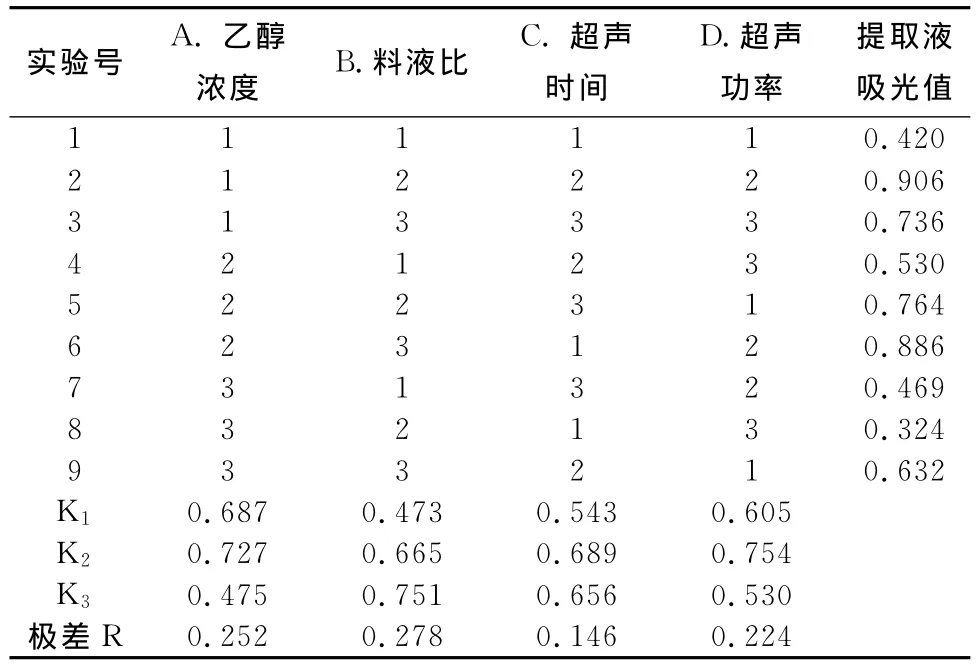
表2 L9(34)正交试验设计分析结果表
从表中可以看出K1、K2、K3反映了因子各水平对实验结果的影响,因而最大的K值对应于最好的水平,所以本实验较适宜的配比为A2B3C2D2,即乙醇浓度60%,料液比1∶20,超声时间40min,超声功率400W。验证试验结果表明,在此条件下吸光值达1.010。
比较各因子极差大小:极差越大,说明该因子的水平变动时,实验结果的变动越大,即该因子对实验结果的影响越大,从而可以按极差的大小来决定因子的主次顺序。本实验各因素对提取效果的影响主次顺序为:料液比>乙醇浓度>超声功率>超声时间。
3 结论
采用超声波辅助提取法能有效地从蓝莓果渣中提取熊果苷,适宜的提取工艺条件为:采用0.1%的盐酸乙醇溶液,乙醇浓度60%,料液比1∶20,超声时间40min,超声功率400W。
[1]高畅,程大海,高欣等.蓝莓果渣提取物总酚含量及抗氧化活性研究[J].植物研究,2010,30(2):253-256
[2]孟凡军,刘德福,迟聪.黑龙江垦区蓝莓产业现状与发展对策[J].现代化农业,2008(7):26-28.
[3]程鹏,陈梅兰,朱岩.高效液相色谱法测定化妆品中α-、β-熊果苷及烟酰胺[J].色谱,2010,28(1):89-92.
[4]阎雪莹,唐晓飞,王雪莹等,熊果苷的研究及应用进展[J].中国医药信息,2007,24(4):18-22.
[5]Jacek E.Nycz,Grzegorz Malecki,Monika Morag,et al.Arbutin:Isolation,X-ray structure and computional studies [J].Journal of Molecular Structure.1999,2010(3):13-17.
[6]Frohne et al.Urinary disinfectant activity of bearberry leaf extracts[J].Planta Med.1969,18(1):1-25.
[7]M aeda K.Fukuda M.In vitro effectiveness of several whitening cosmetic components in human m elanocytes[J].J.Soc.Cosmet.Chem.1991,42:361-368.
[8]Maricela Toma,M Vinatoru,L Paniwnyk,et a1.Investigation of the effects of ultrasound on vegetal tissues during solvent extraction [J].Ultrasonics sonochemistry,2001,8:137-142.
[9]李颖畅,宣景宏,孟宪军.蓝莓中花色素苷的研究进展.食品研究与开发,2007,28(1):178-81.
[10]孟凡丽,苏晓田,李亚东.红豆越桔果实中3-半乳糖-矢车菊色素提、分离及结构鉴定.吉林农业大学学报,2004,26(5):529-30.
[11]佟琳琳,孟凡丽,李亚东等.超声波提取法提取越橘果实花色苷的研究[J].农产品加工,2009(5):73-74.
[12]顾文秀,谢为明,夏文水等.超声波提取乌饭树叶色素及其稳定性的研究[J].林产化学与工业,2005,25(3):74-78.
[13]Demetrios Petkou,Grigorios Diamantidis,Miltidis Vasilakakis.Arbutin oxidation by pear(Pyrus communis L.)peroxidases.Plant Science.2002,162(1):115-119.
[14]王振宇,赵鑫.超声波提取大花葵色素的工业研究[J].林产化学与工业,2003,23(2):65-67.
