青蒿素衍生物对非小细胞肺癌A549细胞增殖的影响
2012-08-07广州中医药大学热带医学研究所广州510405
赵 昉 广州中医药大学热带医学研究所 广州 510405
郑绍琴 广州中医药大学硕士研究生
青蒿素是从中药菊科植物黄花蒿(Artemisia annua L)的叶中提取而来,其衍生物包括:青蒿素(artemisinin)、青蒿琥酯(artesunate,Art)、双氢青蒿素(dihydroartemisinin,DHA)等。青蒿素的药理作用广泛,包括抗疟原虫、抗肿瘤、免疫抑制、抗病毒、抗孕等多种活性药理作用[1-4]。本研究通过对青蒿素、青蒿琥酯、双氢青蒿素对肺癌A549增殖的影响,观察不同青蒿素衍生物的抗肿瘤作用。
1 实验材料
1.1 细 胞 非小细胞肺癌A549,引自美国ATCC,由本室冻存传代保管。
1.2 药 物 青蒿素、双氢青蒿素、青蒿琥酯,由广东新南方青蒿科技有限公司提供。阳性药物5-氟尿嘧啶(5-FU)注射液,上海旭东海普药业有限公司,批号101103,规格0.25g/10 mL。1.3 试剂仪器 低糖DMEM、HEPES均购自美国GIBCO公司;小牛血清购自广州畜牧场,批号20100618;L-谷氨酰铵和MTT均购自Sigma公司;其他相关产品为国产试剂。美国宝特ELX800型全自动酶标仪、全自动CO2孵箱(上海力申科学仪器有限公司,型号:HF90),倒置显微镜(日本 Olympus,型号CK40)、海尔生物安全柜(青岛海尔特种电器有限公司,型号:HR40-ⅡA2)。
2 实验方法
初步检测A549的细胞倍增时间和青蒿琥酯、双氢青蒿素、青蒿素在A549的半数毒性浓度。结合初步实验结果,选取TC10作为后续实验浓度,观察各青蒿素衍生物对A549肺癌细胞增殖的影响。
2.1 细胞接种 常规复苏细胞后,待细胞生长至一定数量后,用0.25%胰酶消化1~5 min,终止消化,并用含10%血清的DMEM培养基重悬细胞。计数后用完全培养基调整细胞浓度为5.0×105/mL,按0.1 mL/孔接种于96孔细胞板上,37℃、5%CO2条件培养。
2.2 A549细胞生长曲线的绘制 按2.1方法接种细胞,于接种后每24 h做一次MTT染色。每天取4个复孔细胞进行MTT染色,连续9天。最后结果以细胞MTT染色OD490为纵坐标,实验时间为横坐标,利用回归法求出细胞增殖时间。
2.3 青蒿素衍生物半数毒性浓度TC50测定 按2.1方法接种细胞,根据A549生长曲线的结果,选取上药时间为细胞接种后12 h,实验周期为4天。在接种细胞12 h后弃细胞上清液,按以下各青蒿素衍生物稀释浓度加入细胞板中,0.1 mL/孔,4复孔/浓度。青蒿素起始浓度为20 mmol/L,双氢青蒿素起始浓度为500 μmol/L,青蒿琥酯起始浓度为500 mol/L,各青蒿衍生物以倍比稀释法稀释,共8个梯度浓度。阳性药物5-氟尿嘧啶起始浓度为20 mmol/L,4倍梯度稀释共5个浓度,同时设置不加药物的正常对照组和含1%DMSO的溶媒对照组。上药后继续于37℃、5%CO2条件下培养4天,终止实验。用MTT法检测各青蒿素衍生物对A549的毒性作用,在酶标仪下以490nm波长读取其OD值。按照下列公式计算:细胞存活率=(正常对照组OD值-实验组OD值)/(正常细胞对照组OD值-溶媒对照组OD值)×100%。再根据Reed-Muench法计算各青蒿素衍生物的TC50。
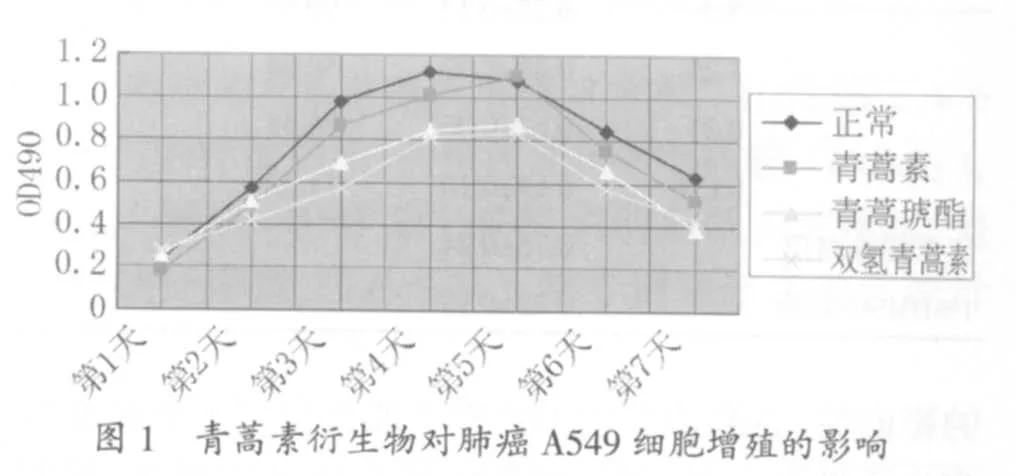
2.4 青蒿素衍生物对非小细胞肺癌A549细胞增殖的影响 根据2.3所得结果,选取青蒿素200μmol/L、双氢青蒿素 5μmol/L、青蒿琥酯 8μmol/L、5-FU。在细胞接种24h后,弃上清液,分别加入含以上各浓度的青蒿素衍生物培养基,同时设立只加正常培养基的对照组。0.1mL/孔,4个复孔/浓度,在上药后分别于第 1、2、3、4、5、6 和第 7 天分别取样做动态 MTT,观察青蒿素衍生物对A549细胞增殖的影响。
3 实验结果
3.1 A549细胞倍增时间的测定 通过回归分析,A549细胞的倍增时间为9.6 h,生长高峰期在接种后的第4天出现。根据初步的实验结果,选取细胞接种后12 h为上药时间,实验周期选5天为1个周期。结果见表1。
表1 MTT法测定非小细胞肺癌A549细胞生长曲线(±s)

表1 MTT法测定非小细胞肺癌A549细胞生长曲线(±s)
OD 1天0.23±0.11 2天0.65±0.08 3天1.15±0.21 4天 5天1.22±0.17 1.18±0.13 490 6天1.05±0.23 7天 8天 9天0.64±0.01 0.58±0.21 0.33±0.05
3.2 青蒿素衍生物半数毒性浓度TC50的测定 在A549细胞上,青蒿素、双氢青蒿素和青蒿琥酯的半数毒性浓度 TC50分别为 1.77 mmol/L、58.24 μmol/L、64.33 μmol/L。阳性对照物5-FU的半数毒性浓度为1.18 mmol/L。根据初步结果显示,双氢青蒿素和青蒿琥酯对A549肺癌细胞的抑制作用较好,其剂量浓度达到微摩尔水平。与双氢青蒿素、青蒿琥酯相比,青蒿素的作用稍微差,为1.77 mmol/L,比阳性对照物5-FU稍大。显示双氢青蒿素抗肺癌A549作用最好,青蒿琥酯次之,青蒿素较差,见表2。
3.3 青蒿素衍生物对A549细胞增殖的影响 正常对照组细胞的倍增时间为11.2 h,第4天达到生长高峰期,从第5天开始,由于受到接触抑制和养分耗竭的影响,细胞活性逐渐下降。青蒿素200 μmol/L组的细胞倍增时间为9.6 h,在第5天到达生长高峰期后细胞活性迅速下降。青蒿琥酯8 μmol/L组的细胞倍增时间为27.8 h,在第5天到达生长高峰期后细胞活性迅速下降;双氢青蒿素5 μmol/L组的细胞倍增时间为36.6 h,在第5天到达生长期,见图1。
4 讨论
近年研究显示,青蒿素类药物对肿瘤细胞的杀伤作用,主要通过抑制细胞增殖和诱导细胞凋亡途径完成。在青蒿素各衍生物中都有一个过氧化物桥活性基团,在其抗疟原虫的研究中指明青蒿素抗疟的机制是由于过氧化物桥可以与二价铁反应生成自由基,最终产生自由基活性代谢物,损伤虫体细胞膜结构以达到抗疟目的。有学者认为青蒿素衍生物抗肿瘤的机制与抗疟机制相似。由于铁蛋白和转铁蛋白受体表达在肿瘤细胞上表达都较高[5],尤其是进入G1期细胞的转铁蛋白受体表达和铁离子摄入都显著增多[6],因此青蒿素针对此周期的细胞具有特异性的靶向性,在高浓度的Fe2+离子催化作用下氧桥断裂产生活性自由基,破坏细胞的线粒体的完整性,同时也可以通过调控细胞周期,下调增殖细胞核抗原(PCNA)和Bcl-2基因的表达,影响拓扑异构酶活性等,诱导细胞进入凋亡程序。也有学者认为,青蒿素类药物可以通过线粒体依赖途径,降低线粒体膜电位等途径诱导肿瘤细胞发生凋亡[7]。
表2 半数毒性浓度TC50的测定(±s)
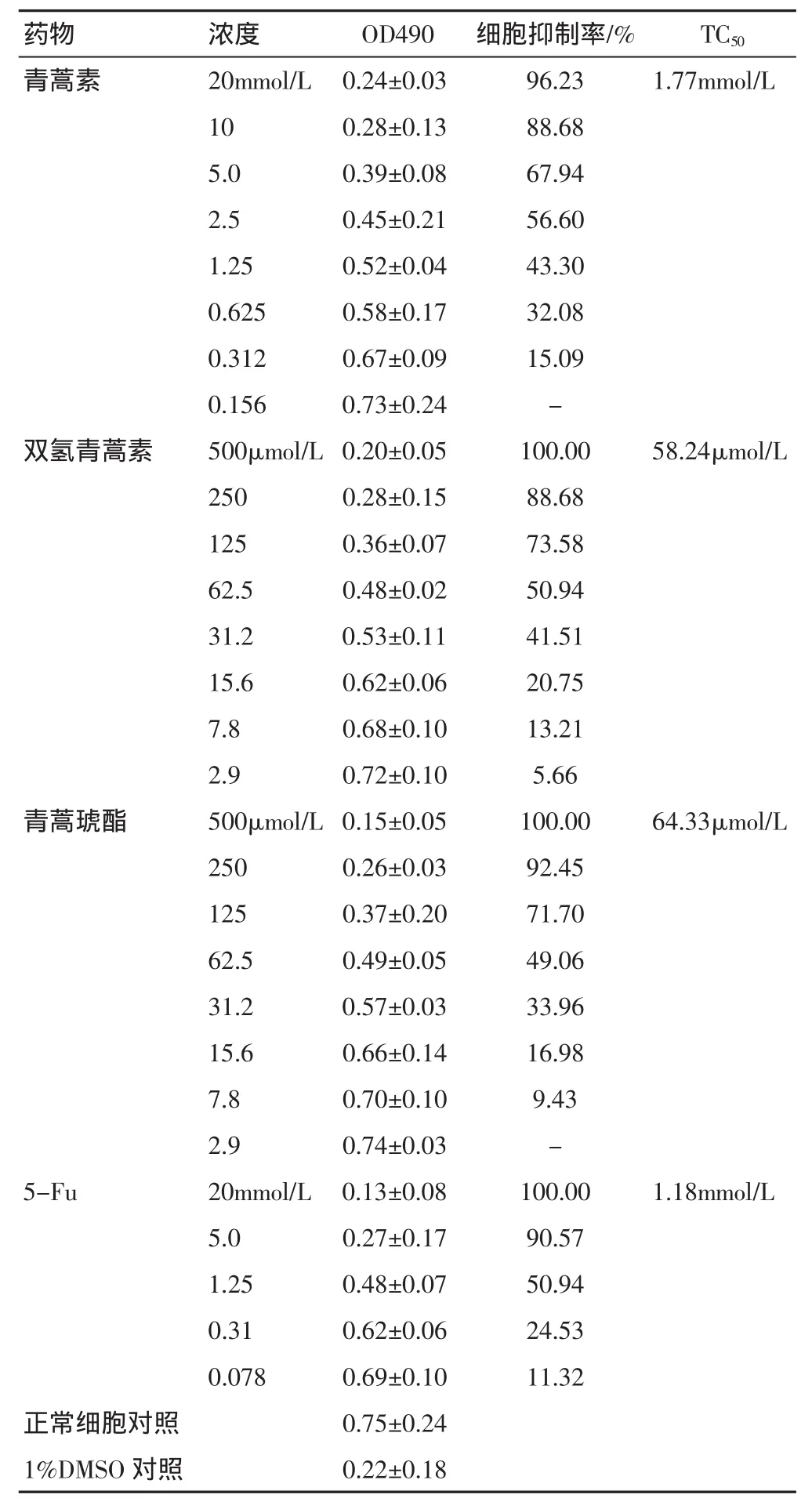
表2 半数毒性浓度TC50的测定(±s)
TC50青蒿素 1.77mmol/L药物浓度20mmol/L OD490 细胞抑制率/%0.24±0.03 96.23 10 0.28±0.13 88.68 5.0 0.39±0.08 67.94 2.5 0.45±0.21 56.60 1.25 0.52±0.04 43.30 0.625 0.58±0.17 32.08 0.312 0.67±0.09 15.09 0.156 0.73±0.24 -双氢青蒿素 500μmol/L 0.20±0.05 100.00 58.24μmol/L 250 0.28±0.15 88.68 125 0.36±0.07 73.58 62.5 0.48±0.02 50.94 31.2 0.53±0.11 41.51 15.6 0.62±0.06 20.75 7.8 0.68±0.10 13.21 2.9 0.72±0.10 5.66青蒿琥酯 500μmol/L 0.15±0.05 100.00 64.33μmol/L 250 0.26±0.03 92.45 125 0.37±0.20 71.70 62.5 0.49±0.05 49.06 31.2 0.57±0.03 33.96 15.6 0.66±0.14 16.98 7.8 0.70±0.10 9.43 2.9 0.74±0.03 -5-Fu 20mmol/L 0.13±0.08 100.00 1.18mmol/L 5.0 0.27±0.17 90.57 1.25 0.48±0.07 50.94 0.31 0.62±0.06 24.53 0.078 0.69±0.10 11.32正常细胞对照 0.75±0.24 1%DMSO对照0.22±0.18
本实验初步显示,青蒿素各衍生物的抗肺癌A549细胞的活性不相同。其中双氢青蒿素和青蒿琥酯抗A549活性较好,青蒿素作用稍差。实验中双氢青蒿素和青蒿琥酯都能延长细胞增殖时间,延缓细胞增殖周期,这与之前报道的青蒿素类药物可以将细胞周期阻滞于G2/M期的结果一致[8]。而青蒿素对A549的抑制作用并不明显。基于不同的青蒿素衍生物对同一肿瘤的抑制活性并不相同这一现象,这可能与化学药物的结构有关。双氢青蒿素为青蒿素经四硼酸钠还原所得,而青蒿琥酯的代谢产物是双氢青蒿素,各衍生物的极性不同,或许会导致细胞对其摄取或结合的程度也不相同,从而影响药物抗肿瘤活性。同时与体内筛选系统相比,体外抗肿瘤筛选体系缺乏氧化还原代谢酶系统完整性,这也对前体药抗肿瘤活性的研究有一定的影响。
[1]廖洪利,苏春丽,王伟新,等.抗肿瘤青蒿素衍生物的研究[J]. 药学实践杂志,2009,27(2):84-86.
[2]贺小青,方鹏飞.青蒿素及其衍生物的药理作用[J].医药导报,2006,25(6):528-530.
[3]李秀萍,郭伟,何琳.青蒿素及其衍生物的药用研究进展[J].疾病监测与控制杂志,2006,2(7):449-450.
[4]梅林,石开云,苏建华,等.青蒿素国内研究进展[J].激光杂志,2008,29(2):95-96.
[5]张豪,沈明山,方宏清,等.转铁蛋白/转铁蛋白受体介导的药物运输[J].中国生物工程杂志,2004,24:1-5.
[6]王勤,吴理茂,王乃平,等.青蒿琥酯抗肿瘤作用的机制研究[J].药学学报,2002,37(6):477.
[7]聂蕾,殷隆,尹少甫,等.青蒿琥酯诱导人早幼粒白血病细胞HL-60凋亡的线粒体机制[J].中国临床药理学与治疗学,2005,10(2):176-179.
[8]林芳,钱之玉,丁健,等.二氢青蒿素对人乳腺癌MCF-27细胞的体外抑制作用[J].中国新药杂志,2002,11(12):934.
