热毒宁注射液对哮喘大鼠肺组织病理改变及TRAF2表达的调控作用
2012-08-07范广民浙江省台州市中心医院台州317000
范广民 叶 斌 浙江省台州市中心医院 台州 317000
李绍波 浙江省台州医院
童夏生 阮正英 浙江省台州市中西医结合医院
亢晓冬 杭州师范大学钱江学院
叶 辉 浙江省台州市第一人民医院
哮喘是一种气道炎症性疾病,涉及多种炎症细胞和细胞组分,导致慢性的病理生理改变,表现为气道组织肿胀、黏液腺增生和黏液栓形成[1]。其机制十分复杂,至今尚未完全阐明。中药热毒宁注射液(成分:金银花、青蒿、栀子)具有抗炎症、抗病毒、清热解毒之功效,不仅能有效治疗上呼吸道感染、慢性支气管炎[2-3],还能在急性肺损伤中起保护作用[4-5],在临床上得到广泛应用。但该药对哮喘的治疗作用则鲜见报道。目前已知,肿瘤坏死因子超家族参与了哮喘气道炎症过程[6],但其超家族成员肿瘤坏死因子受体相关因子(tumor necrosis factor receptor associated factor,TRAF)在哮喘的作用如何,目前知之甚少。本研究通过观察热毒宁注射液对哮喘大鼠肺组织病理改变和TRAF2表达的影响,探讨其可能的作用机制。
1 材料与方法
1.1 主要试剂 鸡卵白蛋白(OVA)Ⅴ级购自美国Sigma公司;小鼠抗大鼠TRAF2多克隆抗体购自美国Santa Cruz公司;即用型SP系列检测试剂盒(其中试剂B:生物素标记二抗工作液选用SP-9000)及DAB显色剂(ZLI-9018)均购自北京中山生物有限公司。
1.2 实验动物及分组 清洁级健康雄性SD大鼠27只,4~5 周龄,体重(121±7)g,由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪)2007-0005,杭州师范大学实验动物中心清洁级环境中饲养。随机分成哮喘组、对照组、热毒宁组,每组9只。
1.3 动物模型复制[7]哮喘组第1天和第8天腹腔注射OVA/Al(OH)3混合液(含OVA1mg和Al(OH)3100mg)2mL致敏,各1次。第15天开始每天向大鼠喷雾(空气压缩雾化器:PARI BOY-037G6000 GERMANY)1%OVA 30min,连续激发 7 天。造模成功后表现为烦躁不安、搔痒、喘鸣、腹肌抽搐等症状。对照组致敏和激发均以生理盐水替代OVA和Al(OH)3,热毒宁组致敏和激发方法同哮喘组,不同的是在抗原首次激发前24 h和每次激发前0.5 h给予腹腔注射热毒宁注射液(江苏康缘药业股分有限公司生产,批号 100618),1 mL/只。
1.4 肺组织标本制备 末次激发24 h后,10%水合氯醛(400mg/kg)腹腔注射麻醉,心脏抽血致死。取右肺门部位组织块,4%多聚甲醛-PBS溶液固定,常规石蜡包埋切片,HE染色后观察肺组织病理变化(OLYMPUS-CX40 JAPAN)。
1.5 免疫组化方法 采用SP法测定TRAF2的表达[8]。染色步骤如下:①石蜡切片,64℃烤片2h,二甲苯Ⅰ、Ⅱ、Ⅲ脱蜡,梯度酒精(依次100%酒精Ⅰ、Ⅱ、95%酒精Ⅰ、Ⅱ、85%酒精、75%酒精)水化,蒸馏水冲洗,PBS浸泡5min;②抗原修复:使用pH=6.0柠檬酸抗原修复液高压锅抗原热修复(高压锅旋转阀开始旋转起计时 2min);③3%H2O2室温孵育 5~10min,PBS 冲洗,2min×3次;④5%~10%正常血清封闭,室温孵育10min。倾去血清,滴加TRAF2,抗体稀释浓度为1:20,4℃过夜;PBS冲洗,2min×3次;⑤滴加生物素标记二抗工作液,37℃孵育 10~20min; PBS冲洗,2min×3次;⑥滴加辣根酶标记链霉卵白素工作液,37℃孵育 10~20min;PBS冲洗,2min×3次;⑦DAB 显色剂显色;⑧自来水充分冲洗,复染、脱水透明、封片。PBS代替一抗作阴性对照。结果判定:光镜下观察细胞着色情况,蛋白定位于细胞胞浆内,阳性细胞胞浆呈棕黄色表达,结构清晰,着色明显高于背景。每张切片随机选择5个细支气管,Image-pro Plus 5.1免疫组化图像分析系统对阳性细胞进行灰度扫描,取其平均值代表该片的光密度值(OD值)。
2 结果
2.1 热毒宁对肺组织病理学的影响 HE染色显示,对照组肺组织结构完整,支气管腔规则,黏膜上皮完整,较少炎症细胞浸润。哮喘组肺内支气管及血管周围见大量炎性细胞浸润、黏液腺增生、气道上皮断裂和脱落、黏液栓形成等表现。热毒宁组炎性细胞数目较哮喘组明显减少,黏膜上皮增生不明显,支气管腔见较少的炎性分泌物,黏液腺增生不明显,未见黏液栓的形成,见图1(封三)。
2.2 热毒宁对肺组织TRAF2表达的影响 免疫组化结果显示,阳性细胞的胞浆呈棕黄色表达,主要表达于气道上皮细胞和炎症细胞,而肺组织中却较少表达。哮喘组支气管壁TRAF2的光密度值显著高于对照组(P<0.01);热毒宁组支气管壁TRAF2的光密度值与哮喘组比较,差异无统计学意义(P>0.05),但仍显著性高于对照组(P<0.01),见表1、图 2(封三)。
表1 三组大鼠支气管壁TRAF2表达水平比较(±s)
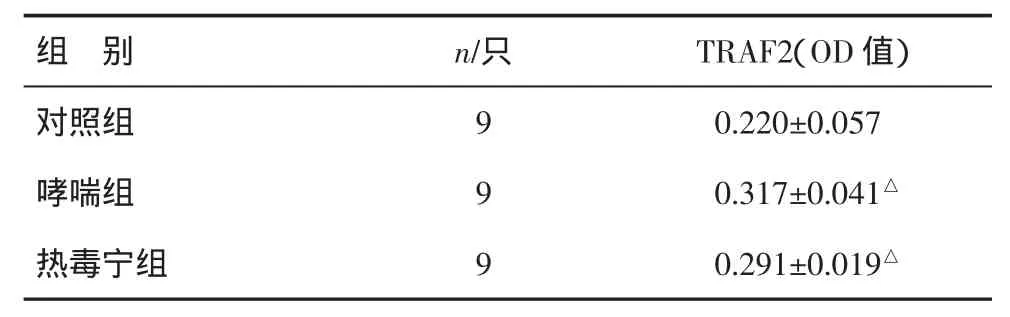
表1 三组大鼠支气管壁TRAF2表达水平比较(±s)
注:与对照组比较,△P<0.01
组 别 n/只 TRAF2(OD值)对照组 9 0.220±0.057哮喘组 9 0.317±0.041△热毒宁组 9 0.291±0.019△
3 讨论
中药是我国的传统医药,有着丰富的临床治疗经验。常作为一种辅助性药物用于哮喘和咳嗽变异性哮喘的治疗[9-10],不仅能调节哮喘时的Th1/Th2失衡[11],还能下调 TNF-α、IgE 等炎症因子[12]。热毒宁注射液主要成分为青蒿、金银花、栀子,具有疏风解表、清热解毒的作用。青蒿辛、苦、寒,辛以解表、寒以清热是解表清热、宣郁散邪之良药。研究表明,青蒿具有免疫抑制和细胞免疫促进作用。金银花具有广谱抗菌、抗病毒、抗肿瘤、增强免疫、解热抗炎、利胆、保肝、降脂等多种药理作用。栀子性寒、味苦、无毒,具有泻火除烦、清热利湿、凉血散瘀的功效。本研究发现,热毒宁组肺组织支气管黏膜上皮增生、支气管腔炎性分泌物、黏液腺增生和黏液栓的病理改变较哮喘组显著性减轻,尤其是炎性细胞数目较哮喘组明显减少,提示热毒宁注射液具有抗炎作用,能够抑制哮喘的气道炎症,为哮喘治疗提供了新的前景。
TRAFs是TNF受体超家族和IL-1R/TLR超家族信号传导通路的重要成分,TNF信号传导中,TRAF2作为接头蛋白和调控因子在几乎所有分支通路中起作用,在调节TNF-R1介导的NF-κB和JNK激活过程中起重要作用。TRAF在天然免疫和获得性免疫中都起重要作用,是细胞凋亡和细胞应激反应的重要调节因子[13]。TRAF不仅能增强TNFR诱导的炎症因子的产生,而且能增强TNFR1-TNFR2的协同作用[14],还与炎症细胞的分化有关[15]。TRAF2是TRAF家族的经典成员,几乎在所有组织中转录,是表达最为广泛的TRAF家族成员。TRAF2能与TNF受体家族中的大多数成员相互作用,并在TNF-R1介导的NF-κB和JNK的激活过程中起作用,对多种生理过程十分重要,如细胞生长、死亡、发育、癌基因的表达、免疫和感染等[16]。
本研究结果显示,阳性细胞的胞浆呈棕黄色表达,提示TRAF2表达部位在细胞浆。它主要表达于气道上皮细胞和炎症细胞中,而肺组织和支气管平滑肌中却较少表达,提示它可能主要是通过气道上皮细胞和炎症细胞起作用。而TRAF1主要表达在支气管平滑肌细胞,可能是通过支气管平滑肌细胞的途经参与哮喘气道高反应性[17]。本研究同时发现,哮喘组支气管壁TRAF2的光密度值显著高于对照组,提示TRAF2可能与哮喘的气道炎症有关。相似的研究[18]也发现,在OVA诱导的哮喘小鼠模型中,支气管肺泡灌洗液中炎症细胞(嗜酸细胞、中性粒细胞、淋巴细胞)、Th2细胞因子和气道高反应性显著增加,而TRAF1缺失的小鼠则没有上述改变,认为TRAF1可能是促进哮喘炎症的一个细胞因子。上述表明,TRAF家族在哮喘的发病中可能起了致炎的作用,抑制或阻断TRAF的信号通路可能是治疗哮喘另一个有效的途经。本研究还发现,热毒宁组支气管壁TRAF2的光密度值与哮喘组相比差异无统计学意义,仍显著性高于对照组。提示热毒宁抑制哮喘气道炎症可能不是通过TRAF2途径,或其量效关系还没有发现。
上述结果表明,哮喘大鼠TRAF2的表达水平增强,它可能参与了哮喘的气道炎症过程。热毒宁能减轻哮喘大鼠气道炎症,可能不是通过TRAF2途径,其机制尚有待于进一步研究。
[1]中华医学会儿科学分会呼吸学组《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南[J].中华儿科杂志,2008,16(10):745-753.
[2]陈灵红.热毒宁注射液治疗小儿急性上呼吸道感染102例[J].浙江中西医结合杂志,2008,18(6):391.
[3]黄承吨.清热解毒法治疗慢性支气管炎急性发作的疗效观察[J].中国医药指南,2010,8(25):86-87.
[4]刘红菊,陶晓南,辛建宝,等.中药热毒宁对急性肺损伤兔肺内致炎因子的影响[J].中国新药与临床杂志,2007,26(6):446-449.
[5]刘红菊,张建初,张劲农,等.热毒宁注射液对兔急性肺损伤的防治作用[J].华中科技大学学报(医学版),2008,37(5):610-613.
[6]Desai D,Brightling C.TNF-alphaantagonism in severe asthma[J].Recent Pat Inflamm Allergy Drug Discov,2010,4(3):193-200.
[7]李昌崇,童夏生,阮正英,等.中性粒细胞弹性蛋白酶和IL-8在大鼠哮喘中的作用及地塞米松调控[J].中华微生物学和免疫学杂志,2005,25(9):737-741.
[8]童夏生,罗冬娇,叶斌,等.CXC类趋化因子GROα、ENA-78及NAP-2在大鼠哮喘中的表达及意义[J].中华微生物学与免疫学杂志,2009,29(9):778-781.
[9]韩振新.GINA方案加中药贴敷治疗儿童支气管哮喘56例效果观察[J].南通大学学报(医学版),2010,30(6):460。
[10]张太华.中药内服外用治疗咳嗽变异性哮喘28例[J].河南中医学院学报,2009,24(141):78.
[11]黎媛,曾垂秀,周远大.中药对过敏性哮喘大鼠模型Thl/Th2型细胞因子的影响[J].细胞与分子免疫学杂志,2009,25(1):1056-1057,1060.
[12]熊维,郑培榆,张渝,等.中药对哮喘大鼠IL-18mRNA和TNF-αmRNA表达及IgE含量的影响[J].第四军医大学学报,2009,30(8):753-756.
[13]Wang PH,Wan DH,Gu ZH,et al.Litopenaeus vannamei tumor necrosis factor receptor-associated factor 6(TRAF6)responds to Vibrio alginolyticus and white spot syndrome virus(WSSV)infection and activates antimicrobial peptide genes[J].Dev Comp Immunol,2011,35(1):105-114.
[14]Wicovsky A,Henkler F,Salzmann S,et al.Tumor necrosis factor receptor-associated factor-1 enhances proinflammatory TNF receptor-2 signaling and modifies TNFR1-TNFR2 cooperation[J].Oncogene,2009,28(15):1769-1781.
[15]Dupoux A,Cartier J,Cathelin S,et al.cIAP1-dependent TRAF2 degradation,regulates the differentiation ofmonocytes into macrophages and their response to CD40 ligand[J].Blood,2009,113(1):175-185.
[16]Chen G,Goeddel DV.TNF-R1 signaling:a beautiful pathway[J].Science,2002,296(5573):1634-1635.
[17]Amrani Y,Chen H,Panettieri RA.Activation of tumor necrosis factor receptor 1 in airway smooth muscle:a potential pathway that modulates bronchial hyper responsiveness in asthma[J].Respir Res,2000,1(1):49-53.
[18]Oyoshi MK,Bryce P,Goya S,et al.TNF receptor-associated factor 1 expressed in resident lung cells is required for the development of allergic lung inflammation[J].J Immunol,2008,180(3):1878-1885.
