盐霉素增强吉非替尼诱导人肺腺癌细胞株A549凋亡的作用*
2012-08-02陈小宇祝爱珍刘成成谭广销刘革修
曾 葭,陈小宇,祝爱珍,刘成成,谭广销,刘革修△
(1解放军第411医院呼吸内科,上海 200081;2暨南大学医学院血液病研究所,广东 广州 510632)
以铂类为基础的两药联合化疗方案和表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinases inhibitor,EGFR-TKI)是当前针对EGFR基因非突变或突变的晚期非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者首选治疗措施[1-3],但由于存在继发耐药与复发问题,延长患者生存期的作用有限[4-6]。如何克服耐药已成为目前研究热点之一[7-9]。最近研究发现一种名为盐霉素(salinomycin)的抗生素可以杀死肿瘤干细胞,克服耐药,其效力比普通抗癌药物泰克索(taxol)高100倍[10-13]。我们前期研究显示,盐霉素能诱导人肺腺癌耐顺铂细胞株A549/DDP凋亡[14]。本实验将进一步探讨盐霉素联合吉非替尼诱导人肺腺癌细胞株A549凋亡的协同作用,为盐霉素应用于肺腺癌治疗探索新的思路。
材料和方法
1 材料
人肺腺癌细胞株A549由本实验室保存。盐酸吉非替尼购自湖北老百姓药业有限公司,盐霉素和PI染料购自Sigma;RPMI-1640培养液和胎牛血清购自 Gibco;细胞内活性氧、caspase-3、caspase-8、caspase-9活性以及JC-1线粒体膜电位检测试剂盒购自碧云天生物技术有限公司;细胞色素C凋亡检测试剂盒为BioVision;Fluo-3AM购自Biotium;Epics XL型流式细胞仪为Beckman Coulter产品。
2 方法
2.1 细胞培养 以每瓶1×105细胞接种于75 cm2培养瓶,采用含10% 胎牛血清、1×105U/L青霉素及100 mg/L链霉素的 RPMI-1640培养液置于含5%CO2、饱和湿度、37℃孵箱中培养,2~3 d传代。当细胞生长至约70%融合度时用于实验。
2.2 MTT法检测细胞增殖活性 取对数生长期细胞以每孔180 μL(5×103细胞)接种于96孔板,细胞贴壁后,分别加入盐霉素(0.05、0.10、0.20、0.40、0.80、1.60 和 3.20 μmol/L)、吉非替尼(0.25、0.50、1.0、2.0、4.0、8.0 和 16.0 μmol/L)以及吉非替尼(0.50 μmol/L)联合不同浓度的盐霉素(0.05、0.10、0.20、0.40、0.80、1.60 和 3.20 μmol/L),进行药物干预,每个浓度设5个复孔。同时设空白对照组、仅含有DMSO的溶媒对照组。继续培养72 h后,每孔加入MTT(5 g/L)10 μL,37℃培养4 h后低速离心10 min吸弃上清液,每孔加入DMSO 150 μL,振荡15 min使沉淀充分溶解,用酶联免疫检测仪在波长490 nm处测定吸光度(A)值。细胞生长抑制率(%)=(实验组平均A值-空白组平均A值)/(对照组平均A值-空白组平均A值)×100%。采用直线回归方法计算药物的半数抑制浓度(half maximal inhibitory concentration,IC50)。实验重复3次。
2.3 计算盐霉素和吉非替尼的联合作用效果 根据中效原理,采用Chou-Talalay联用指数法判定2种药物的联合作用。按中效方程式计算出不同抑制率时两药的单用和联用浓度,公式如下:D=Dm[fa/(1-fa)]1/m;式中D为药物浓度,Dm为中效浓度,fa为细胞生长抑制率,m为斜率。2种药物的联用指数(combination index,CI)的计算公式如下:CI=(D)1/(Dx)1+(D)2/(Dx)2+a(D)1(D)2/(Dx)1(Dx)2;其中(Dx)1和(Dx)2分别为2种药物单用时产生某一效应值fa时的浓度,(D)1和(D)2则是2种药物联用时产生相同效应fa时各自所需要的浓度。当2种药物的相互作用为非排斥性时,a=1;当2种药物的相互作用为排斥性时,a=0。求出CI值,如果CI<1,认为两药物联用为协同作用;如果CI=1,认为两药联用为相加作用;如果CI>1,则认为两药联用为拮抗作用。
2.4 Annexin V-PI双染测定细胞凋亡 取对数生长的A549细胞,每孔2×105个细胞接种至6孔板内,设(0.2 μmol/L)盐霉素处理组、盐霉素(0.2 μmol/L)与吉非替尼(0.50 μmol/L)联合处理组、单纯吉非替尼(0.50 μmol/L)组,以及DMSO对照组,作用48 h后,消化收集细胞,PBS洗涤,弃上清,加入200 μL试剂盒提供的结合缓冲液,重悬细胞后,分别加入 10 μL Annexin V-FITC 和 5 μL PI,轻轻混匀,4℃避光反应30 min,再加入300 μL结合缓冲液,上机检测。
2.5 线粒体膜电位、活性氧和胞质Ca2+释放的检测取对数生长期的A549细胞,以2×105cells/well接种至12孔板,设有上述4组,在6、12、24 h时收集细胞,PBS洗涤2遍。500 μL JC-1(10 mg/L)重悬细胞检测线粒体膜电位,500 μL DCFH-DA(5 μmol/L)重悬细胞检测细胞内活性氧,10 μmol/L荧光染料Fluo-3AM检测细胞内Ca2+浓度,37℃避光孵育20 min,PBS洗3次,即刻用流式细胞仪检测,激发波长为488 nm,发射波长为530 nm。
2.6 Caspase-3、caspase-8和caspase-9活性检测取对数生长期的A549细胞,以2×105cells/well的密度接种至6孔板,设有上述4组,分别处理6、12、24 h,按照试剂盒说明收集细胞,预冷PBS洗涤后重悬于细胞裂解液中,冰上裂解30 min,4℃下10000×g离心10 min,取上清加入显色底物(caspase-3底物Ac-DEVD-pNA,caspase-8底物Ac-IETD-pNA,caspase-9 底物 Ac-LEHD-pNA),终浓度50 μL/L,均匀混合并加入到96孔板中,每组5个复孔,避光孵育4 h,酶标仪在波张405 nm处检测吸光度(A)值。
2.7 Western blotting检测 处理48 h后,收集并PBS洗2遍,加入蛋白抽提液抽提总蛋白;细胞色素C测定是按试剂盒抽提胞浆及线粒体蛋白。BCA蛋白浓度测定试剂测定蛋白浓度,取蛋白50 μg,经10%SDS-PAGE电泳分离,常规转移至PVDF膜,用含5%脱脂牛奶的TBST封闭液(20 mmol/L Tris pH 7.6,0.1%Tween 20)封闭过夜。兔抗Akt抗体(H-136)、鼠抗人细胞色素 C、Bcl-2抗体(Santa Cruz)、p-EGFR、p-Akt和 p-ERK 抗体 (Cell Signaling Technology)或GAPDH(Chemicon International)4℃孵育过夜,1∶2000稀释的HRP标记的Ⅱ抗室温孵育1 h,用TBST洗3次,ECL显色液显色。目的条带用Image-Pro Plus分析软件进行灰度值分析,以β-actin为内参照校正。
3 统计学处理
结 果
1 盐霉素与吉非替尼对A549细胞增殖的抑制作用
盐霉素与吉非替尼分别以不同浓度单独作用于A549细胞72 h,均显示抑制增殖作用,且在一定浓度范围内呈浓度依赖性,见图1,与对照组比较差异有统计学意义(P<0.05)。盐霉素的IC50值为(0.47±0.07)μmol/L,而吉非替尼的 IC50值为(2.93 ±0.13)μmol/L。根据合用指数计算公式,计算出吉非替尼和盐霉素合用在不同效应(0.90、0.80、0.75、0.70、0.65、0.60、0.50 和 0.40)时的 CI分别为 0.473、0.482、0.545、0.667、0.741、0.864、0.938 和 0.949即当 fa 为 0.90、0.80、0.75、0.65、0.60、0.50 和 0.40时两药合用为协同作用。
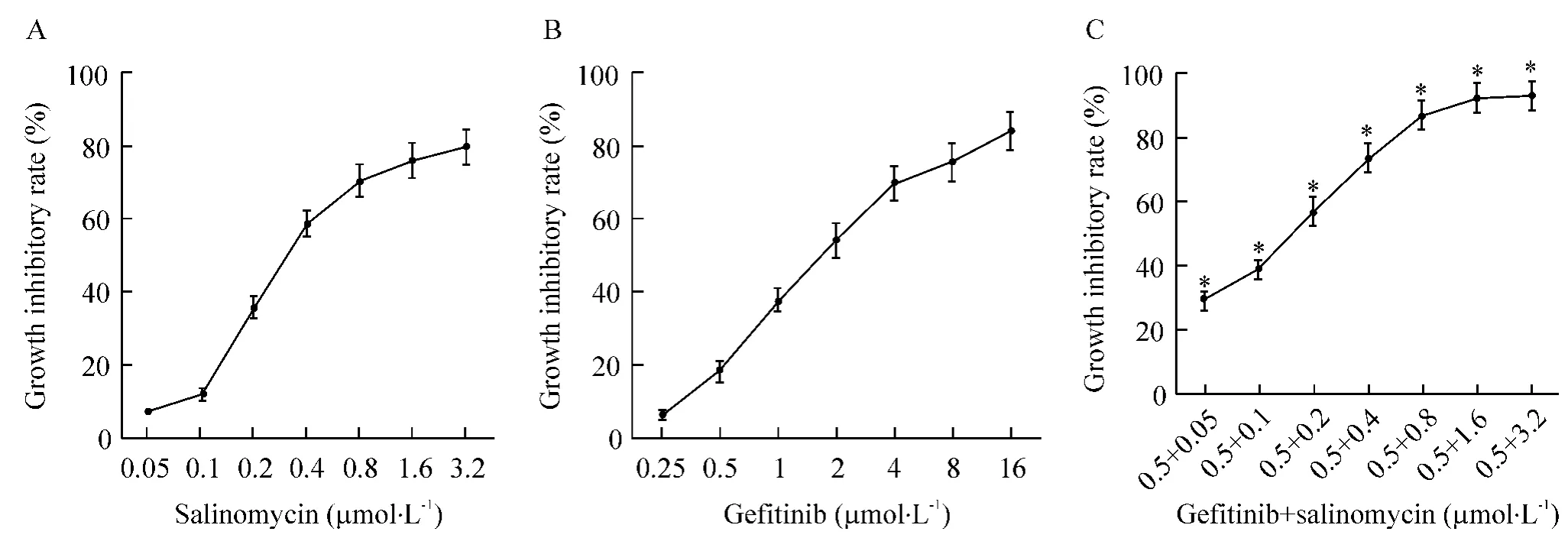
Figure1.Growth inhibitory rates of A549 cells treated with salinomycin and gefitinib at different concentrations,alone or in combination.A:salinomycin;B:gefitinib;C:salinomycin and gefitinib..n=5.*P<0.05 vs salinomycin alone at corresponding concentration.图1 不同浓度盐霉素与吉非替尼单用或合用对A549细胞的生长抑制率
2 盐霉素与吉非替尼单独或联合作用对A549细胞凋亡的影响
盐霉素(0.2 μmol/L)或吉非替尼(0.50 μmol/L)分别单独作用A549细胞72 h后,细胞凋亡率分别为(11.81±2.27)%和(8.53±2.24)%,显著高于DMSO对照组(4.85±2.21)%,P<0.05;而盐霉素(0.2 μmol/L)和吉非替尼(0.50 μmol/L)联合作用A549细胞的凋亡率为(26.74±3.59)%,高于单独用药组,差异有统计学意义(P<0.05),见图2。由此可见,联合应用盐霉素可增强吉非替尼诱导A549细胞凋亡的作用。

Figure2.f Effects of salinomycin and gefitinib,alone or in combination,on apoptosis of A549 cells.图2 盐霉素与吉非替尼单独或联合作用对A549细胞凋亡的影响
3 盐霉素与吉非替尼单独或联合作用对A549细胞线粒体膜电位、活性氧和细胞内Ca2+的影响
0.2μmol/L的盐霉素作用于A549细胞之后,线粒体膜电位在6 h时已显著下降,24 h时下降至最低,为对照组的(35.1±3.6)%;细胞内活性氧在6 h时已显著升高,24 h时仍然高于对照组水平(130.3±5.5)%;细胞内Ca2+在6 h时已显著升高,为对照组的(152.7±5.5)%,24 h时下降至接近对照组水平。0.5 μmoL/L吉非替尼单独作用对A549细胞线粒体膜电位、活性氧和细胞内Ca2+没有影响。盐霉素与吉非替尼联合作用则可进一步改变A549细胞线粒体膜电位、活性氧和细胞内Ca2+,差异有统计学意义(P <0.01),见图3、表1。

Figure3.Effects of salinomycin(Sal)and gefitinib(Gef),alone or in combination,on mitochondria membrane potential in A549 cells.图3 盐霉素与吉非替尼单独或联合作用对A549细胞线粒体膜电位的影响
表1 盐霉素与吉非替尼单独或联合作用对A549细胞线粒体膜电位、活性氧和细胞内Ca2+的影响Table1.Effects of salinomycin(Sal)and gefitinib(Gef),alone or in combination,on mitochondrial membrane potential(MMP),ROS and Ca2+in A549 cells(%..n=5)

表1 盐霉素与吉非替尼单独或联合作用对A549细胞线粒体膜电位、活性氧和细胞内Ca2+的影响Table1.Effects of salinomycin(Sal)and gefitinib(Gef),alone or in combination,on mitochondrial membrane potential(MMP),ROS and Ca2+in A549 cells(%..n=5)
** P <0.01 vs Sal;△△P <0.01 vs Gef.
2+MMP ROS Ca 6 h 12 h 24 h 6 h 12 h 24 h 6 h 12 h 24 h Sal 84.2±5.9 58.3±4.6 32.7±3.9 150.8±5.9 134.5±5.7 127.5±5.6 155.2±5.6 101.8±5.7 99.8±5 Group.7 Sal+gef 74.9±6.0**△△ 46.8±4.5**△△ 21.8±3.9**△△153.0±5.9**△△131.8±5.7**△△116.1±5.6**△△150.3±5.6△△ 99.4±5.7△△ 99.6±5.7△△Gef 100.8±5.8 98.9±5.8 101.2±5.8 99.8±5.5 99.6±5.5 100.9±5.5 100.1±5.5 99.4±5.5 101.4±5.5
4 盐霉素与吉非替尼单独或联合作用对A549细胞caspase-3、caspase-8和 caspase-9活性的影响
0.2μmol/L盐霉素处理A549细胞后,随着时间的增加,caspase-3、caspase-8和caspase-9活性增加,呈时间-效应关系,与对照组比较,差异有统计学意义(P<0.01),见表2。这一结果表明,caspase-3、caspase-8和caspase-9参与了盐霉素诱导的凋亡途径。
表2 盐霉素与吉非替尼单用或合用对A549细胞caspase-3、caspase-8和caspase-9活性的影响Table2.Effects of salinomycin(Sal)and gefitinib(Gef),alone or in combination,on the activity of caspase-3,caspase-8 and caspase-9 in A549 cells(%..n=5)

表2 盐霉素与吉非替尼单用或合用对A549细胞caspase-3、caspase-8和caspase-9活性的影响Table2.Effects of salinomycin(Sal)and gefitinib(Gef),alone or in combination,on the activity of caspase-3,caspase-8 and caspase-9 in A549 cells(%..n=5)
**P <0.01 vs Sal;△△P <0.01 vs Gef.
GroupCaspase-3 Caspase-8 Caspase-96 h 12 h 24 h 6 h 12 h 24 h 6 h 12 h 24 h Sal 115.3±5.1 128.7±5.2 134.8±5.2 156.9±5.8 161.6±5.8 159.4±5.8 137.5±5.4 148.0±5.4 152.9±5.4 Sal+Gef 126.0±5.2**△△ 155.1±5.2**△△ 167.4±5.2**△△ 164.3±5.8**△△ 180.2±5.8**△△ 174.1±5.8**△△ 156.8±5.4**△△ 165.6±5.4**△△ 176.7±5.4**△△Gef 102.7±5.1 118.5±5.1 121.8±5.1 110.7±5.7 119.8±5.7 109.6±5.7 108.3±5.3 118.5±5.3 120.8±5.3
5 盐霉素与吉非替尼单独或联合作用对A549细胞Bcl-2、细胞色素 C、p-EGFR、p-Akt和 p-ERK蛋白水平影响
盐霉素(0.2 μmol/L)单独作用A549细胞,虽然对EGFR、Akt和ERK总蛋白水平无显著影响,但是Bcl-2表达下调,而且胞浆细胞色素C显著增加,p-EGFR、p-Akt和p-ERK蛋白水平也显著下降;吉非替尼(0.50 μmol/L)单独作用,不仅Bcl-2表达下调,而且p-EGFR、p-Akt和p-ERK蛋白水平下降更明显,胞浆细胞色素C增加量少;盐霉素与吉非替尼联合作用,则Bcl-2、p-EGFR、p-Akt和 p-ERK 蛋白水平进一步下降,而且胞浆细胞色素C上升更高,见图4。这一结果说明联合应用盐霉素可通过多种途径增强吉非替尼诱导A549细胞凋亡的作用。
讨 论
本研究结果显示,盐霉素或者吉非替尼单用虽然均显示对A549细胞有不同程度的增殖抑制作用和诱导细胞凋亡作用,但它们联用则显示了更强的协同作用,盐霉素提高吉非替尼诱导A549细胞凋亡作用。该协同作用与盐霉素和吉非替尼各自药理特性有关。盐霉素属于聚醚类一元羧酸,由白色链霉菌发酵产生,具有特殊的环状结构,是典型的离子载体抗生素,它对细胞中的阳离子,尤其是K+、Na+和Rb+的亲和力特别强,使生物所必需的阳离子通过膜上脂质屏障的浸透性增强,妨碍细胞内外阳离子的传递,使细胞内外离子浓度发生变化,从而影响细胞内生命活动,可以诱导氧化应激和线粒体凋亡途径[15-17]。本研究显示盐霉素能增加细胞内活性氧,降低线粒体膜电位,促进线粒体细胞色素C释放,使caspase-3、-8和-9酶激活,诱导细胞凋亡,与我们前期研究结果一致[14]。吉非替尼属于小分子的EGFR酪氨酸激酶抑制剂,其通过竞争性地与EGFR酪氨酸激酶催化区域中的Mg-ATP位点结合,抑制酪氨酸激酶磷酸化,阻断EGFR的信号转导通路,从而抑制细胞周期进程,加速细胞凋亡[18-22]。EGFR属于Ⅰ型生长因子家族,具有酪氨酸激酶活性,可通过下游多种信号通路调节细胞活性,如有促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/ERK、PI3K/Akt及 Janus激酶/信号转导子与转录激活子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)信号通路等。许多研究证实EGFR信号通路参与了肿瘤细胞浸润、血管生成、细胞增殖和凋亡抵抗等。本研究显示,吉非替尼单用则主要通过抑制p-EGFR、p-Akt和p-ERK蛋白表达,抑制细胞增殖,诱导凋亡,而对胞浆细胞色素C、caspase-3、-8和-9酶活性影响较少。所以,盐霉素与吉非替尼合用具有协同作用。这与2种药物在作用机理上具有互补作用密切相关。该结果为改善肺腺癌临床治疗方法提供新的依据。但如何应用盐霉素于肺腺癌临床治疗还有待进一步研究。

Figure4.Effects of salinomycin(Sal)and gefitinib(Gef),alone or in combination,on the protein levels of Bcl-2,cytochrome C,p-EGFR,p-Akt,p-ERK,EGFR,Akt and ERK in A549 cells.Con:control..n=5.*P<0.05 vs Con.图4 盐霉素与吉非替尼单独或联合作用对A549细胞中Bcl-2、cytochrome C、p-EGFR、p-Akt、p-ERK、EGFR、Akt和ERK蛋白水平的影响
[1]Goldstraw P,Ball D,Jett JR,et al.Non-small-cell lung cancer[J].Lancet,2011,378(9804):1727-1740.
[2]Van Schil PE,Hendriks JM,Hertoghs M,et al.Current surgical treatment of non-small-cell lung cancer[J].Expert Rev Anticancer Ther,2011,11(10):1577-1585.
[3]Pennell NA.Integration of EGFR inhibitors and conventional chemotherapy in the treatment of non-small-cell lung cancer[J].Clin Lung Cancer,2011,12(6):350-359.
[4]Stella GM,Luisetti M,Inghilleri S,et al.Targeting EGFR in non-small-cell lung cancer:lessons,experiences,strategies[J].Respir Med,2012,106(2):173-183.
[5]Cataldo VD,Gibbons DL,Pérez-Soler R,et al.Treatment of non-small-cell lung cancer with erlotinib or gefitinib[J].N Engl J Med,2011,364(10):947-955.
[6]Gridelli C,De Marinis F,Di Maio M,et al.Gefitinib as first-line treatment for patients with advanced non-small-cell lung cancer with activating epidermal growth factor receptor mutation:Review of the evidence[J].Lung Cancer,2011,71(3):249-257.
[7]Liu S,Wang D,Chen B,et al.The safety and efficacy of EGFR TKIs monotherapy versus single-agent chemotherapy using third-generation cytotoxics as the first-line treatment for patients with advanced non-small cell lung cancer and poor performance status [J].Lung Cancer,2011,73(2):203-210.
[8]Kosaka T,Yamaki E,Mogi A,et al.Mechanisms of resistance to EGFR TKIs and development of a new generation of drugs in non-small-cell lung cancer[J].J Biomed Biotechnol,2011,2011:165214.
[9]Lin CC,Yang JC.Optimal management of patients with non-small cell lung cancer and epidermal growth factor receptor mutations[J].Drugs,2011,71(1):79-88.
[10]Gupta PB,Onder TT,Jiang G,et al.Identification of selective inhibitors of cancer stem cells by high-throughput screening[J].Cell,2009,138(4):645-659.
[11]Fuchs D,Heinold A,Opelz G,et al.Salinomycin induces apoptosis and overcomes apoptosis resistance in human cancer cells[J].Biochem Biophys Res Commun,2009,390(3):743-749.
[12]Riccioni R,Dupuis ML,Bernabei M,et al.The cancer stem cell selective inhibitor salinomycin is a p-glycoprotein inhibitor[J].Blood Cells Mol Dis,2010,45(1):86-92.
[13]Zhi QM,Chen XH,Ji J,et al.Salinomycin can effectively kill ALDHhighstem-like cells on gastric cancer[J].Biomed Pharmacother,2011,65(7):509-515.
[14]曾 葭,刘成成,祝爱珍,等.盐霉素抑制人肺腺癌耐顺铂细胞株A549/DDP增殖及诱导凋亡的机制[J].中国病理生理杂志,2012,28(5):834-838.
[15]Kim JH,Yoo HI,Kang HS,et al.Salinomycin sensitizes antimitotic drugs-treated cancer cells by increasing apoptosis via the prevention of G2 arrest[J].Biochem Biophys Res Commun,2012,418(1):98-103.
[16]Ketola K,Hilvo M,Hyötyläinen T,et al.Salinomycin inhibits prostate cancer growth and migration via induction of oxidative stress[J].Br J Cancer,2012,106(1):99-106.
[17]Kim KY,Yu SN,Lee SY,et al.Salinomycin-induced apoptosis of human prostate cancer cells due to accumulated reactive oxygen species and mitochondrial membrane depolarization[J].Biochem Biophys Res Commun,2011,413(1):80-86.
[18]Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl J Med,2004,350(21):2129-2139.
[19]Paez JG,Jänne PA,Lee JC,et al.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304(5676):1497-1500.
[20]Kancha RK,von Bubnoff N,Peschel C,et al.Functional analysis of epidermal growth factor receptor(EGFR)mutations and potential implications for EGFR targeted therapy[J].Clin Cancer Res,2009,15(2):460-467.
[21]Tiseo M,Rossi G,Capelletti M,et al.Predictors of gefitinib outcomes in advanced non-small cell lung cancer(NSCLC):study of a comprehensive panel of molecular markers[J].Lung Cancer,2010,67(3):355-360.
[22]Chang MH,Ahn HK,Lee J,et al.Clinical impact of amphiregulin expression in patients with epidermal growth factor receptor(EGFR)wild-type nonsmall cell lung cancer treated with EGFR-tyrosine kinase inhibitors[J].Cancer,2011,117(1):143-151.
