木质素相关合成酶在甘蓝型黄、黑籽油菜中的表达差异
2012-08-01冉秀芝李加纳柴友荣
冉秀芝,雷 波,梁 颖,李加纳,李 波,柴友荣
(1.重庆理工大学化学化工学院,重庆 400054;2.贵州省烟草科学研究所,贵阳 550081;3.重庆市油菜工程研究中心,重庆 400716;4.重庆市公安局,重庆 401147)
木质素是自然界中的第二大聚合物,是由多种简单的苯丙烷及其衍生物经聚合形成的复杂的聚合物[1]。在木质素生物合成中有许多酶参与,其中:对 - 香豆酸连接酶(E.C.6.2.1.12,p-coumarate-CoA ligase,4CL)是苯丙烷代谢总途径的最后一个酶,可为大量天然化合物的合成提供前体物质(包括木质素);5-羟基阿魏酸羟化酶(EC None,ferulate 5-hydroxylase,F5H)是一种 P450 依赖的单加氧酶,是S-木质素合成中的必须环节;松柏醇脱氢酶 (E.C.1.1.1.195,cinnamyl-alcohol dehydrogenase dehydrogenase,CAD)是合成木质醇的最后一步反应的酶,其功能是将CCR的还原产物再还原为相应的松柏醇,为木质素的聚合提供相应的、直接的前体物质。
有关木质素生物合成的酶学研究表明,在木质素的生物合成途径中,4CL、F5H、CAD都是关键酶之一[2-3]。前期有关木质素甘蓝型黄、黑籽油菜种皮木质素及相关酶的比较研究表明,在甘蓝型黄、黑籽油菜的种皮中都可能存在木质素生物合成的苯丙烷代谢途径,4CL、CAD和F5H均参与了该代谢途径[4]。为了深入分析甘蓝型黄籽油菜种皮中木质素含量差异形成的分子生物学机制,本研究以1对甘蓝型黄、黑籽油菜的近等基因系为材料,研究了木质素生物合成部分关键酶4CL、F5H和CAD在黄、黑籽油菜的不同组织中的表达差异,为油菜的分子育种和优质育种提供重要的理论依据。
1 实验材料与方法
1.1 实验材料与流程
1)植物材料:1对甘蓝型黄、黑籽油菜近等基因系(黄籽:L2,黑籽:L1),来源于甘蓝型黑籽油菜×芥菜型黄籽油菜的后代。
2)实验技术路线:取供试材料的花、蕾和不同发育时间的种子为材料,先抽提RNA,再经反转录得到cDNA,进行表达差异的研究,其流程如图1所示。

图1 甘蓝型黄、黑籽油菜种皮的木质生物合成酶表达研究流程
1.2 cDNA的获得
1)RNA的抽提。使用上海华舜生物工程有限公司的小量植物 (叶)总 RNA抽提试剂盒(W6771)。苯酚/氯仿标准裂解步骤:① 液氮冷冻条件下将植物叶捣碎成粉末,待液氮自然挥发后,加入1 mL RD液,立即用移液器抽打5次以悬浮样品,将匀浆液移入1.5 mL离心管中,盖上盖子,高速振荡2 min;② 室温静置 5 min后,加入200 μL氯仿,用力颠倒离心管混匀,室温静置使之分层,15 000 r/min离心5 min,小心地移取水相至1.5 mL离心管中;③加入一半体积的75% 乙醇,彻底混匀后,全部移入吸附柱,离心30 s,倒掉收集管中的液体,将吸附柱移入同一个收集管中;④加入500 μL RP液,离心30 s,将吸附柱移入另外一个干净的收集管中;⑤ 加入 500 μL W3液,静置1 min后,离心15 s,弃收集管中的液体,将吸附柱移入同一个收集管中;⑥ 加入 500 μL W3液,离心15 s;⑦倒掉收集管中的液体,将吸附柱移入同一个收集管中,离心1 min;⑧ 将吸附柱放入另外一个干净的1.5 mL离心管中,在吸附膜中央加入50 μL纯水,室温静置1 min后,离心 1 min,将1.5 mL离心管(RNA)贮存于-70℃待用。
2)去除RNA中的基因组DNA。①在微量离心管中配制下列反应液(含量50 mL):总RNA 20 ~50 μg,10 × DNaseⅠ Buffer 5 μL,DNaseⅠ(RNase-free,5 U/μL)2 μL,RNase Inhaibitor(40 U/μL)0.5 μL,用 DEPC H2O 补加至 50 mL;②37℃反应 20 ~30 min,加入 50 μL DEPC H2O;③加入 100 μL(等量)苯酚/氯仿/异戊醇(5∶24∶1),充分混匀;④ 离心,取上层(水层)移至另一微量离心管中,加入100 μL(等量)苯酚/氯仿/异戊醇(5∶24∶1),充分混匀;⑤ 离心,取上层(水层)移至另一微量离心管中,加入10 μL(1/10量)的3M NaOAc(pH值为5.2);⑥ 加入250 μL(2.5倍量)的冷无水乙醇,-20℃放置30~60 min;⑦ 离心,回收沉淀,用70%的冷乙醇清洗沉淀,真空干燥;⑧用适量的DEPC H2O溶解后,进行Agarose检测电泳以确认是否除去基因组DNA。
3)反转录合成cDNA第1链(20 μl反应体系)。使用Invitrogen公司的SuperScriptTMII RTPCR 试剂盒(适用于10 pg~5 μg总 RNA),具体操作步骤:①在灭菌的小离心管中加入以下几种成分:50 ng/μL 随机引物 1 μL,总 RNA 5 μg,pH值为7.0的10 mM dNTP混合物1 mL,用无菌的蒸馏水补充至13 mL;② 在65℃温育5 min,然后冰浴至少1 min;③用另一只灭菌的试管将以下各成分按照顺序加入:5×First-strand Buffer 4 mL,0.1M DTT 1mL,RNaseOUTTMRecombinant RNase Inhibitor(Cat.no.10777 - 019,40 U/μL)1 mL,SuperScriptTMⅢ RT(200 U/μL)1 mL(以上是1个样品的量,如果有多个样品的话,应该加倍),然后小心地充分混匀,离心;④ 在各反应管中加入上述混合液,25℃温育5 min;⑤ 在50℃反应60 min;⑥ 用70℃下15 min后中止反应,然后在冰上冷却;⑦ 离心收集反应混合物,放置在-20℃ 备用。
1.3 引物的设计
F4CLC5'-TACATCCCTAACCACCTCCCTCTC-3'(24nt,Mw=7150.7,Tm=66.28,对应于 At4CL1 gene(AF106084)的185~208bp);
R4CLC5'-TCTAGCTCAGCTGGAGCCACCTG-3'(23nt,Mw=7062.6,Tm=68.12,互补于 At4CL1 gene(AF106084)的1509~1487bp)。
2)CAD基因引物。根据AtCAD5和AtCAD4基因的公共保守区设计十字花科CAD基因家族总体表达检测引物(引物不跨内含子),其序列如下:
FCAD545'-GTGGGATCAGATGTGAGCAAGTTC-3'(24nt,Mw=7534.9,Tm=64.57,对应于 At-CAD5 mRNA(AY302082)的232~255bp);
RCAD545'-ACCGCCATTCCTTCTGGAATCTT-3'(23nt,Mw=6987.6,Tm=62.77,互补于 AtCAD5 mRNA(AY302082)的464~442bp)。
3)十字花科F5H基因引物。根据已报道的甘蓝型油菜F5H基因家族3个成员cDNA的保守区设计甘蓝型油菜F5H基因家族总体表达检测引物(引物不跨内含子),其序列如下:
FBNF5HC5'-GACTTATGACCGAGCCGACATG-3'(22nt,Mw=6806.5,Tm=64.54,对 应 于BNF5H1 mRNA(AF214007)的386~407bp);
(2)锚索、锚杆设计岩土工程参数参考值。根据《建筑边坡工程技术规范》(GB 50330—2002)推荐值并结合实际综合考虑,推荐砂浆与螺纹钢筋的粘结强度为2 000 kPa,砂浆与钢绞线的粘结强度为2 500 kPa,砂浆与片麻岩的粘结强度为1 000 kPa。
RBNF5HC5'-CTTGGGAACGAAGTAACCGTCG-3'(22nt,Mw=6846.5,Tm=64.54,互补于BNF5H1 mRNA(AF214007)的1250~1229bp)。
以上引物的合成均由上海生工完成。
1.4 PCR反应体系及条件
1)PCR扩增体系。采用50 μL的扩增体系,按照实验的需要加入对应的模板,且每个基因采用相应的引物和反应参数,PCR反应体系如表1所示。

表1 PCR反应体系
2)各个基因的PCR反应参数。① 4CL的PCR反应参数:94℃,2 min→(94℃,1 min→53℃,30 s→72℃,1 min)×30 →72℃,10 min →16℃,holding;即94℃预变性2 min,随后以94℃变性1 min、53℃退火30 s、72℃延伸1 min的条件进行30个循环的扩增,最后在72℃保温10 min,以1%的琼脂糖凝胶电泳检测。②CAD的PCR反应参数:94℃,2 min→(94℃,1 min →53℃,30 s →72℃,30 s)×30 →72℃,10 min →16℃,holding;即94℃预变性2 min,随后以94℃变性1 min、53℃退火30 s、72℃延伸30 s的条件进行30个循环的扩增,最后在72℃保温10min,以2%的琼脂糖凝胶进行电泳检测。③ F5H的 PCR反应参数:94℃,2 min→(94℃,1 min →61℃,1 min →72℃,1.5 min)×30 →72℃,10 min →16℃,holding;即94℃预变性2 min,随后以94℃变性1 min、61℃退火1 min、72℃延伸1.5 min的条件进行30个循环的扩增,最后在72℃保温10 min,以1%的琼脂糖凝胶电泳检测。
2 结果与讨论
2.1 4CL的表达差异
以cDNA为模版扩增的4CL的片段长度约为1 200 bp,与预期长度一致,4CL在甘蓝型油菜中的表达如图2所示。

图2 4CL在甘蓝型油菜中的表达
如图2所示,在甘蓝型黄籽油菜中,4CL在蕾期和10 d种中的表达最强,在花和20 d种的表达次之,而在30 d种中的表达最弱;在甘蓝型黑籽油菜中,4CL在10 d和30 d的种子中的表达最强,在蕾、花和中种的表达较弱,几乎为前两者的1/2。4CL在甘蓝型黄、黑籽油菜的上述各器官中的表达差异来看,在花和中种的表达差异不明显;在蕾、幼种和老种中的表达具有明显的差异,即在蕾期,黑籽中4CL的表达比黄籽弱,而在幼种和老种时期,黑籽中4CL的表达比黄籽强。另外,在种子的发育进程中:4CL的表达在甘蓝型黄籽油菜中逐渐降低,且在老种时期的表达迅速下降;4CL在甘蓝型黑籽油菜种子中的表达量却先减少后增加。因此,在种子的发育进程中,在甘蓝型黄、黑籽油菜之间4CL的转录水平差异明显。
在模式植物——拟南芥的4CL的3个基因家族成员中:At4CL1和At4CL2属于Ⅰ类,主要参与木质素和其他酚类化合物的合成;At4CL3属于Ⅱ类,主要参与黄酮类化合物的合成。同时,在拟南芥中3种同工酶基因在植物的不同器官的表达都有差异[5]。在本研究中,4CL在甘蓝型黄、黑籽油菜中的不同器官或组织中的表达存在差异,与前人的研究结果一致。同时,本研究还发现在不同种皮颜色的甘蓝型油菜品系间,4CL在同一器官中的表达也存在差异。
Jürgen 等[6]研 究 了 拟 南 芥 的 At4CL1 和At4CL2两种同工酶对底物的亲和性,结果发现:2种酶均能催化肉桂酸发生反应,但只有4CL1才能催化阿魏酸发生反应;而4CL2的主要功能是在4CL1反应的下游起清除阿魏酸的作用。
前期有关木质素含量与4CL活性关系的研究表明:在种子的发育进程中,其活力在甘蓝型黄、黑籽油菜中呈极显著差异;同时,木质素含量在甘蓝型黄、黑籽油菜中与4CL活力的相关性分别达到极显著水平和显著水平[4]。本研究的结果表明:在种子的发育进程中,4CL在甘蓝型黄、黑籽油菜之间在转录水平上存在差异,特别是在30d的种子中,黑籽油菜中的4CL表达比在黄籽油菜中强许多倍(图2)。因此,4CL参与了油菜的种皮形成过程中木质素的生物合成,且转录水平的不同可能引起木质素含量在黄、黑籽油菜之间的差异。
2.2 F5H的表达差异
F5H在甘蓝型黄、黑籽油菜中的表达实验结果如图3所示。以cDNA为模版扩增的F5H的片段长度约为800 bp,与预期长度一致。在甘蓝型黄、黑籽油菜之间,F5H在花、蕾和10 d和20 d的种子在转录水平上差异不明显,而在30 d种中的差异却十分明显,黑籽中的表达量是黄籽中的5倍以上。同时,F5H在种子中的表达明显低于在花期和蕾期。在种子的发育进程中,F5H的表达在甘蓝型黑籽油菜中逐渐增强,而在甘蓝型黄籽油菜中的表达先增强后减弱,这样,使得F5H在黑籽油菜和黄籽油菜的30 d种中的表达量的差异十分明显。因此,在种子的发育进程中,在甘蓝型黄、黑油菜之间,F5H的转录水平差异明显(图3)。

图3 F5H在甘蓝型油菜中的表达
Ramesh Nair等[7](2000)从加拿大的栽培的甘蓝型油菜中分离到3个 F5H的基因,即BNF5H1、BNF5H2和BNF5H3,而从白菜型油菜和甘蓝栽培品种的二倍体(这2种二倍体融合后得到多倍体甘蓝型油菜)中分别分离得到了BNF5H1和BNF5H2,同时都分离到了BNF5H3。这3个基因的编码区有90%的一致性,其中BNF5H1与BNF5H2的一致性更高。其研究结果表明:F5H在甘蓝型油菜的茎中表达量最多,而在其种子中的表达量最少,3个基因在叶、根、蕾、花、荚果等其他组织或器官中表达量的差异很微小。
前期有关木质素含量与F5H活性关系的研究结果表明,在种子的发育进程中,F5H活力在甘蓝型黑籽油菜中的活力极显著高于甘蓝型黄籽油菜;同时,木质素含量在甘蓝型黄、黑籽油菜中与F5H活力的相关性均达到极显著水平[4]。本研究结果表明:F5H在甘蓝型油菜的花、蕾中的表达比种子中的表达强,这与前人的研究结果一致[7];F5H在甘蓝型黄、黑籽油菜种子中的表达量的不同,可能造成甘蓝型黄、黑籽油菜种子中芥子酸含量的不同,从而导致其转化的芥子酰胆碱的含量也不同,进而可能引起S-木质素含量的不同,导致G/S比率下降。根据前人的研究和本试验的研究,可以推断F5H在合成S-木质素的途径中是必不可少的一种酶,因而要改变木质素的G/S比率,可以对F5H采取分子生物学的操作,培育生产上需要的甘蓝型油菜的新品种。
2.3 CAD的表达差异
CAD在甘蓝型黄、黑籽油菜的花、蕾和不同成熟度的种子中的表达研究结果表明:以cDNA为模版扩增的CAD片段长度约为250 bp,与预期长度一致,如图4所示。
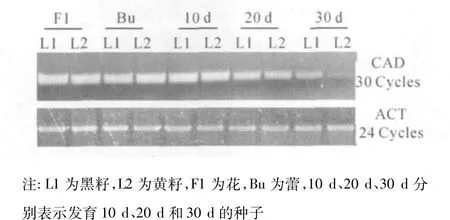
图4 CAD在甘蓝型油菜中的表达
在黄、黑籽油菜之间,CAD的表达在花和蕾期的差异不明显。而在不同种子的发育时期,CAD的表达差异明显。在10 d、20 d和30 d种中,黑籽中的表达量分别是黄籽的1.3倍、1.6倍和2.0倍以上;同时,在蕾、花期中的表达比种子的不同时期的强。在种子的发育进程中,CAD在甘蓝型黄、黑籽油菜中的表达都是逐渐减弱,但在黑籽油菜中,这种减弱的趋势比黄籽油菜要慢些,所以,在30 d种中,CAD在黄籽油菜中比在黑籽油菜中的表达弱得多(图4)。因此,在种子的发育进程中,在转录水平上,CAD在甘蓝型黄、黑油菜之间也存在差异。
在模式植物拟南芥中,CAD被推定有9条CAD基因,分属于3类,其中:Ⅰ类的CAD6的突变会引起木质素含量和结构的改变;Ⅱ类的CAD3、CAD4和CAD5是白杨SAD最近的同系物,优先催化芥子醇和芥子醛,从而参与S-木质醇合成支路[8-10]。
前期有关木质素含量与CAD活性关系的研究结果表明:在种子的发育进程中,CAD活力在甘蓝型黑籽油菜中的活力极显著高于甘蓝型黄籽油菜;同时,木质素含量在甘蓝型黄、黑籽油菜中与CAD活力的相关性均达到极显著水平[4]。CAD表达差异的研究结果显示,在甘蓝型黄、黑籽油菜中,其表达量随油菜种子的成熟都逐渐减少,在黄籽油菜中,下降的幅度较黑籽油菜的大,因而在30 d种中的表达量具有显著的差异。因此,在种子的发育进程中,CAD在甘蓝型黄、黑籽油菜之间的转录水平上也存在差异,特别是在30 d种中,黑籽油菜中的CAD表达比在黄籽油菜中强许多倍(图4)。
3 结论与展望
自从梁艳丽等[11]报道在油菜种子发育过程中木质素是导致黄籽皮壳率低于黑籽的原因之一后,有关木质素导致种皮皮壳率低的原因鲜见报道。梁颖等[12]在研究甘蓝型油菜种皮颜色形成相关酶与蛋白质相关性时,推测PAL、PPO和POD可能调控木质素的合成,从而影响种皮厚度的形成。在前期L1和L2这对甘蓝型黄黑籽油菜种皮发育过程中木质素的含量与4CL、F5H和CAD三种酶活力之间呈显著或极显著关系[4]。本实验进一步研究了在转录水平上这3种酶在L1和L2之间的差异。实验结果表明:4CL在甘蓝型黄、黑籽油菜中的不同器官或组织中的表达存在差异,在相同的器官中,不同种皮颜色的甘蓝型油菜品种的4CL表达也存在差异;F5H在甘蓝型黄、黑籽油菜的花、蕾、10 d种、20 d种中的表达差异不明显,而在30 d种中的表达差异明显,在同一油菜品系的种子中的表达量明显低于花和蕾;CAD在甘蓝型黄、黑籽油菜的花、蕾中的表达差异不明显,而在种子的不同发育时期中表达差异明显,在相同的油菜品系中,在蕾和花期的表达比在种子的不同发育期强。4CL主要以阿魏酸和肉桂酸为其催化底物参与木质素的生物合成,而F5H对阿魏酸或松柏醛具有不同的亲和性,很有可能引起G-或S-木质素含量的不同,此外,CAD/SAD以松柏醛或芥子醛为底物参与G-或S-木质素的生物合成,因此,这几种酶在甘蓝型黄、黑籽油菜种子中的表达存在差异,特别是在甘蓝型黄籽油菜的30 d种中的表达都明显低于相应的黑籽油菜,说明它们很有可能是导致木质素含量和成分在甘蓝型黄、黑籽油菜之间存在差异的主要原因之一。
作为自然界中的第二大聚合物,木质素是植物细胞壁的重要组成成分之一,不仅对农业、工业、环境有着重要的影响,与人们的生活也息息相关,对植物体本身而言,也有重要的功能。在木质素的生物合成过程中有很多酶参与作用,不同酶系之间有可能存在相互作用,其个体和种群间的遗传变异和环境因素等都对木质素的含量有不同程度的影响[13]。因此,结合细胞生物学、生物化学、分子生物学等多学科的研究手段,从不同角度来研究不同遗传背景的油菜在不同组织、器官的木质素的生物合成,不仅对阐明油菜种皮特性形成的生理生化机理及木质素的生物合成机理具有重要的理论价值,并且还可以结合常规育种手段,通过对木质素生物合成中的酶基因进行操作,在不同组织或器官抑制或过量表达某1个或几个酶基因,可能培育出品质好而又具有多种抗性的油菜新品种。此外,利用分子生物学的方法来抑制或提高木质素合成酶基因的表达量,在减少造纸用材工艺的消耗,改善牧草品质,或是通过提高木质素含量来增强农作物、树木的机械强度等方面都具有重要的理论和实践意义。
[1]冉秀芝.木质素生物合成代谢中的酶学研究进展[J].中国农学通报,2009,25(3):23 -27.
[2]Baucher M,Monties B,Van Montagu M,et al.Biosynthesis and genetic engineering of lignin[J].Crit Rev Plant Sci,1998,17:125 -197.
[3]Boudet A M,Lapierre C,Grima-Pettenati J.Biochemistry and molecular biology of lignification[J].New Phytol,1995,129:203 -236.
[4]RAN Xiu-zhi,LIANG Ying,LI Jia-na.Analysis of the Lignin Contents and Related Enzymes activities in Seed coat between Black-seeded and Yellow-seeded Rapes(Brassica napus L.)[J].Agricultural Science in China,2005,4(12):890 -897.
[5]Ehlting J,Buttner D,Wang Q,et al.Three 4-coumarate coenzyme A ligases in Arabidopsis Thaliana represent two evolutionarily divergent classes in angiosperms[J].The Plant Journal,1999,19:9 -20.
[6]Jürgen Ehlting,Jane J K S,Carl J D.Identification of 4-coumarate:coenzyme A ligase(4CL)substrate recognition domains[J].The Plant Journal,2001,27(5):455-465.
[7]Ramesh B N,Richard W J,Eugen Kurylo,et al.Identification of a CYP84 Family of Cytochrome P450-Dependent Mono-Oxygenase Genes in Brassica napus and Perturbation of Their Expression for Engineering Sinapine Reduction in the Seeds[J].Plant Physiology,2000,123:1623 -1634.
[8]Jeroen R,Antje R,Jörgen H C,et al.Genome-Wide Characterization of the Lignification Toolbox in Arabidopsis[J].Plant Physiology,2003,133:1051 -1071.
[9]Sibout R,Eudes A,Pollet B,et al.Expression pattern of two paralogs encoding cinnamyl alcohol dehydrogenase in Arabidopsis.Isolation and characterization of the corresponding mutants[J].Plant Physiol,2003,132:848-860.
[10]Li L,Cheng X F,Leshkevich J,et al.The last step of syringyl monolignol biosynthesis in angiosperms is regulated by a novel gene encoding sinapyl alcohol dehydrogenase[J].Plant Cell,2001,13:1567 -1586.
[11]粱艳丽,梁颖,李加纳,等.甘蓝型黄、黑籽油菜种皮特性比较研究[J].中国油料作物学报,2002,24(4):14-18.
[12]Liang Y,Li J N.The relationship of color formation with related enzymes and protein contents in the seedcoat of oilseed rape(Brassica napus)[J].Agricultural Science in China,2004,5:384 -391.
[13]Marie B,Claire H,Michel P C.Lignin:Genetic Engineering and Impact on Pulping[J].Critical Reviews in Biochemistry and Molecular Biology,2003,38:305 -350.
