垃圾渗滤液厌氧降解中溶解性有机物的光谱特性
2012-08-01赵庆良夏小青
赵庆良 ,卜 琳,夏小青
(1. 哈尔滨工业大学市政环境工程学院,哈尔滨 150090;
2. 哈尔滨工业大学城市水资源和环境国家重点实验室,哈尔滨 150090)
垃圾渗滤液是一种成分复杂的高浓度有机废水,含有大量的难降解有机物和有毒物质.生物法因具有高效、廉价等特点在渗滤液处理中居于主导地位,尤其是厌氧法在高浓度渗滤液处理中应用广泛[1].厌氧序批式反应器(anaerobic sequencing batch reactor,ASBR)具有处理能力强、负荷高、节能且出水水质好等优点,其特殊的间歇操作方式在理论上能够获得比连续进水的普通厌氧活性污泥法更高效的生物絮凝(甚至颗粒化)和固液分离效果,近年来被广泛用于多种废水处理中[2-3].采用 ASBR能有效处理渗滤液,中温条件下化学需氧量(chemical oxygen demand,COD)去除率可达64%~85%[4].
由于不同物质水解速度的不同,在生物处理过程中形成不同程度的去除[5].渗滤液中有机物主要为溶解性有机物(dissolved organic matter,DOM)[6-7],其组成的复杂性和良好的溶解性使得在处理过程中较难被完全去除.一般说来,DOM 组分中除含有以腐殖酸、富里酸为主的腐殖质类物质外,还含有一些亲水性有机酸、氨基酸和碳水化合物等[8],其不同组分构成(如亲、疏水性物质,腐殖酸等)对于其他有毒物质(如内分泌干扰物、POPs、重金属等)的形成具有不同的作用[9],因此对 DOM 的特性分析显得尤为重要.目前对于渗滤液中 DOM 特性已展开部分研究,但主要集中于渗滤液 DOM 的组成特点及其随填埋时间的变化[10-11],对渗滤液处理工艺种类及其运行操作条件对DOM降解的影响缺少深入研究.
本研究采用 XAD系列树脂吸附技术将有机物分成 5种组分:疏水性有机酸(HPO-A)、疏水性有机中性物质(HPO-N)、过渡亲水性有机酸(TPI-A)、过渡性亲水性有机中性物质(TPI-N)和亲水性有机物(HPI),考察渗滤液在 ASBR降解过程中不同水力停留时间(hydraulic retention time,HRT)下出水有机物组成的差异,并依据各组分光谱特征来揭示有机物的降解特性,以期深入认识厌氧降解过程中DOM的去除规律,为合理、经济、有效地处理垃圾渗滤液提供了理论基础.
1 材料与方法
1.1 渗滤液水质及测定方法
垃圾渗滤液取自哈尔滨西南垃圾填埋场,其主要指标如下:化学需氧量(COD)为 6,240~15,200,mg/L;五日生化需氧量(5-day biochemical oxygen demand,BOD5)为 2,580~6,800,mg/L;总有机 碳(total organic carbon,TOC)为 2,160~5,380,mg/L;溶解性有机碳(dissolved organic carbon,DOC)为 1,930~5,060,mg/L;pH 值为 6.55~7.20;氨氮(NH4+-N)含量为876~1,350,mg/L.
根据标准方法[12]测定水样的 COD、BOD5和NH4+-N,用pHs-3C精密pH计测定pH值,采用日本SHMADZU的TOC-VCPH分析仪测定TOC和DOC.
1.2 厌氧反应及污泥驯化
试验采用哈尔滨文昌生活污水处理厂二沉池污泥进行接种,经厌氧驯化后反应器中混合液悬浮固体浓度(mixed liquor suspended solids,MLSS)为22.6,g/L,混合液挥发性悬浮固体浓度(mixed liquor volatile suspended solids,MLVSS)为 11.1,g/L,污泥沉降性能良好.取厌氧污泥和经0.45,µm滤膜过滤后的渗滤液(稀释为COD浓度1,250,mg/L)分别放入5个密封瓶中,维持污泥负荷为 0.57,g/g(COD /VSS),控制 HRT分别为 1,d、2,d、3,d、5,d和 7,d.试验采用中温消化,温度控制在(35±1),℃范围内.
1.3 DOM的分级方法
试验前采用改进索氏提取法清洗树脂柱[13].图1为有机物分级示意,其具体步骤如下所述.
(1)将水样用 0.45,µm 滤膜过滤后,用盐酸酸化至pH值为2,然后以每小时15倍床体积流速依次通过串联的XAD-8和XAD-4树脂柱,不能被树脂柱吸附的物质为HPI.
(2)用NaOH以每小时2倍床体积的速度对树脂柱分别进行反冲洗,从XAD-8和XAD-4树脂柱反冲洗所得的组分分别为HPO-A和TPI-A.
(3)反冲洗后,用甲醇对树脂柱分别进行冲洗得到HPO-N和TPI-N.
(4)将 HPO-A及 TPI-A样品的 pH值调节为 2后,再次分别对应通入清洗后的XAD-8和XAD-4树脂柱,流速为每小时 15倍床体积,组分吸附后用甲醇对树脂柱分别进行冲洗得到 HPO-A和 TPI-A.样品经真空干燥除去甲醇后再次溶于超纯水(Millipore Milli-Q)中,于 4,℃下保存.
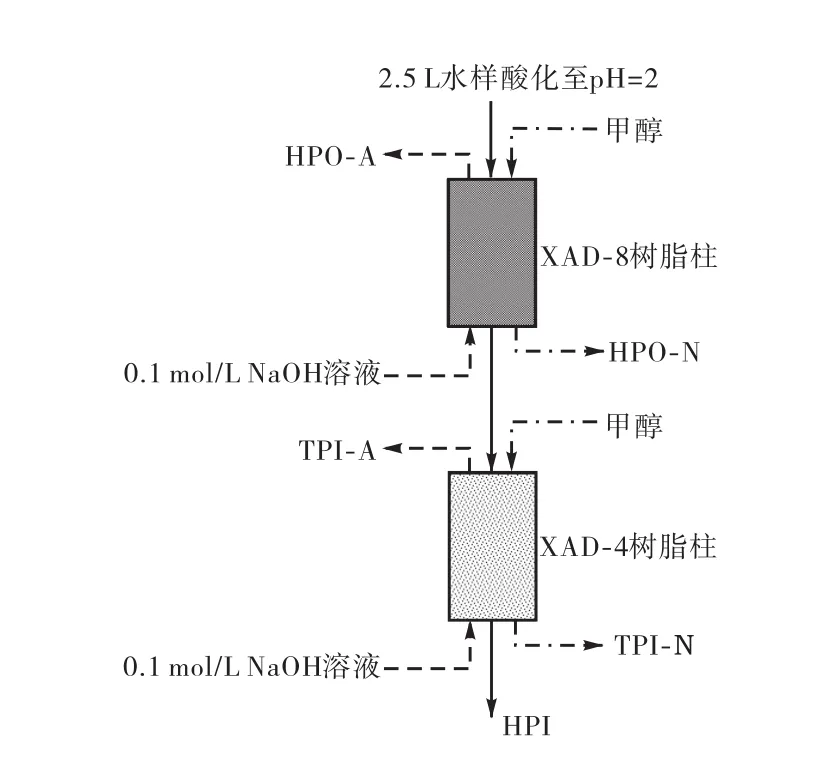
图1 溶液性有机物分级示意Fig.1 Scheme of DOM fractionation
1.4 分子光谱测定
采用岛津UV-2250紫外/可见分光光度计测定紫外光谱,扫描波长为 200~400,nm.测定前将各水样pH值调节至7,以超纯水作空白校正.
在 1~2,mg的固体样品中加入溴化钾晶体共同研磨压片,采用Perkin-Elmer Spectrum One B型红外光谱仪进行测定,波谱扫描范围为4,000~400,cm-1.为便于比较,傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)图谱用基线校正后进行归一化处理.
采用Jasco FP-6500型荧光分光光度计测定三维荧光光谱(three-dimension excitation emission matrix fluorescence spectroscopy,3DEEM),激发光源为氙灯.激发和发射狭缝宽度均为5,nm,激发光波长范围为 220~400,nm(步长 5,nm),发射光波长范围为280~480,nm(步长 1,nm),扫描速度为 2,000,nm/min.分析前以超纯水作空白校正纯水的拉曼散射.调节各水样至 pH=7,DOC 为 1,mg/L,以消除pH值和DOM浓度对荧光光谱的影响.
1.5 荧光FRI分析
采用荧光光谱区域积分(fluorescence regional integration,FRI)法将荧光光谱图划分为 5个区域[14],通过计算特定区域标准体积(Фi,n)对渗滤液处理前后DOM 图谱进行量化.为反映出相似性质特定结构的相对含量,以Фi,n表示各区域所代表DOM的累计荧光强度,ФT,n表示整体积分区域的累计荧光强度(以AU·nm2·(mg/L)-1为单位,其中 AU(arbitrary units)描述荧光峰强度),Pi,n表示各区域累计荧光强度百分比.Фi,n、ФT,n、Pi,n分别为
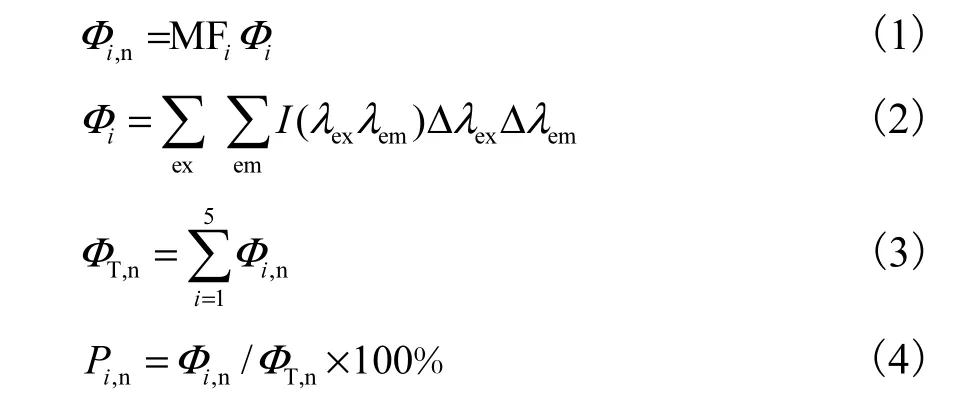
式中:ex、em 分别表示激发光和发射光;λex为激发波长;λem为发射波长;I(λexλem)为激发-发射波长对应的荧光强度;MFi为某一区域的区域倍增系数,其数值为该积分区域占整体积分区域面积比例的倒数.
2 结果与讨论
2.1 厌氧降解过程有机物含量变化
不同 HRT下厌氧降解渗滤液 COD及 DOC的去除率变化见图 2.可以看出,随着 HRT的减少,有机负荷增加,COD的去除率逐渐降低.当HRT由7,d变化到 3,d时,COD及DOC的去除率变化不明显,出水处理率分别维持在85%和90%以上.从3,d到2,d,COD去除率明显下降至80%以下;而降到1,d时,有机负荷增加3倍,有机物去除效果明显降低,COD和DOC的处理率分别由84.9%和92.1%降低至40.9%和48.9%.
试验中较长HRT条件下有机物的稳定去除,表明ASBR能有效降低渗滤液中复杂的有机物;但由于渗滤液本身所含有机物的毒性和难生物降解特性,使得在短HRT下厌氧微生物难以充分降解渗滤液中有机物,处理效果较低[15].
相同条件下DOC的去除率高于COD的去除率,表明厌氧过程中溶解性较非溶解性有机物的去除更为有效;而随着HRT的延长,两类物质的去除率差异不大.
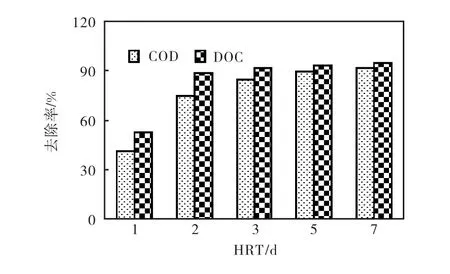
图2 不同HRT条件下厌氧降解COD和DOC去除率Fig.2 Removal efficiencies of COD and DOC during anaerobic degradation with varying HRTs
2.2 厌氧降解过程DOM组成变化

图3 渗滤液及不同HRT条件下厌氧降解处理出水DOM组成Fig.3 DOM fractionation of raw leachate and the effluents of anaerobic degradation with varying HRTs
垃圾渗滤液处理前后水样中各组分DOC浓度如图 3所示.原水中以疏水性有机物所占比例最大(占DOC的 40.9%;其中 HPO-A 占 31.9%,HPO-N 占9%),是 DOM 中的主要部分;其次是亲水性有机物和过渡亲水性有机物,分别占 DOC的 30.9%和28.2%(其中TPI-A占24.0%,TPI-N占4.2%).渗滤液组成特点表明原水中存在大量的腐殖酸、羧酸化合物和芳香酸;相对而言,碳氢化合物以及糖类化合物含量较少[6].
厌氧处理后渗滤液DOM浓度均有明显降低.相同 HRT下,各组分去除率存在 TPI-A>HPO-A>TPI-N >HPO-N的变化规律.延长HRT能有效提高有机组分的处理效果[16],在 1~7,d内,疏水性、过渡亲水性、亲水性组分去除率分别从 50.8%、51.9%和56.4%提高到 93.6%、94.3%和 96.6%;其中,当 HRT>2,d时,各组分的去除率均已达到 80%以上,且随着HRT的增加而趋于稳定.短HRT下酸性组分百分含量的暂时降低以及中性组分的提高可能是部分酸性组分被厌氧微生物优先利用和转化的表现[17];此外,基质中不同组分间浓度差异也可能是造成微生物降解效果差异的原因之一.从组分亲疏水性看,出水各组分比例变化不大,疏水性组分仍为渗滤液中的主要组分(占 DOC 的 50%),其次为过渡亲水性组分(占DOC的30%),亲水组分比例的降低表明厌氧处理过程中小分子羧基酸、聚糖、氨基酸等物质生物降解的优势.
2.3 DOM紫外光谱特性
UV254可用于表征DOM中与腐殖质相关的芳香性有机物的含量[18].原水中各组分 UV254值差异较大,表现为 HPO-A>HPO-N>TPI-A>TPI-N>HPI的递减规律如图4所示.疏水性组分UV254值较高的特点表明芳香性有机物多存在于这类组分中,尤其是HPO-A,以芳香性腐殖质类有机物为主[19];而在 HPI中以弱芳香性和非芳香性脂肪族为主,芳香性物质含量相对较少.
厌氧处理后,各组分 UV254值明显下降.由于组分组成不同,去除效果存在差异,中性组分去除率明显高于酸性组分,疏水性组分去除率高于过渡亲水性组分(HPO-N>TPI-N;HPO-A>TPI-A),出水中仍以HPO-A芳香性最强.
延长 HRT能更充分地降低渗滤液中有机物,但并不能彻底消除芳香性有机物.随着非芳香性和弱芳香性物质的优先降解和难生物降解类物质的累积,UV254值降低缓慢.在 HRT>3,d时,过渡亲水性组分(TPI-A和 TPI-N)中 UV254均表现略微升高,这可能与微生物作用下有机物在亲、疏水性组分间的相互转化有关.
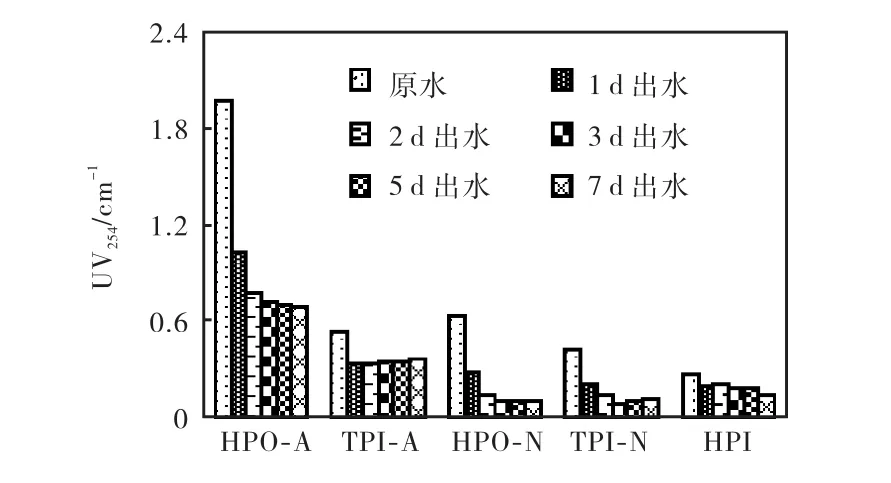
图4 渗滤液及厌氧降解处理出水DOM各组分UV254变化Fig.4 UV254 of DOM fractions in raw leachate and the effluents of anaerobic degradation with varying HRTs
2.4 DOM红外光谱特性
渗滤液及其厌氧处理后水(HRT=2,d)各组分红外光谱如图5所示.
依据红外谱图所表达的物质结构信息[20-21],HPO-A 中 1,740~1,700,cm-1、1,420~1,400,cm-1、1,250~1,150,cm-1位置的红外吸收峰与羧基C=O伸长、O—H及C—O振动有关,3,150~3,000,cm-1处的芳环振动峰表明 HPO-A中芳香结构和羧基酸、芳香酸等结构的大量存在,如图5(a)所示.
厌氧处理后,3,150~3,000,cm-1和 1,420~1,400,cm-1处吸收峰的明显削弱和 3,400,cm-1、2,950~2,850,cm-1位置吸收峰的加强,表明芳香酸、羧酸化合物含量的减少,而相应的脂肪族化合物和醇含量增加.
图5(b)所示TPI-A谱图与HPO-A相似,仅峰强存在差异,可能与分子结构的酸性、芳香性等有关.中性组分 HPO-N和 TPI-N红外谱图中 3,500~3,300,cm-1、1,570~1,520,cm-1(氨基Ⅱ类)、850,cm-1附近强烈的吸收峰表明有大量氨基化合物存在;1,630~1,590,cm-1峰强相对较弱,而 1,480~1,440,cm-1位置明显的吸收峰表明中性组分中含有大量脂肪族化合物,芳香性物质含量相对较少,这与UV254分析结果一致(图 5(c)和图 5(d)).厌氧处理后HPO-N和TPI-N红外谱图变化不大,主要表现为氨基化合物相关的吸收峰的减弱.
2.5 DOM荧光光谱特性
2.5.1 3DEEM光谱分析
图6(a)为渗滤液原水荧光光谱(FI为荧光强度),可以看出,在λex/λem=(220~230)nm/(290~310)nm(区域Ⅰ,芳香性蛋白类荧光物质,以酪氨酸为主)、λex/λem=(270~285)nm/(310~350)nm(区域Ⅳ,溶解性微生物副产物类荧光物质(soluble microbial products,SMP))和λex/λem=(220~240)nm/(325~350)nm(区域Ⅱ,芳香性蛋白类荧光物质,以色氨酸为主)区域有明显荧光峰;此外,在λex/λem=(275~300)nm/(390~420)nm(区域Ⅴ,腐殖酸类荧光物质)、λex/λem=(230~250)nm/(380~440)nm(区域Ⅲ,富里酸类荧光物质)区域也有少量肩峰出现[14,22].
多荧光峰的存在表明渗滤液原水中包含有微生物副产物、芳香性蛋白和腐殖质等多类荧光物质,短发射波长下较强的荧光峰表明蛋白类荧光物质在原水中占有优势地位.
厌氧降解后渗滤液 DOM 中长发射波长下的荧光峰(>380,nm)有明显增强,而短波长下的荧光峰(<380,nm)表现为一定程度的削弱,如图6(b)~6(f)所示.
单位DOC浓度下腐殖质类荧光强度的增强和蛋白类荧光强度的减弱表明厌氧微生物能优先利用渗滤液中的蛋白类物质,而对腐殖酸和富里酸类荧光物质的降解程度较弱.
随着 HRT的延长,腐殖质类物质荧光强度增加明显,尤其是富里酸类荧光取代蛋白类荧光成为优势峰,这与长链脂肪族物质在微生物作用下转化形成的富里酸类物质有关[23].

图5 渗滤液及其厌氧处理出水DOM各组分红外光谱(HRT=2,d)Fig.5 FT-IR spectra for DOM fractions in raw leachate and the effluent of anaerobic degradation(HRT=2,d)
2.5.2 荧光强度定量计算
采用 FRI法对渗滤液处理前后 DOM 的荧光光谱进行分析发现,处理后水中DOM的累计荧光强度较进水有所增大(表 1).HRT为 1,d时,尽管富里酸类荧光峰强较原水有明显增大(图 6(b)),但由于其他区域荧光强度变化,使得处理后水DOM的ФT,n值变化不大.而当HRT>2,d时,ФT,n值随着HRT显著增大,单位浓度组分中芳香碳含量增加.
从原水DOM的荧光强度分布中可以看出,区域Ⅱ所占比例最大,而区域Ⅴ的比例最小.厌氧降解后,各区域 Pn值相应改变,其中区域Ⅲ和Ⅴ所分别代表的富里酸和腐殖酸类荧光比例分别由27%和 10%上升到 36%和 20%;而区域Ⅰ、Ⅱ和Ⅳ所代表的蛋白类荧光区域 Pn值普遍下降明显,这可能与微生物活动有关[24].
结合DOM浓度变化可以发现,随着厌氧反应的进行,大部分有机物不断被微生物利用分解,而难生物降解的部分,尤其是富里酸类荧光物质会随着HRT的延长在反应器中累积而造成单位浓度中荧光强度的增大;同时源于细胞分解的糖和蛋白质的转换也可能造成腐殖质等大分子有机物的累积[25].值得注意的是芳香性蛋白及溶解性微生物副产物虽然较易降解,但随着反应的进行也会有少量累积[17,26].单位浓度下各区域 Фi,n值变化的线性拟合结果也说明了这一点(表2),各荧光区域间累积速率遵循Ⅲ>Ⅴ>Ⅱ>Ⅳ>Ⅰ的变化规律.

图6 渗滤液及其不同HRT条件下厌氧处理出水DOM三维荧光光谱Fig.6 EEMs of DOM in the raw leachate and the effluents of anaerobic degradation with varying HRTs

表1 渗滤液及不同HRT下厌氧处理出水DOM的Pi,n和ФT,nTab.1 Pi,n and ФT,n for DOM in raw leachate and effluents of anaerobic degradation with varying HRTs

表2 各区域Фi,n值变化的线性拟合Tab.2 Fitted linear equation for the Фi,n of each region
3 结 论
(1) ASBR能有效降低渗滤液中复杂的有机物,对DOC的去除率为53.0%~94.7%,延长反应时间可获得稳定的有机物处理效果.
(2) 渗滤液中疏水性有机物为 DOM 中的主要组分,依次分别是亲水性和过渡亲水性有机物;经过ASBR降解后疏水性、过渡亲水性和亲水性组分的去除率分别可达 50.8%~93.6%、51.9%~94.3%和56.4%~96.6%.在相同条件下,非亲水性各组分的去除率遵循 TPI-A>HPO-A>TPI-N>HPO-N的变化规律.
(3) 渗滤液中芳香性有机物多存在于疏水性组分中,厌氧处理能有效降低各组分 UV254值;但随着HRT的增加,过渡亲水性组分中UV254略微升高.厌氧处理后酸性组分中芳香环、羧基官能团减少明显,而相应的脂肪链、醇结构增加;中性组分中氨基化合物削减明显.
(4) 厌氧处理出水中富里酸和腐殖酸类物质累计荧光强度比例由37%上升到56%,代替芳香性蛋白类物质在渗滤液中占据优势地位.随着 HRT的延长,单位浓度中各区域累计荧光强度 Фi,n不断增大,各区域间累积速率遵循区域Ⅲ>区域Ⅴ>区域Ⅱ>区域Ⅳ>区域Ⅰ的变化规律.
[1] Yang Z Q,Zhou S Q. The biological treatment of landfill leachate using a simultaneous aerobic and anaerobic(SAA) bio-reactor system[J]. Chemosphere,2008,72(11):1751-1756.
[2] Mohan S V,Babu V L,Sarma P N. Anaerobic biohydrogen production from dairy wastewater treatment in sequencing batch reactor(AnSBR):Effect of organic loading rate[J]. Enzyme and Microbial Technology,2007,41(4):506-515.
[3] Sarti A,Fernandes B S,Zaiat M,et al. Anaerobic sequencing batch reactors in pilot-scale for domestic sewage treatment[J]. Desalination,2007,216(1/2/3):174-182.
[4] Timur H,Özturk I. Anaerobic sequencing batch reactor treatment of landfill leachate[J]. Water Research,1999,33(15):3225-3230.
[5] Hobson P N. The kinetics of anaerobic digestion of farm wastes[J]. Journal of Chemical Technology and Biotechnology,1983,33(1):1-20.
[6] Kang K H,Shin H S,Park H Y. Characterization of humic substances present in landfill leachates with different landfill ages and its implications[J]. Water Research,2002,36(16):4023-4032.
[7] 方 芳,刘国强,郭劲松,等. 三峡库区垃圾填埋场和焚烧厂渗滤液水质特征[J].重庆大学学报,2008,31(1):77-82.Fang Fang,Liu Guoqiang,Guo Jinsong,et al.Characterization of water quality of leachates from landfill site and incineration plant in Three Gorges area[J]. Journal of Chongqing University,2008,31(1):77-82(in Chinese).
[8] Leenheer J A,Croué J P. Characterizing aquatic dissolved organic matter[J]. Environmental Science and Technology,2003,37(1):18-26.
[9] Zheng Z,He P J,Shao L M,et al. Phthalic acid esters in dissolved fractions of landfill leachates[J]. Water Research,2007,41(20):4696-4702.
[10] Huo S L,Xi B D,Yu H C,et al. Characteristics of dissolved organic matter(DOM) in leachate with different landfill ages[J]. Journal of Environmental Science,2008,20(4):492-498.
[11] Fan H J,Shu H Y,Yang H S,et al. Characteristics of landfill leachates in central Taiwan[J]. Science of the Total Environment,2006,361(1/2/3):25-37.
[12] 水和废水监测分析方法编委会. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,2002:105-106,211-213,227-231.Water and Wastewater Examination Methods Editorial Committee. Standard Methods for the Examination of Water and Wastewater[M]. 4th ed. Beijing:China Environmental Science Press,2002:105-106,211-213,227-231(in Chinese).
[13] Thurman E M,Malcolm R L. Preparative isolation of aquatic humic substance[J]. Environmental Science and Technology,1981,15(4):463-466.
[14] Chen W,Westerhoff P,Leenheer J A,et al. Fluores-cence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science and Technology,2003,37(24):5701-5710.
[15] Xu S Y,He P J,Lu F,et al. Transformation of organic matters in fresh leachate during anaerobic degradation under long hydraulic retention time[J]. Journal of Environmental Sciences,2009,21(9):1302-1308.
[16] Ndegwa P M,Hamilton D W,Lalman J A,et al. Effects of cycle-frequency and temperature on the performance of anaerobic sequencing batch reactors (ASBRs)treating swine waste[J]. Bioresource Technology,2008,99(6):1972-1980.
[17] Shimada T,Zilles J,Raskin L,et al. Carbohydrate storage in anaerobic sequencing batch reactors[J]. Water Research,2007,41(20):4721-4729.
[18] Janhom T,Wattanachira S,Pavasant P. Characterization of brewery wastewater with spectrofluorometry analysis[J]. Journal of Environmental Management,2009,90(2):1184-1190.
[19] Quanrud D M,Karpiscak M M,Lansey K E,et al.Transformation of effluent organic matter during subsurface wetland treatment in the Sonoran Desert[J].Chemosphere,2004,54(6):777-788.
[20] Sierra M M D,Giovanela M,Parlanti E,et al. Structural description of humic substances from subtropical coastal environments using elemental analysis,FT-IR and13C-Solid State NMR data[J]. Journal of Coastal Research,2005,42(Suppl):370-382.
[21] Fuentes M,Baigorri R,González-Gaitano G,et al.The complementary use of1H NMR,13C NMR,FTIR and size exclusion chromatography to investigate the principal structural changes associated with composting of organic materials with diverse origin[J]. Organic Geochemistry,2007,38(12):2012-2023.
[22] Baker A,Curry M. Fluorescence of leachates from three contrasting landfills[J]. Water Research,2004,38(10):2605-2613.
[23] Lu F,Chang C H,Lee D J,et al. Dissolved organic matter with multi-peak fluorophores in landfill leachate[J]. Chemosphere,2009,74(4):575-582.
[24] Marhuenda-Egea F C,Martínez-Sabater E,Jordá J,et al. Dissolved organic matter fractions formed during composting of winery and distillery residues:Evaluation of the process by fluorescence excitation-emission matrix[J]. Chemosphere,2007,68(2):301-309.
[25] Dignac M F,Ginestet P,Rybacki D,et al. Fate of wastewater organic pollution during activated sludge treatment:Nature of residual organic matter[J]. Water Research,2000,34(17):4185-4194.
[26] Barker D J,Stuckey D C. A review of soluble microbial products(SMP) in wastewater treatment systems[J].Water Research,1999,33(14):3063-3082.
