子痫前期患者血浆抵抗素水平与糖脂代谢紊乱的关系
2012-07-31李庆,辛虹
李 庆,辛 虹
(1淄博市第一医院,山东淄博,255200;2河北医科大学第二医院)
子痫前期病因尚未阐明,其病理生理改变包括以胰岛素抵抗综合征为特点的各种代谢紊乱,主要包括血压升高、血脂异常、胰岛素抵抗、肥胖等。抵抗素是由脂肪组织分泌的一种新多肽类激素,与炎症反应、胰岛素抵抗和脂质代谢紊乱等有密切关系[1]。目前关于抵抗素与子痫前期关系的研究较少。2011年1~12月,本研究观察了子痫前期患者血浆抵抗素水平变化,探讨其与子痫前期代谢紊乱的相关性。
1 资料与方法
1.1 临床资料 子痫前期患者80例,年龄20~36(26.3±4.2)岁。其中轻度子痫前期(MPE)45例(MPE 组),孕(38.3 ±1.9)周;重度子痫前期(SPE)45例(SPE 组),孕(36.7±3.9)周。同时随机选取45例健康妊娠晚期孕妇为对照(对照组),年龄19~34(25.4 ±4.8)岁,孕(38.6 ±2.6)周。入选者均无胎膜早破、前置胎盘等产科并发症,孕前无高血压、糖尿病,排除有脂代谢异常改变者(包括肝胆管损伤、甲状腺功能减退、肾病综合征等),研究对象均为单胎、初产,均以剖宫产方式终止妊娠。三组年龄、孕周资料相比,P均 >0.05。MPE、SPE、对照组体质量指数(BMI)分别为 28.3 ±4.7、29.4 ±5.9、26.3 ±4.5,前两者高于后者(P均 <0.05);三组收缩压(SBP)分别为(153.6 ±10.5)、(169.4±13.4)、(106.3 ±14.1)mmHg,舒张压(DBP)分别为(72.6 ± 9.1)、(95.4 ± 12.5)、(110.3 ± 11.6)mmHg,三组相比,P均 <0.05。
1.2 血浆抵抗素、空腹血糖(FBG)及血脂的检测入院接受镇静、解痉、降压治疗前抽空腹静脉血5 mL,取其中3 mL置于抗凝试管,3 000 r/min离心15 min分离血浆,采用ELISA法测定血浆抵抗素水平;另2 mL置于普通管分离血清,检测空腹血糖及血脂水平。FBG测定采用葡萄糖己糖激酶法;血脂项目包括HDL、LDL、TG、TC,采用原装试剂德国罗氏全自动生化分析仪测定。
1.3 统计学方法 采用SPSS13.0统计软件。计量资料以±s表示,采用t检验,相关性分析采用直线相关分析法(Pearson检验)。P≤0.05为差异有统计学意义。
2 结果
2.1 三组血浆抵抗素水平、FBG、血脂指标比较TC、LDL、血浆抵抗素水平MPE组>SPE组>对照组,血清TG、HDL水平MPE、SPE组均高于对照组(P均<0.05);SPE组FBG高于对照组和MPE组(P均 <0.05)后两者相近,P>0.05。见表1。
2.2 子痫前期患者及正常孕妇血浆抵抗素水平与血压、BMI、FBG及血脂指标的相关性 子痫前期患者血浆抵抗素水平与 SBP、BMI、FBG、TG、LDL呈正相关(r分别为 0.524、0.462、0.287、0.539、0.657,P均 <0.05),与HDL呈负相关(r= -0.544,P<0.05),与DBP及 TC 无关(P均 >0.05);对照组孕妇血浆抵抗素水平与BMI呈正相关(r=0.635,P<0.05),与其他指标无明显相关性(P均>0.05)。
表1 三组血浆抵抗素水平、FBG、血脂指标比较(mmol/L,±s)
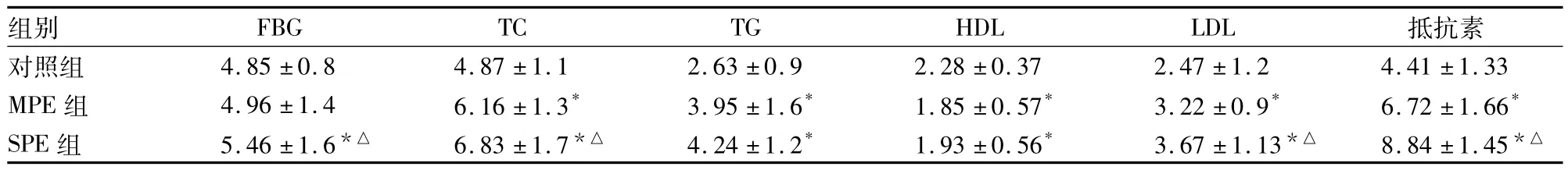
表1 三组血浆抵抗素水平、FBG、血脂指标比较(mmol/L,±s)
注:与对照组比较,*P <0.01;与 MPE 组比较,△P <0.05
组别 FBG TC TG HDL LDL 抵抗素对照组 4.85 ±0.8 4.87 ±1.1 2.63 ±0.9 2.28 ±0.37 2.47 ±1.2 4.41 ±1.33 MPE 组 4.96 ±1.4 6.16 ±1.3* 3.95 ±1.6* 1.85 ±0.57* 3.22 ±0.9* 6.72 ±1.66*SPE 组 5.46 ±1.6*△ 6.83 ±1.7*△ 4.24 ±1.2* 1.93 ±0.56* 3.67 ±1.13*△ 8.84 ±1.45*△
3 讨论
由于妊娠期的生理需要,妊娠妇女常伴有血脂和脂蛋白水平升高及耗氧量增加。研究证实,胰岛素抵抗、脂质代谢紊乱、动脉粥样硬化和内皮细胞功能障碍与子痫前期的发病有关。抵抗素直接或间接参与肥胖、高血压及代谢紊乱过程,在子痫前期及其伴发代谢紊乱的发病机制中发挥重要作用[2]。
3.1 代谢紊乱与子痫前期的关系 目前认为子痫前期患者代谢紊乱的发生主要与氧化应激反应过强、胰岛素抵抗、血管内皮功能失调和激活、交感神经系统过度激活有关。本研究中,子痫前期患者BMI、FBG、TG、TC、LDL 水平均明显高于对照组,而HDL水平明显低于对照组,这与其他学者研究结果一致[3]。HDL它能促进乳糜微粒和 VLDL的分解以及胆固醇酯的合成,阻止自由胆固醇沉积在动脉壁和其他组织中。其在抗LDL氧化中也起到重要作用,HDL水平降低可导致机体抗氧化能力降低,从而促进脂质过氧化增强及血管内皮损伤,是子痫前期的重要危险因素。研究表明,过高的 TG和VLDL与血管内皮细胞损伤有关,可导致血管收缩,抑制平滑肌舒张,促进血小板聚集,促使子痫前期发生。本研究发现,子痫前期患者TG水平显著正常孕妇。血脂异常可促进子痫前期患者的氧化应激,尤其在胰岛素抵抗综合征存在时,其可直接导致并加重胰岛素抵抗,同时胰岛素抵抗可使血压升高[4],进一步加重子痫前期的发生与发展。
3.2 抵抗素与代谢紊乱的关系 抵抗素主要在白色脂肪组织特异性表达,可降低脂肪细胞、骨骼肌细胞、肝细胞对胰岛素的敏感性,使血糖水平升高、脂肪细胞增生而致肥胖。本研究结果显示,子痫前期患者血浆抵抗素水平较对照组明显升高,并与SBP、BMI、FBG、TG、LDL 呈正相关,与 HDL 呈负相关,说明抵抗素与子痫前期患者的代谢紊乱密切相关。体外实验表明,抵抗素可使胰岛素诱导的脂肪细胞对葡萄糖的摄取减少37% ,用抵抗素抗体则起相反作用[5]。母体循环中高抵抗素与胰岛素靶组织如肝脏、脂肪及骨骼肌上的抵抗素受体结合后,能够抑制AMPK及其下游信号通路蛋白活性,使葡萄糖转运蛋白合成及膜转位发生障碍,葡萄糖代谢减慢,同时肝脏糖异生增加,脂肪分解代谢障碍,胰岛素抵抗加剧[6],导致糖脂代谢紊乱。
3.3 抵抗素与子痫前期的关系 血管内皮细胞受损或功能失调是子痫前期特征性的病理变化之一[7],抵抗素不仅与子痫前期的代谢紊乱密切相关,而且参与了血管内皮细胞功能损伤诱导的子痫前期的病理过程[8]。本研究中子痫前期患者血浆抵抗素水平明显高于对照组,且重度子痫前期患者高于轻度患者,与Seol等[9]的研究结果一致。高抵抗素水平可能通过以下机制导致血管内皮细胞功能障碍:①增强氧化应激:抵抗素引起氧化应激产物超氧阴离子的堆积,使内皮细胞依赖性血管舒张功能下降;②减少NO合酶的表达:抵抗素通过抑制NO合酶的活性而减少内皮细胞NO的产生和释放,引起血管舒张功能受损[10];③增加内皮素-1(ET-1)mRNA的表达:抵抗素处理后的内皮细胞ET-1 mRNA的表达增加,后者是强效内皮源性缩血管因子,能引起内皮细胞功能障碍;④通过真核细胞转录因子-κB(NF-κB)信号转导通路:抵抗素能通过 NF-κB信号转导通路引起前炎症因子表达增强从而诱导炎症反应,引起内皮细胞功能障碍[11];⑤降低TNF受体相关因子-3(TRAF-3)的表达:TRAF-3是一种内皮细胞活动的强效抑制剂,其表达下调将导致内皮细胞功能障碍;⑥损伤缓激肽受体:缓激肽的前身是血管舒张素,抵抗素可通过损伤缓激肽受体,干扰其介导的血管舒张作用;⑦增加血管内皮细胞黏附因子-1和单核细胞趋化因子-1的表达,直接或间接参与子痫前期的病理生理过程[12]。
总之,子痫前期患者常伴有血浆抵抗素水平增高与代谢紊乱,血浆高抵抗素水平可能与子痫前期患者胰岛素抵抗、代谢紊乱有关,进一步探讨抵抗素在子痫前期及其伴发代谢紊乱发病机制中的作用,将为子痫前期的诊治提供帮助。
[1]Stappan CM,Bailey ST,Bhat S,et al.The hormone resist in links obesity to diabetes[J].Nature,2001,409(6818):307-312.
[2]Briana DD,Malamitsi-Puchner A.Reviews:adipocytokines in normal and complicated pregnancies[J].Reprod Sci,2009,16(10):921-937.
[3]Isezuo SA,Ekele BA.Comparison of metabolic syndrome variables among pregnant women with and without eclampsia[J].J Natl Med Assoc,2008,100(9):1059-1062.
[4]Li GH,Liu L,Liu YY.Relationship between Estrogen Levels and Insulin Resistance,Blood Lipids,and Blood Pressure in Postmenopausal Women with Type 2 Diabetes[J].Medical Recapitulate,2010,16(21):3315-3317.
[5]Ort T,Arjona AA,MacDougall TR,et al.Recombinant human FIZZ3/resistin stimulates lipolysis in cultured human adipcytes,mouse explants and normal mice[J].Endocrinlogy,2005,146(5):2200-2209.
[6]Zhou YD,Jiang RZ,Song J,et al.The expression of resistin in placenta in gestational diabetes mellitus pregnant women and its significance[J].Prog Obstet Gynecol,2008,17(3):161-164.
[7]George EM,Granger JP.Recent insights into the pathophysiology of preeclampsia[J].Expert Rev Obstet Gynecol,2010,5(5):557-566.
[8]Miehle K,Stepan H,Fasshauer M.Leptin,adiponectin and other adipokines in gestational diabetes mellitus and pre-eclampsia[J].Clin Endocrinol,2012,76(1):2-11.
[9]Seol HJ,Oh MJ,Yeo MK,et al.Comparison of serum levels and the placental expression of resistin between patients with preeclampsia and normal pregnant women[J].Hypertens Pregnancy,2010,29(3):310-317.
[10]Kougias P,Chai H,Lin PH,et al.Adipocyte-derived cytokine resistin causes endothelial dysfunction of porcine cornary arteries[J].Vasc Surg,2005,41(4):691-698.
[11]Haugen F,Drevon CA.Activation of nuclear factor-kappaB by high molecular weight and globular adiponectin[J].Endocrinology,2007,148(11):5478-5486.
[12]RizviI M,Pathak D,Freedman JE,et al.CD40-CD40ligand interactions in oxidative stress,inflammation and vascular disease[J].Trends Mol Med,2008,14(12):530-538.
