牛病毒性腹泻弱毒疫苗免疫抗体水平与攻毒保护关系的研究
2012-07-30张淑琴郭利王炜武华
张淑琴 郭利 王炜 武华
中国农业科学院特产研究所,长春 130122
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)的代表种,在分类上与猪瘟病毒(Classical swine fever virus,CSFV)和边界病毒(Border disease virus,BDV)同为一属,抗原性有交叉性反应。病毒可感染牛、羊、猪等多种家畜和野生反刍动物,但以牛为主。受感染牛表现为发热、白细胞减少、腹泻、流产、黏膜糜烂溃疡等急性感染症状及小牛先天持续性感染。1946年,Olafson等[1]首次在美国东北部地区发现并分离出BVDV。到目前为止,该病呈世界性分布,在大多数养牛国家都存在,给世界养牛业造成了巨大的经济损失[2]。在我国,李佑民等[3]于1983年首次从国外引进牛的流产胎儿脾脏中分离并鉴定出BVDV,自此以来,我国新疆、内蒙古、宁夏、甘肃、青海、黑龙江、河南、河北、山东、辽宁、陕西、山西、广西、四川、江苏、安徽等20多个省市自治区均检出此病,个别地区阳性率在85%以上[4]。
由于没有很好的免疫防护措施,本病呈上升趋势,对牛群的肥育、产奶和繁殖影响极大,给养牛业造成了严重危害。疫苗接种是本病最主要的预防和控制措施,中国农业科学院特产研究所自2006年就开始进行BVDV发病机理及疫苗研究,并成功分离到BVDV攻击用强毒株[5],正在进行牛病毒性腹泻弱毒活疫苗的研究。本研究统计了进行牛病毒性腹泻活疫苗研究过程中使用的部分试验动物,确定血清中和试验与攻毒试验评价牛病毒性腹泻弱毒活疫苗的保护效力的平行关系,为牛病毒性腹泻病毒疫苗评价奠定基础。
1 材料与方法
1.1 材料
1)病毒和细胞。BVDV-SM疫苗株、BVDV-JL攻击用强毒株和MDBK细胞,由中国农业科学院特产研究所人兽共患病研究室保存。
2)主要试剂和仪器。DMEM培养基和马血清,购自Hyclone公司;牛血清购自济南劲牛公司科技有限公司;血细胞计数仪由SYSMIX公司生产。
1.2 方法
1)试验动物分组。试验共使用3月龄以上健康易感断乳牛125头,免疫组70头牛,对照组55头牛。免疫组为颈部肌肉注射BVDV-SM株弱毒活疫苗;对照组为BVDV抗体阴性牛,颈部肌肉接种MDBK细胞冻融物。在免疫后最短28d后促凝采血,微量血清中和试验检测BVDV抗体效价。按中和抗体效价结果将所有试验动物重新分组。第1组:1∶2<SN≤1∶16,10 头牛;第 2 组:1∶16<SN≤1∶64,13 头牛;第 3组:SN>1∶128,47头牛;第 4组为对照组,SN=1∶1,55头牛。所有动物用BVDV-JL强毒株鼻内喷雾接种攻击,攻击剂量为6×107.0TCID50/mL,攻毒后每日测量体温,观察记录临床症状并采集鼻拭子进行病毒分离,隔日采血用于病毒分离和白细胞计数,攻毒后14d结束(见表1)。
2)免疫接种及抗体检测。制备的BVDV-SM弱毒活疫苗在冷冻条件下由实验室运送到免疫现场,疫苗融解后颈部肌肉注射1mL/头,所用的疫苗样品立即低温保存运回实验室测定病毒毒价,回滴后确定免疫剂量。动物免疫后,每周采血分离血清,用于血清抗体检测。并于28d后采血分离血清,检测血清抗体效价。
3)攻毒。试验牛使用BVDV-JL强毒(效价为107.0TCID50/mL)攻击,攻击剂量为6mL/头,鼻内喷雾接种,3mL/鼻孔。动物接种强毒后,同时每天观察临床症状,包括食欲、精神状态等;每天测定体温,表现。
4)病毒分离。动物接种强毒后,每日采集鼻拭子,隔日采血分离白细胞,用于病毒分离测定;试验于病毒攻毒后14d结束。
2 结果与分析
2.1 抗体检测结果
动物免疫后,体内产生特异性抗BVDV中和抗体。抗体检测结果显示,免疫后14d内开始产生抗体,通常28d后中和抗体效价介于210~211,抗体水平在2~3个月达到高峰,持续数周后缓慢下降,免疫12个月抗体水平仍在1∶724以上。
2.2 攻毒后临床观察结果
所有试验动物经BVDV-JL强毒株经鼻内喷雾攻毒后,对照牛(抗体阴性)的体温超过基础体温1℃的有78%(43/55),白细胞数值下降,一般出现在第6天和第8天,93%(51/55)的牛白细胞下降比例超过30%。白细胞和鼻拭子病毒分离率为85%(47/55)。第 1 组 1∶2<SN≤1∶16,有 70%(7/10)的牛体温超过基础体温1℃,80%(8/10)的牛白细胞下降比例超过30%,70%(7/10)的牛在白细胞和鼻拭子中分离到病毒;第2组:1∶16<SN≤1∶64,有46%(6/13)的牛体温超过基础体温 1℃,62%(8/13)的牛白细胞下降比例超过30%,23%(3/13)的牛在白细胞和鼻拭子中分离到病毒;第3组:SN>1∶128,有 4%(2/47)的牛体温超过基础体温 1℃,2%(1/47)的牛白细胞下降比例超过30%,没有牛(0/47)在白细胞和鼻拭子中分离到病毒。具体结果见表2。

表1 动物分组情况
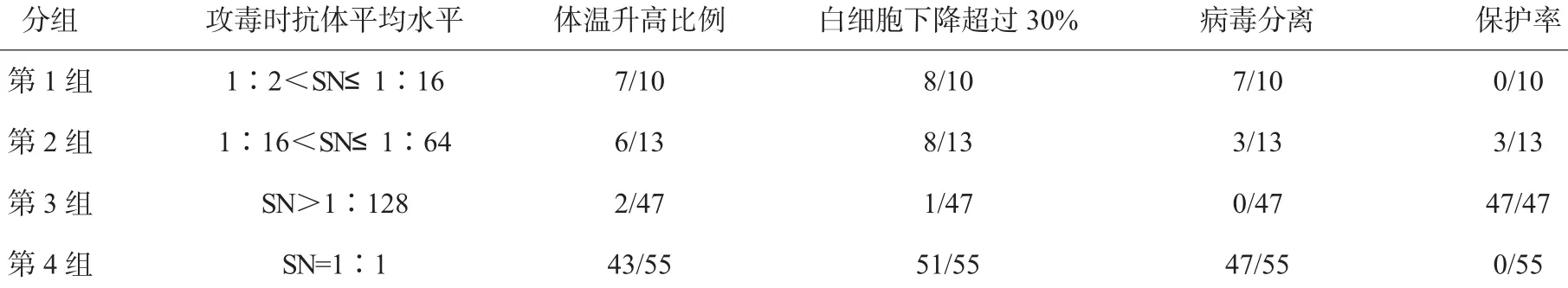
表2 攻毒后体温检测及临床观察结果
3 讨 论
弱毒疫苗是预防和控制BVD-MD的主要措施,第1株牛病毒性腹泻弱毒疫苗研究始于1961年,是把致细胞病变型BVDV毒株Oregon C24V在原代牛肾细胞上连续传代而被致弱[6];1964年,弱毒疫苗开始大批量生产[7],其用于预防牛病毒性腹泻已有约50a的历史。弱毒活疫苗既可刺激机体的细胞免疫,又可刺激机体产生体液免疫;动物免疫后产生免疫速度快并且免疫期持久,无需重复免疫。到目前为止,国外批准上市的抗BVDV的疫苗达数百种[8]。在集约化养牛业日益发达的今天,国外牛病毒性腹泻疫苗成了养牛业必须使用的疫苗之一。我国目前尚无自主研发的牛病毒性腹泻病毒活疫苗,此项研究可填补这一空白。本试验将攻毒保护结果与攻毒时抗体效价结果平行比较分析,结果显示,当BVDV抗体效价高于1∶128时,疫苗免疫可以对牛产生良好的保护效力,保护率在80%以上,牛病毒性腹泻病毒活疫苗的抗体水平与保护效力之间存在一定的平行关系。进行牛病毒性腹泻病毒活疫苗效力试验必须使用本动物,没有其他可供选择的试验系统。本研究采用血清学效力检验与靶动物免疫攻毒保护相关性的研究,探讨一种更适于成品疫苗效力检验的评估方法,节约试验成本,提高试验效率,为牛病毒性腹泻病毒活疫苗的效力检验研究提供依据。
[1]OLAFSON P,MACCALLUM A D,FOX F H.An apparently new transmissible disease of cattle[J].Cornell Vet,1946(36):205-213.
[2]HOUE H.Epidemiological features and economical importance of bovine virus diarrhoea virus(BVDV) infections[J].Veterinary Microbiology,1999,64(2-3):89-107.
[3]李佑民,刘振润,武银莲.牛病毒性腹泻-粘膜病病毒株(长春184)的分离和鉴定[J].中国人民解放军兽医大学学报,1983,3(2):113-121.
[4]张宁,秦建华.牛病毒性腹泻-黏膜病的诊断与防治[J].畜牧兽医杂志,2008,27(2):8-11.
[5]张淑琴,郭利,冷雪,等.牛病毒性腹泻病毒BVDV-JL株的分离与鉴定[J].中国预防兽医学报,2011,33(3):181-184.
[6]COGGINS L,GILLESPIE J H,ROBSON D S,et al.Attenuation of virus diarrhea virus (strain Oregon C24V)for vaccine purposes[J].Cornell Vet,1961(54):539-545.
[7]PETER C P,TYLER D E,RAMSEY F K.Characteristics of a condition following vaccination with bovine virus diarrhea vaccine[J].J Am Vet Med Assoc,1967(150):46-52.
[8]GOYAL S M,RIDPATH J F.Bovine viral diarrhea virus:diagnosis,management and control[M].USA:Blackwell Publishing,2005:91-104.
