统计学分析方法确定微波法提取佛手多糖的最佳工艺
2012-07-28纪跃芝李纯净
李 忻 纪跃芝 李纯净 于 倩
1.吉林大学中日联谊医院药剂科,吉林 长春 130033;2.长春工业大学基础科学学院,吉林 长春 130012
试验设计是考虑如何安排多因素多水平的试验,能合理而高效地获得所需要的试验数据,并用相应的方法分析这些数据,以确定哪些因素的影响是主要的,各因素用什么水平搭配起来对试验的指标是最佳的。试验设计在改进产品配方、降低原料和能源的消耗、提高产品的产量和质量等方面具有广泛的应用。本文以佛手多糖含量为指标,以提取次数、浸提时间、提取功率、料液比为因素,利用正交试验和方差分析方法,通过微波提取,对佛手多糖的提取工艺进行系统研究,确定最佳提取工艺,为合理利用和开发佛手药物资源提供科学依据。
1 仪器与药品
仪器:U1901双光束紫外可见分光光度计(北京普析通用仪器有限公司),XH-200A型微波萃取仪(北京鸿鹄科技发展有限公司),电子天平(赛多利斯科学仪器北京有限公司)。药品:佛手(长春药材公司),苯酚(开原化学试剂厂)、葡萄糖(中国药品生物制品检定所,批号:1108332200302,供含量测定用)、浓硫酸(胶州市富田化工有限公司)、乙醇(北京化工厂)等,均为分析纯试剂。
2 方法与结果
2.1 方法[3-5]
2.1.1 佛手多糖的测定方法 以葡萄糖为标准品,采用硫酸-苯酚比色法。
2.1.2 佛手多糖样品液的制备 精密称取1.0 g干燥至恒重的佛手,分别用95%的乙醇和80%的乙醇回流脱脂除糖,置于微波萃取仪内加水提取,将提取液合并,定容于500 mL容量瓶中,即得佛手多糖样品液。
2.1.3 标准样品液的制备 精密称取14.71 mg恒重干燥的无水葡萄糖,放入100 mL容量瓶中用水溶解,即得147.1 μg/mL标准样品液。
2.1.4 标准曲线的绘制 精密吸取上述标准样品液0.2、0.4、0.6、0.8、1.0 mL 至 10 mL 容量瓶中, 依次加入 1.8、1.6、1.4、1.2、1.0 mL蒸馏水,再各加1.0 mL 6%苯酚试剂,混匀,精密加入5 mL浓硫酸,振摇后放置5 min,置沸水浴中加热15 min,立即转入冷水浴中冷却至室温,以蒸馏水为空白,在490 nm波长处测定吸光度,以浓度C为自变量,吸光度A为因变量,进行一元线性回归,得到标准曲线A=0.0408C+0.211,算得相关系数r=0.9985,可见两者有高度相关性。
2.1.5 佛手多糖样品液的测定 精密吸取佛手样品液1.0 mL,按“2.1.4”项下标准曲线的绘制方法操作。
2.2 单因素试验的结果
2.2.1 提取次数对多糖得率的影响 选择提取时间8 min,提取功率 550 W,料液比 1∶20,提取次数分别为 1、2、3、4、5 次,多糖得率结果见图1。由图1可见,提取次数2次与3、4、5次相比,样品多糖得率相差不大,故选择2次。
屈哨兵提出了发展好教育的广州路径,分阶段启动卓越校长培养工程、高素质人才培养工程、新一轮基础教育“百千万人才培养工程”等,使得广州好教育的五重内涵都有了抓手与方向,具有很强的操作性,“广州好教育”这盘棋也因此下得更精彩、更久远。
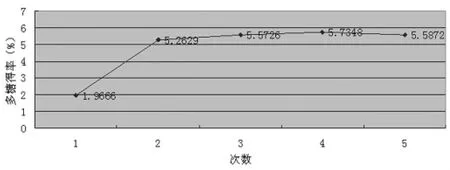
图1 提取次数对多糖得率的影响
2.2.2 提取时间对多糖得率的影响 提取次数2次,提取功率550 W,料液比 1∶20,提取时间分别为 4、6、8、10、12 min,多糖得率结果见图2。由图2可见,当提取时间达到8 min时,多糖得率达到最大。故选择提取时间8 min。

图2 提取时间对多糖得率的影响
2.2.3 微波功率对多糖得率的影响 提取次数2次,提取时间8 min,料液比 1∶20,提取功率分别为 250、400、550、700、850 W,多糖得率结果见图3。
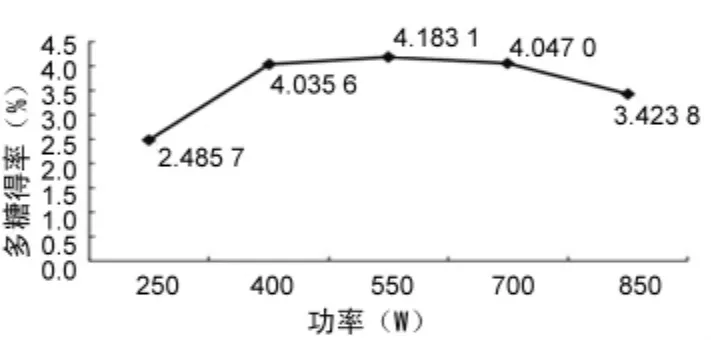
图3 微波功率对多糖得率的影响
由图3可见,当微波功率达到550 W时,多糖得率达到最大值。故选择微波功率550 W。
2.2.4 料液比对多糖得率的影响 提取次数2次,提取时间8 min,微波功率 550 W,提取料液比分别为 1∶5、1∶10、1∶15、1∶20、1∶25,多糖得率结果见图4。
由图4可见,当料液比为1∶20时,多糖得率达到最大值。故取料液比 1∶20。
2.3 佛手多糖提取条件的优化设计与统计分析
2.3.1 佛手多糖提取条件的优化设计 在单因素试验的基础上,以提取时间A(min)、提取功率B(W)和料液比C为因素,作三因素、三水平的正交试验。因素-水平的优化设计见表1。
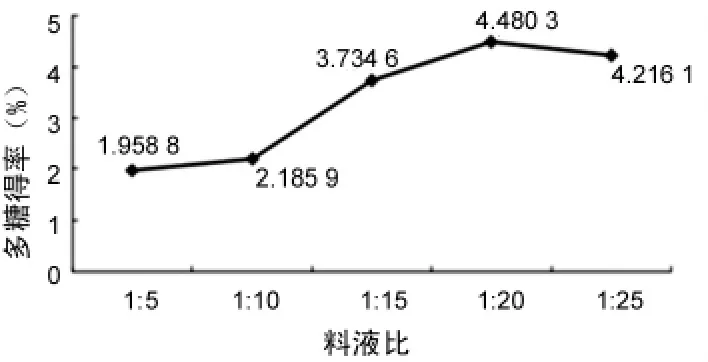
图4 料液比对多糖得率的影响

表1 因素-水平的优化设计
2.3.2 统计分析[6-7]
选用正交表L9(34),根据表1进行正交设计,取显著性水平α=0.05。实验结果见表2,方差分析见表3。
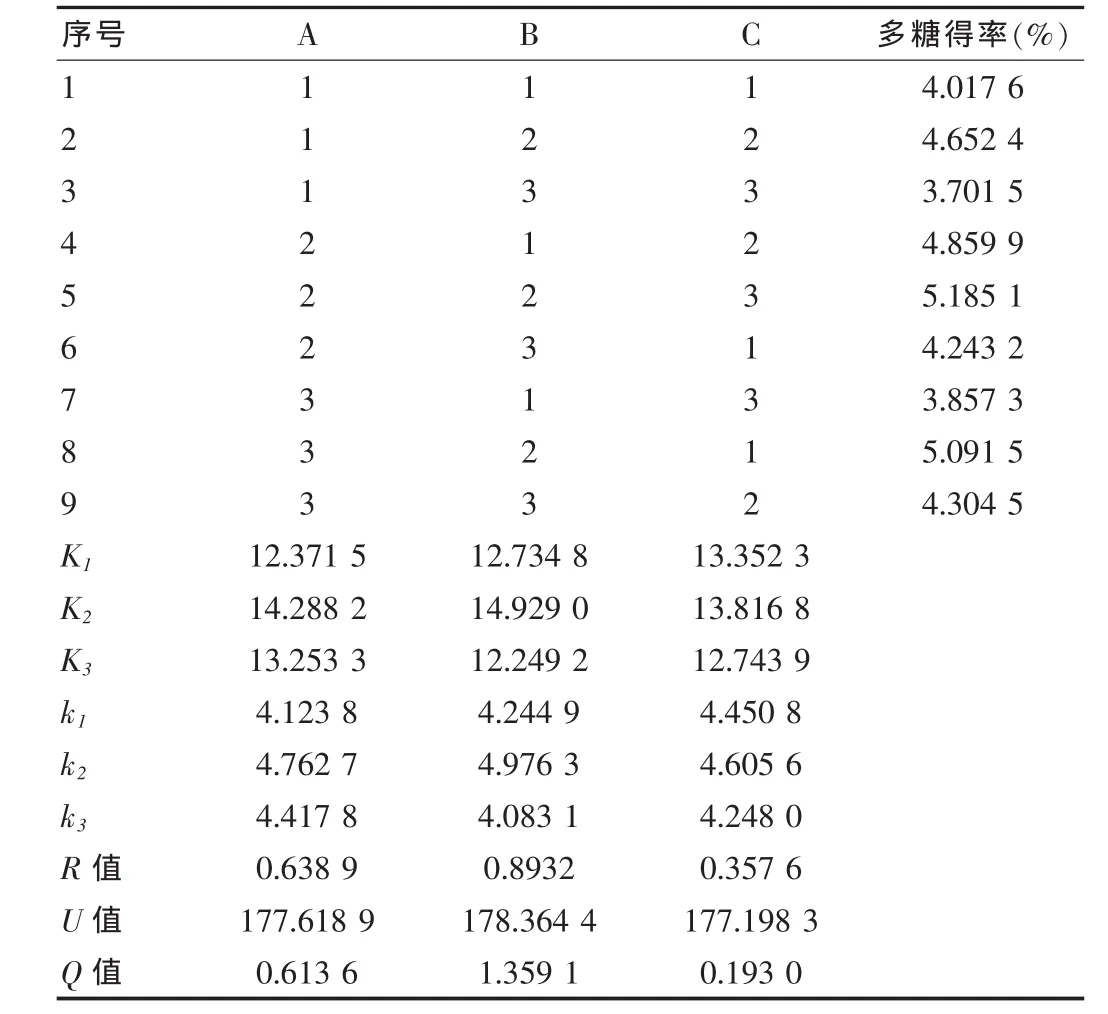
表2 正交试验结果
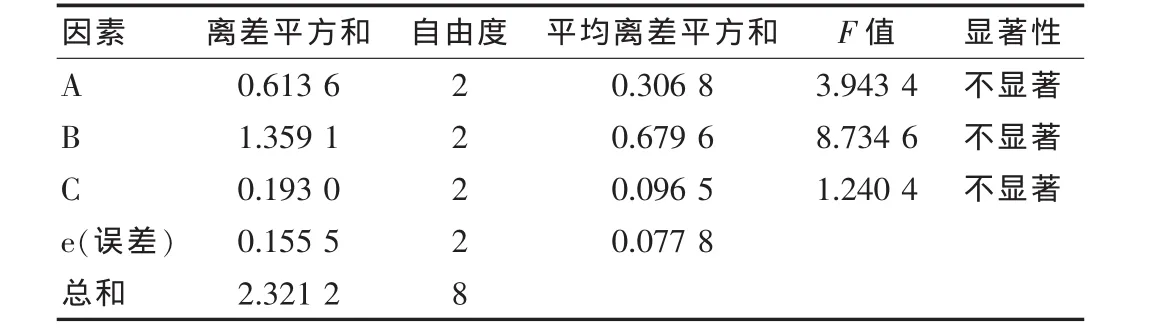
表3 方差分析
根据表6和表7,对其进行分析,结果如下:
①由RC<RA<RB知,影响佛手多糖得率的因素排序为C<A<B,即影响力为微波功率>提取时间>料液比。
②由 A:K1<K3<K2,B:K3<K1<K2,C:K3<K1<K2可知,最佳工艺条件是A2B2C2。
③在水平 α=0.05 下,F0.05(2,2)=19,由于 FA、FB、FC均小于19,所以3个因素对佛手多糖得率的影响均不显著。
综合上述分析结果表明,微波法佛手多糖的最佳工艺条件为浸提时间8 min,微波功率550 W,料液比1∶20。
3 讨论
化学成分分析结果表明,佛手是一种富含香豆素类化合物的植物,同时还含有黄酮类、柠檬苦素类等成分[8],而佛手多糖作为佛手提取主要成分后的副产物,近年来发现其具有多方面的生理活性。本试验采用正交试验设计和数据处理,方法科学合理,快速,灵敏,重现性好,是进行优化中药有效成分提取工艺的最佳设计,也为有效开发和利用佛手资源提供了可靠的理论依据。
随着佛手多糖保健功能研究的不断深入,利用佛手多糖开发的保健品或药品的市场前景为人们所看好。所以在以后的研究中应加深对佛手多糖功能方面的研究,如其抗衰老、降血糖、降血脂作用等[7],并将其应用到保健品、药品和食品中,生产出有利于人民身体健康的、经济效益高的产品。
[1]江苏新医学院.中药大辞典(上册)[M].上海:上海人民出版社,1986:1141.
[2]黄玲,张敏,蔡玉军,等.佛手多糖对小鼠免疫功能影响[J].时珍国医国药,1999,10(5):324-325.
[3]赵文彬,成玉怀.天山大黄多糖的超声提取及含量测定[J].时珍国医国药,2006,17(2):223-224.
[4]纪耀华,纪耀芝,马爱民,等.微波法提取大黄多糖最佳工艺优化研究[J].中药材,2009,32(8):1291-1293.
[5]倪受东,严德江,徐先祥.大黄多糖的提取及含量测定[J].中国药业,2007,16(13):10-11.
[6]梅长林,周家良.实用统计方法[M].北京:科学出版社,2006:218-238.
[7]洪伟,吴承祯.试验设计与分析——原理、操作、案例[M].北京:中国林业出版社,2004:208-235.
[8]周春丽,郭卫东.佛手种质资源研究进展[J].陕西农业科学,2005,42(3):89.
