多层螺旋CT在胃肠道间质瘤临床诊断中的应用
2012-07-28白卓杰
闵 钢 胡 宁 白卓杰
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是较为少见的非上皮性肿瘤,曾称为平滑肌瘤、平滑肌肉瘤、成平滑肌细胞瘤等。近年来已认识到该病是原发于胃肠道、网膜及肠系膜,为原癌基因干细胞生长因子受体(KIT)阳性的梭性细胞或上皮样细胞肿瘤[1],显示向胃肠道间质Cajal细胞分化;kit受体抑制剂能有效地治疗恶性GIST[2]。本组回顾性分析12例经手术和病理证实的胃肠道间质瘤多层螺旋CT表现,以提高对该病的认识及临床诊断价值。
1 材料与方法
收集我院2007年1月至2011年12月经手术病理证实的GIST患者12例,其中男性7例,女性5例,年龄32~82岁,平均年龄为56岁。临床症状和体征主要为腹痛5例,腹痛伴有腹部包块3例,进食后上腹部不适2例,自我无意识扪及腹部包块2例;其中伴有黑便2例,排便、排气减少1例。
检查方法:12例均行CT平扫和增强扫描,使用Somatow Sensation型16排螺旋CT扫描机,准直为1.5 mm,重组层厚5 mm,间隔5 mm。增强扫描使用MEDRAO双筒高压注射器从肘静脉注射质量浓度为300 mg /ml的对比剂碘海醇90 ml,注射流速为3 ml/s。采用自动触发软件,当主动脉强化达100 HU并延时5 s自动开始动脉期扫描,30 s后开始静脉期扫描。计算机软件多平面重组(multiplanar reformation,MPR)后处理,以利于解剖结构、肿瘤与邻近结构关系最佳显示。
2 结果
12例患者肿瘤长径3.2~18.6 cm。肿瘤位于胃部4例,十二指肠3例,空肠3例,回肠2例。肿瘤形态呈圆形或椭圆形,其中2例有分叶。肿瘤直径<5 cm者4例,≥5 cm者8例。肿瘤密度均匀2例,密度不均匀内见坏死8例,囊实性混合2例。实性部分平扫CT值为30~45 HU,增强扫描有2例均匀强化,10例为不均匀强化,其中明显强化2例,CT值95~110 HU,增加幅度>40 HU;中度强化7例,增加幅度20~40 HU;轻度强化3例,增加幅度<20 HU。10例肿瘤边界清楚,2例边界不清。5例为黏膜下型,7例为浆膜下型。全部病例均做CD117、CD34、SMA等免疫组化染色检查。CD117均呈阳性表达(100%),CD34阳性表达8例(占66.7%),SMA阳性表达3例(占25%),病理证实为良性2例,交界性3例,恶性7例。
3 讨论
3.1 病理特点和分型
GIST由Mazur等于1983年根据肿瘤的分化特点提出,肿瘤来源于胃肠道间质的Cajal细胞(胃肠道起搏细胞)。镜下观查来源于胃肠道,边缘光滑,柔软,呈灰白色。基本形态为梭型细胞和上皮样细胞,根据梭型和上皮样细胞比例将其分为梭型细胞型(占70%)、上皮型(占20%)和混合型(占10%)。免疫组化检查表现为95%的病例可有kit表达,82%出现CD34表达,95%的GIST对CD117抗体呈强阳性,而胃肠道平滑肌源性肿瘤及神经鞘瘤均不表达CD117[3],因而可作出鉴别诊断,这也是目前将GIST认为是一种独立的胃肠道间叶性肿瘤的主要依据。
3.2 病理学诊断与良性恶性判定
目前,关于GIST的良性、恶性判定尚存在一些分歧,但多数学者认为肿瘤的大小以及有丝分裂率是判定肿瘤良性、恶性的主要标准。以往曾以肿瘤最大直径>10 cm(小肠5 cm),有丝分裂率>10/50高倍镜视野(HPF)为恶性,直径<5 cm(小肠2 cm),有丝分裂率<5/50 HPF为良性;介于两者之间为交界性[4-5]。但发现一些很小的GIST,其有丝分裂率<5/50 HPF却出现转移,因此对于小的GIST强调用低恶性风险来描述和术后密切随访。美国国立卫生研究院关于GIST侵袭行为的风险标准为:很低恶性风险直径<2.0 cm,有丝分裂率<5/50 HPF;低恶性风险直径2~5 cm,有丝分裂率<5/50 HPF;中度恶性风险直径<5 cm,有丝分裂率6~10/50 HPF,或直径5~10 cm,有丝分裂率<5/50 HPF;高度恶性风险直径>5 cm,有丝分裂率>5/50 HPF,或直径>10 cm,而无论任何程度的有丝分裂率,或任意大小,但有丝分裂率>10/50 HPF[6]。
3.3 临床表现
GIST的临床表现无特异性,常见的症状包括中上腹部不适和腹痛,腹部肿块、便血等。肿瘤较小时常无症状,多为偶然发现。发病年龄多见于中老年,男性略多于女性。肿瘤好发于胃部,其次为小肠、结肠、直肠,食道等部位少见。
3.4 多层螺旋CT表现
GIST可发生在胃肠道各个部位,根据瘤体与胃肠道管壁的关系CT可分为4型。
(1)黏膜下型:肿瘤从黏膜下向腔内生长,与内壁形成宽基底相连肿瘤。
(2)浆膜下型:肿瘤从浆膜下向外生长,与管壁有蒂相连。
(3)肌壁间型:肿瘤同时向腔内外生长。
(4)胃肠道外型:肿瘤起源于胃肠管壁以外腹内其他部位。
肿瘤大多数呈孤立膨胀性生长,形态呈圆形、椭圆形及分叶不规则形;密度可均匀,出现出血、坏死、囊变;密度可不均匀,有的可形成囊实性混合间质瘤。当肿瘤坏死、囊变与胃肠腔发生穿孔时,肿瘤内可见气体影或气液平面,囊腔与胃肠道相通的窦道全程显示时可呈特征性隧洞样征象[7]。肿瘤钙化少见。通常小的GIST密度均匀,但有文献报道约38%小的GIST在CT上可出现局灶性低密度区,可能代表实性肿块的出血、坏死、囊变、溃疡中液体聚集及纤维分隔,而与高的有丝分裂率无关,因此出现这些表现不能预测其潜在恶性行为[8]。肿瘤大多边界清晰、光整,即使巨大的肿块其对周围组织的侵润亦相对较轻,少部分间质瘤可以与多个脏器发生粘连,肿瘤边界与邻近结构模糊不清则提示侵润。肿瘤可向腔内生长,形成腔内肿块(如图1所示)。肿瘤多以宽基底与管壁相连,但也有的呈蒂状相连,肿瘤表面若发生缺血坏死,可形成溃疡;肿瘤也可向腔外、向浆膜下生长,形成瘤体大部分位于腔外肿块,有的只是通过细蒂与胃肠道管壁肌层相连;肿瘤一般都比较大,甚至是巨大(如图2所示),多层螺旋CT多平面重组(MPR)有助于判断肿瘤起源部位(如图3所示)。增强CT可见肿块均匀强化,若出现出血、坏死、囊变则强化不均匀。良性间质瘤多密度均匀,增强扫描呈中度至明显均匀强化;交界性、恶性间质瘤多密度不均匀,增强扫描肿块实质成分呈轻度至中度不均匀强化、坏死或囊变区不强化(如图4所示),静脉期增强CT值高于动脉期;本组1例间质瘤的实性区域内可见簇状、线状血管影(如图5所示),这可能与肿瘤血供丰富有关。GIST向腔内生长,形成占位,可使消化道变窄,但很少出现肠梗阻征象。这可能与肿瘤较柔软,表面光整,与肠管内壁无粘连有关。GIST最常见是通过血行转移到肝脏和肺,也可通过种植转移到肠系膜和网膜等部位,淋巴结转移少见[9](如图6所示)。少数GIST可多发,可伴发或继发其他肿瘤[10]。
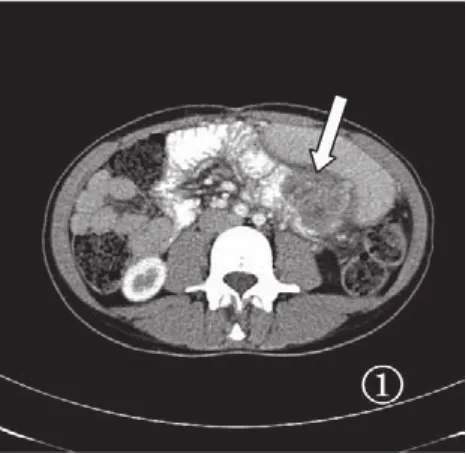
图1 空肠间质瘤,肿瘤向腔内生长的类圆性肿块,密度不均匀,CT增强呈轻度不均匀强化(箭头)
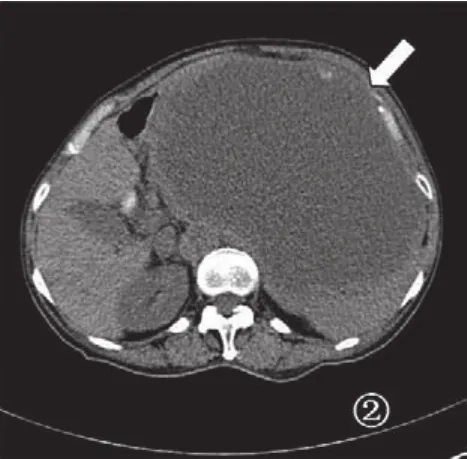
图2 胃间质瘤CT平扫,肿瘤向腔外生长的巨大肿块,肿瘤大部分坏死囊变(箭头)
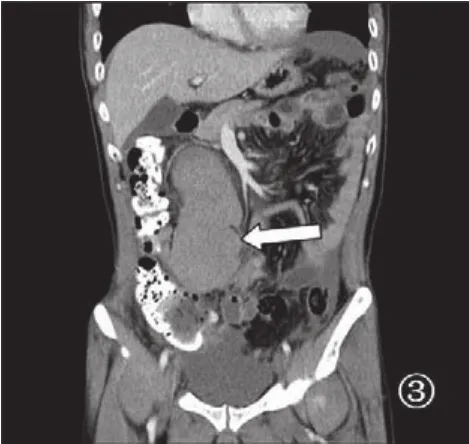
图3 十二指肠间质瘤MPR,有助于判断肿瘤起源部位,以利于解剖结构、肿瘤与邻近结构关系最佳显示(箭头)

图4 空肠间质瘤 CT增强,肿瘤边缘欠清晰,有侵润现象;实质成分呈中度不均匀强化,坏死囊变区不强化(箭头)
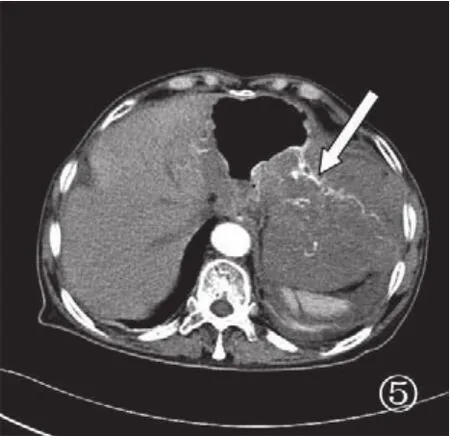
图5 胃间质瘤CT增强,肿瘤实性部分簇状、线状血管强化影(箭头)

图6 腹腔转移CT平扫,腹腔内见多个大小不等圆形肿块,部分坏死囊变(箭头),通过种植转移到肠系膜和网膜,腹膜后未见肿大淋巴结
3.5 鉴别诊断
(1)GIST与胃肠道淋巴瘤鉴别:胃淋巴瘤胃壁增厚广泛,腔外生长少,腹腔淋巴结肿大多见。小肠淋巴瘤受侵肠壁较广呈环形增厚,CT示“夹心面包征”和“动脉瘤样肠腔扩张征”,肠系膜淋巴结肿大[11]。
(2)GIST与神经鞘瘤鉴别:对肿瘤较大,其内密度不均,可见有坏死、囊变者,应首先考虑间质瘤[12]。
(3)GIST与平滑肌类肿瘤鉴别:除了平滑肌类肿瘤发生率远低于GIST之外,CT上均有类似表现,尚不能区别,确诊仍需依靠免疫组化和电子显微镜检查。
3.6 治疗与随访
肿瘤手术切除后复发概率大,生长快;对放疗、化疗不敏感。目前,治疗方法主要是生物治疗,甲磺酸伊马替尼能有效治疗恶性GIST。较一致的观点是在出现转移性病变时即应使用甲磺酸伊马替尼,直到产生耐药性为止。由于恶性GIST易复发,很小的GIST也可出现转移,故应认为是潜在恶性肿瘤,应定期严密随访[13]。
4 结语
随着CT检查技术的发展和完善,特别是多层螺旋CT在消化道检查中的广泛应用,其诊断价值越来越受到重视,极大提高了GIST检出率,同时动态增强扫描可更好地观察肿瘤影像特征;多层螺旋CT以及多平面重组技术能够多方位展示GIST大小、形态、密度及与周围脏器关系等情况,对肿瘤的定位及定性具有重要的临床应用价值,并可初步判定肿瘤的性质,为临床制定手术方案提供可靠的依据。
[1]Miettinen M,Lasota J. Gastrointestinal stromal tumors-definition,clinical, histological,immunohistoh emical,and molecular genetie features and differential diagnosis[J].Virchws Arch,2001,438(1):1-12.
[2]Demetri GD,von Mehren M,Blanke CD,et al.Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors[J].N Engl J Med,2002,347(7):472-480.
[3]Yamaguchi U,Hasegawa T,Masuda T, et al.Differential diagnosis of gastrointestinal stromal tumor and other spindle cell tumors in the gastrointestinal tract based on immunohistochemical analysis[J].Virchows Arch,2004,445(2):142-150.
[4]Kim HC, lee JM, Choi SH, et al.Imaging of gastrointestinal stromal tumors[J].J Comput Assist Tomogr,2004,28(5):596-604.
[5]Kim HC, Lee JM, Kim KW, et al.Gastrointestinal stromal tumors of the stomach:CT findings and prediction of malignancy[J].AJR Am J Roentgenol,2004,183(4):893-898.
[6]Fletcher CD, Berman JJ, Corless C,et al.Diagnosis of gastrointestinal stromal tumors:A consensus approach[J].Hum Pathol,2002,33(5):459-465.
[7]李晚君,崔东,张承惠,等.胃肠道间质瘤的CT诊断[J].影像诊断与介入放射学杂志,2005,14(2):90-93.
[8]Kim HC, lee JM, Kim SH, et al. Small gastrointestinal stromal tumours with focal areas of low attenuation on CT:pathological correlation[J].Clin Radiol,2005,60(3):384-388.
[9]Hasegawa S,Swmelka RC,Noone TC,et al.Gastrointnestinal stromal sarcomas:correlation of MR imaging and histopathologic findings in nine patients[J].Radiology,1998,208(3):591-595.
[10]刘征华,陈韵彬.多层螺旋CT诊断胃肠道间质瘤的探讨[J].影像诊断与介入放射学杂志,2008,17(1):14-16.
[11]郑祥武,吴恩福,程建敏,等.小肠原发性恶性淋巴瘤的CT诊断[J].中华放射学杂志,2001,35(5):370-372.
[12]杨永岩,杨利,皮厚山,等.胃间质瘤的影像学诊断[J].医学影像学杂志,2006,16(9):1000-1001.
[13]张龙江,祁吉.胃肠道间质瘤:一种新确定的胃肠道间叶性肿瘤[J].中华放射学杂志,2006,40(9):998-1001.
