肺、肝多发性血管畸形1例并文献复习
2012-07-27单长波刘永强
单长波 刘永强
肺多发性血管畸形很少见,肺多发性血管畸形合并肝血管畸形更罕见[1-2]。现将本院收治的1例肺动静脉畸形(pulmonary arteriovenous malformations,PAVMs)合并肝血管畸形报道如下,并结合文献进行复习。
病例摘要
患者女性,41岁,农民,因右胸痛5~6 d,加重伴胸闷1 d于2011年8月18日入院。患者入院前5~6 d无明显诱因出现右侧胸痛,为阵发性疼痛,于咳嗽时加重,疼痛不剧烈,患者未在意。入院前1 d夜间开始右侧疼痛剧烈,伴胸闷,稍一活动即明显加重,无咳嗽咳痰,无咳血,无发热,于当地医院做胸部CT检查示胸腔积液、肺内占位,在当地未治疗,即来我院就诊。自述慢支已30年,近两年在活动时憋喘明显。患者否认有鼻出血史。
查体:T 36.2℃,P 98 次/min,R 22 次/min,BP 120/65 mm Hg,无皮肤毛细血管扩张,浅表淋巴结未触及肿大。耳、鼻、喉部检查无异常。口唇紫绀,右肺叩诊浊音,呼吸音低,左肺呼吸音粗,呼气相延长,未闻及胸膜摩擦音。右胸部锁骨中线第3肋间可闻及频率与心率一致的血管杂音,心前区无隆起,心率98次/min,心律规整,三尖瓣区可闻及2/6级收缩期杂音。腹平坦无压痛,肝颈静脉返流征阴性,双下肢无凹陷性水肿,双手指端紫绀,杵状指。辅助检查:胸部CT右肺占位性病变、右胸腔积液、慢支肺气肿,初步诊断为胸腔积液性质待查。入院后胸腔B超:右侧胸腔9.1 cm的液性暗区,进行胸腔穿刺抽液见血性胸液,给予化验,胸水常规:血性标本,李凡他试验(+),镜检细胞数540×106/L,单叶0.25,多叶0.75,未见抗酸杆菌。胸水生化:白蛋白51.3 g/L,腺苷脱氨酶11 U/L,葡萄糖3.5 mmol/L,乳酸脱氢酶(lactic deluydrogenase,LDH)312 U/L,淀粉酶 29 U/L。胸水细胞学:红细胞背景下见散在少量炎细胞、间皮细胞。心电监护显示血氧饱和度最高88%,稍有活动即下降至80%,患者精神差,胸闷、憋喘、胸痛较重,并请胸外科会诊能否探查,会诊医生认为不除外恶性胸腔积液,建议引流观察,用止血药物。8月19日引流液为1600 ml,8月20日为500 ml,8月21日150 ml,8月23日300 ml。自入院到8月23日12时血压在160~98/92~66 mm Hg之间波动,心率在100~126次/min之间波动;吸氧流量达5 L/min,SpO2在82~93%之间,PaO242.8~50.9 mm Hg。辅助检查:肝肾功能电解质:总胆红素 28.4 μmol/L,间接胆红素 22.7 μmol/L,白蛋白32.6 g/L,尿素氮7.6 mmol/L,余正常;血糖4.5 mmol/L。凝血四项正常。心电图:窦性心动过速。尿常规正常。8 月18 日血气分析:pH 7.490,PaCO219.5 mm Hg,PaO242.8 mm Hg,cBase-6.7 mmol/L。血常规:WBC 11.95 ×109/L,中性粒细胞 84.6%,RBC 3.76 ×1012/L,Hb 119g/L,血小板161×109/L。ESR:5 mm/h。8月19日血常规:WBC 12.1×109/L,中性粒细胞75%,RBC 3.47×1012/L,Hb 108 g/L,血小板143×109/L。8月20日血气分析中的血红蛋白测定值为79 g/L,于是输注浓红2U。血清四项:正常。胸片:双肺纹理增强,境界欠清晰,双肺门浓,肺动脉段突出,双肺底云雾状阴影,心影增大梨形,右侧胸腔积液。8月21日患者自感症状好转,胸痛、憋喘明显减轻,SpO2有时可达到93%,经家属同意,做心脏彩超,结论为:右房大,三尖瓣中量反流,主动脉瓣少量反流,肺动脉高压(61 mm Hg),EF 77%。并做肺CT,见双下肺密度增高的异常阴影,疑为血管影(图1),于是次日做增强肺CT扫描,见肺动脉干增粗,直径约5 cm,左右肺A主干均增粗;进行影像重建,追踪汇入和流出血管走向,并动态观察,见双肺下叶、右肺中叶肺动、静脉均示明显迂曲、扩张,末端融合成瘤样扩张的血管囊腔,升降主动脉无扩张(图2~4);右侧中等量胸水;扫描野见肝左中右三支静脉均示扩张(图5);结论:①双肺动静脉畸形,肺动脉高压;②右侧胸腔积液;③ 肝静脉发育畸形。8月22日胸水CEA8.8 ug/L。血肿瘤标志物正常。
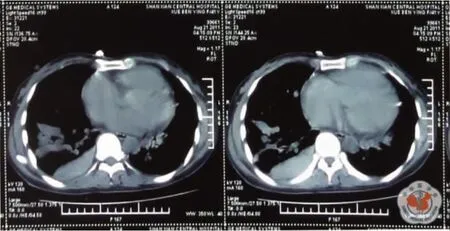
图1 CT图
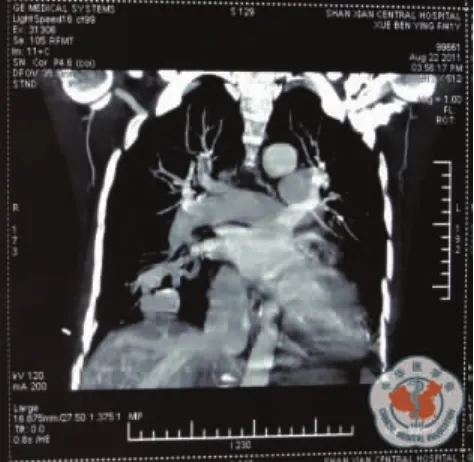
图2 CT图
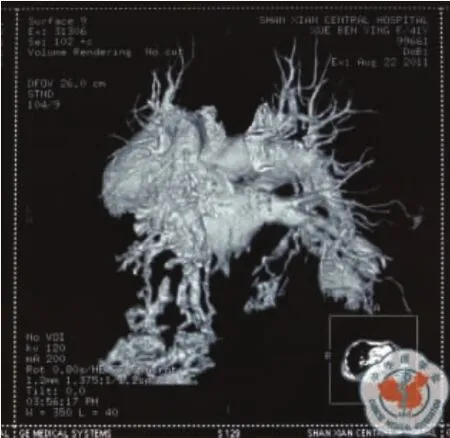
图3 CT图
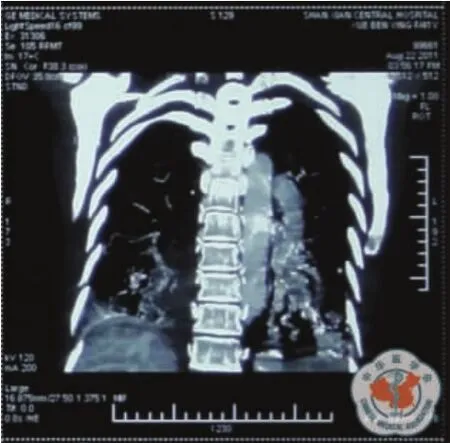
图4 CT图

图5 CT图
8月18日开始:吸氧,应用芬必得、莫沙必利片、茶碱缓释片、头孢呋辛、左氧氟沙星、多索茶碱、氨溴索;静注血凝酶(巴曲亭);19日雾化复方异丙托溴胺;8月20日浓红2U;同时胸腔闭式引流。经综合治疗,患者胸闷、憋喘、胸痛减轻,精神好转。右后背部可闻及频率与心率一致的血管杂音。8月23日12:45分患者于饮食时出现呛咳,随即出现右侧剧烈胸痛,烦躁不安,很快出现意识不清,呼吸浅慢,血压测不出,全身苍白,引流管内见较多血性液体流出,考虑肺血管畸形再次破裂出血、休克,急行气管插管,补液,低分子右旋糖酐、浓红输注,止血、心肺复苏等治疗,最终失败。
讨 论
PAVMs又称肺动静脉瘘,1897年由Churton首次报告,在临床上比较罕见[3]。PAVMs为肺末梢血管畸形,是各种原因使血管发育畸形致肺动脉分支与静脉之间有直接交通,使未经毛细血管氧合的血液由右向左分流,临床上轻者可无任何表现,重者则引起致命性大咯血。PAVMs发病率为0.02‰ ~0.03‰,男女比例1︰1.5 ~1.8[4],随着年龄增长,发病率上升,50 ~60 岁达高峰。
PAVMs可以是先天性或是后天获得,超过80%PAVMs是先天性的,少数为后天获得,如可由创伤、血吸虫病、肿瘤、长期的肝硬化、肺放线菌病等原因而引起的肺内继发改变而形成[3-4]。先天性者多因胚胎发育时肺动脉支和静脉丛间的血管间隔形成发生障碍,使毛细血管发育不全或退化,肺动脉支直接与肺静脉支相通,从而形成动静脉短路。这种肺动静脉的异常结构在患者出生和年幼时并不显著,常处于潜伏状态,但随着年龄的增长,在肺动脉压力的长期冲击作用下病变逐渐扩大,形成薄壁血管瘤囊样改变。本例患者无后天获得因素,因此考虑为先天性。2011年8月22日胸部CT可以看到后者的病变明显发展扩大,这与病变长期受来自肺动脉压力的作用有关。
PAVMs好发于双肺下叶,多为单肺病变,占50% ~75%,且多发生于左肺下叶,30%为多发病变,仅8% ~10%为双肺病变。瘘口多接近胸膜,肺实质少见[5]。与其相连的动脉血管和静脉血管,可为1条、2条或更多,病理学上分为囊状PAVMs和弥漫型PAVMs,前者又分为单纯型、复杂型。①单纯型PAVMs:最为常见,约70%以上的PAVMs是单纯型,为单个扩张的动脉瘤连接一条动脉和一条静脉,此病灶单发占多数,约8%的病变可位于双侧肺;②复杂性PAVMs:大约20%的PAVMs为复杂型,有多支供血动脉和多支引流静脉,右往左分流量较大,临床上肺内血管杂音和缺氧体征较明显;③弥漫型PAVMs少于10%,动静脉之间仅有多数细小瘘道相连,无瘤囊形成,多缺乏典型X线征象。本例患者为双侧复杂型病变,且靠近胸膜,8月23日患者于饮食时出现呛咳,引起薄壁的血管瘤囊压力增加,造成左侧再次破裂后引起血性胸腔积液,失血性休克死亡。
PAVMs可引起相应的临床表现,其程度与分流量大小直接相关[6]。①心外的右向左分流:由于未氧合的肺动脉血液通过短路进入肺静脉而至全身,导致不同的低氧血症表现,如紫绀、杵状指、易疲劳、工作负荷能力降低等,血红蛋白代偿性升高和血黏度增加,甚至可出现心力衰竭。约10%的患者有典型的三联征,即劳力性呼吸困难、紫绀、杵状指(趾);②薄壁的血管瘤囊容易破裂而引发致命性的大咯血或血性胸腔积液;③另外由于缺少了正常的毛细血管的滤过功能,导致异位栓塞而引起相应的表现,临床上常见脑梗死、短暂脑缺血发作等神经系统症状,同时有红细胞增多也易诱发脑血栓形成;5%~14%的患者可出现脑脓肿。另外PAVMs与偏头痛有一定关系,PAVMs可引起偏头痛,认为肺的右向左分流在偏头痛的发病机制上起作用[7]。本例患者有劳力性呼吸困难、紫绀、杵状指(趾)等典型的三联征,又有血性胸腔积液,但没有神经系统症状。
临床怀疑PAVMs需行影像学检查,检查目的在于明确病灶的位置、数量、大小以及供血动脉的数量、血管直径等情况,这对选择治疗方案是十分重要的,特别有助于栓塞介入治疗方案的制定。肺血管造影是诊断该病的金标准,对细小血管分辨率高,不仅显示PAVMs,还能更好地显示肺血管病变的血管结构,可直接进行介入治疗[3]。但肺血管造影检查费用高、有创伤性、患者难以接受等缺点在某种程度上限制了其应用,目前很少应用,此方法主要用于某些诊断有困难的病例或用于治疗前检查。随着CT扫描技术和后处理功能发展,近年来研究认为多排螺旋CT作为一种安全、无创、敏感性高的检查方法,能够提供与PA-DSA相同甚至更多的诊断信息(如病灶及其相关血管以外的解剖学信息),明显优于肺血管造影,可部分取代常规肺血管造影或DSA,成为确诊PAVMs的首选检查方法。
本例患者肝左、中、右三支静脉均扩张,分析原因,①与PAVMs病因相同,为先天性发育异常;②各种原因造成肝静脉回流阻力增加,压力增高而至扩张,最常见者为布加氏综合征。布加氏综合征病程多呈慢性经过,可见于任何年龄,但以20~40岁青壮年多见,由于肝静脉及下腔静脉肝段的阻塞,使肝脏出现肝窦淤血、出血、坏死等病理变化。临床表现为腹胀、肝肿大、脾肿大、腹水、食管静脉曲张等,本病因下腔静脉阻塞后,回心血流受阻,下腔静脉内压力升高,还可出现双下肢浮肿、皮肤色素沉着等其他组织和器官的功能障碍表现[8]。而本患者无相应的表现;③慢性右心功能不全可有肝肿大瘀血、肝颈静脉返流征阳性、下肢水肿等表现。本例患者也无相应的表现。结合患者患有PAVMs,肝静脉扩张为先天性发育异常的可能性较大。
PAVMs的治疗有手术和介人两种方法,介入导管栓塞法操作较简单,并发症少。可最大限度的保留正常肺组织及其功能。栓塞已成为治疗PAVMs的首选方法[9]。弥漫型PAVMs属手术禁忌证,但可行介入治疗,选择病变较重的部位进行栓塞,可改善患者的缺氧症状。Reynaud Gaubert等[10]报道肺移植可作为弥漫型PAVMs的一种治疗手段,并提出切除实质组织的传统外科手术依然是治疗巨大孤立性PAVMs的金标准。
1 刘 影,李传福,马祥兴,等.肺、肝多发性动静脉畸形1例[J].中华放射学杂志,2006,40(7):689.
2 唐敖荣.肺动静脉瘘伴有肝血管瘤样病变[J].国外医学(临床放射学分册),1984,7(1):45.
3 Sharifah AI,Jasvinder K,Rus AA.Pulmonary arteriovenous malformation:a rare cause of cyanosis in a child[J].Singapore Med J,2009,50(4):e127-e129.
4 Khurshid I,Downie GH.Pulmonary arteriovenous malformation[J].Postgrad Med J,2002,78(918):191-197.
5 周营营,胡莉娟,朱 蕾.肺动静脉畸形合并遗传性出血性毛细血管扩张症1例报告并文献复习[J].中国实用内科杂志,2007,27(21):1710-1711.
6 黄之杰,王庆旭,孙志勇.64排螺旋CT三维重建对肺动静脉畸形的诊断价值[J].西南国防医药,2009,19(7):718-720.
7 Na SJ,Cho HM,Park JS.A case of successful surgical treatment of migraine headaches in a patient with sporadic pulmonary arteriovenous malformations[J].J Korean Med Sci,2009,24(2):330-332.
8 戴少登,潘 明,李发中.布加氏综合征诊断分析[J].医药论坛杂志,2007,28(15):44-45.
9 Brian Funaki.Embolization of pulmonary arteriovenous malformations[J].Semin Intervent Radiol,2007,24(3):350-355.
10 Reynaud-Gaubert M,Thomas P,Gaubert JY,et al.Pulmonary arteriovenous malformations:lung transplantation as a therapeutic option[J].Eur Respir J,1999,14(6):1425-1428.
