活血消瘿片水提液的澄清工艺研究
2012-07-25胡俊杰吕秋霞郑国华
胡俊杰, 肖 伊, 吕秋霞, 郑国华*
(1.湖北中医药大学,湖北武汉430065;2.孝感市南区食品药品监督管理局,湖北孝感432300)
活血消瘿片是湖北省中医院根据国家名老中医陈如泉教授的经验方研制而成的医院制剂,由桃仁、莪术、柴胡、王不留行、猫爪草等八味中药组成,具有活血通络、消瘿化结之功效,临床上主要用于结节性甲状腺肿[1]。为将其开发成现代中成药,有效控制该制剂的质量,保证其临床疗效,减少服用量,本试验以浸膏得率和苦杏仁苷含有量为评价指标,对活血消瘿片水提液澄清工艺进行了研究。
1 仪器与试药
Agilent1100型高效液相色谱仪 (四元泵、紫外检测器及配套色谱工作站);ZK072型电热真空干燥箱 (上海市仪器试验总厂);Mettler-Toledo AG285型分析天平 (Mettler-ToledoGmbH,Laboratory& Weighing Technologies,Switzer-land);DZHW型调温电热套 (北京市永光明医疗仪器厂);HH-4型数显恒温水浴锅 (国华电器有限公司);KH-400-FDB型高功率数控超声波清洗器 (昆山禾创超声仪器有限公司)。苦杏仁苷对照品 (中国药品生物制品检定所批号:110820-200403),甲醇、磷酸为色谱纯,水为自制重蒸水,其余试剂均为分析纯。处方中各药材经湖北中医药大学生药学教研室鉴定均为正品。
2 评价指标
以浸膏得率和苦杏仁苷含有量作为澄清工艺筛选的考察指标。
2.1 浸膏得率的测定 精密量取提取液25 mL,置于已干燥至恒质量的蒸发皿中,水浴上蒸干后,置真空干燥箱中,60℃恒温减压干燥36 h至恒质量,移至干燥器中,冷却30 min,迅速精密称定质量,计算,即得。
浸膏得率 =(浸膏质量 /原药材的质量)×100%
2.2 苦杏仁苷测定[2]
2.2.1 色谱条件 Aichrom Bond-AQ C18色谱柱 (4.6 mm×250 mm,5 μm),检测波长210 nm,柱温30℃,流动相甲醇-0.1%磷酸 (20∶80),体积流量1 mL/min。
2.2.2 对照品溶液的制备 精密称取减压干燥至恒质量的苦杏仁苷对照品6.45 mg,置25 mL量瓶中加70%甲醇溶液溶解并稀释至刻度,配成质量浓度为0.258 mg/mL的对照品溶液。
2.2.3 供试品溶液的制备与测定 精密量取提取液5 mL,水浴挥干,残渣用70%甲醇溶解并转移至25 mL量瓶中,用70%甲醇稀释至刻度,超声5 min,用微孔滤膜 (0.45 μm)滤过,取续滤液作为供试品溶液。精密吸取供试品溶液各10 μL,注入高效液相色谱仪,测定峰面积,代入线性回归方程,计算,即得。
2.2.4 标准曲线的建立 精密量取对照品溶液0.5、1、2、3、4、5 mL,置5 mL量瓶中,用甲醇溶液稀释至刻度,摇匀,按上述色谱条件测定。以峰面积积分值 (Y)对进样量 (X)进行线性回归,得回归方程为:Y=877.4376X-8.6077,r=0.99998。结果表明,苦杏仁苷在0.258~2.580 μg的范围内与峰面积积分值呈良好线性关系。
2.2.5 精密度试验 精密量取同一对照品溶液10 μL,按上述色谱条件,重复进样6次,测定峰面积积分,结果RSD为0.61%(n=6),表明仪器精密度较好。
2.2.6 回收率实验 采用加样回收法取样品6份,精密加入苦杏仁苷对照品溶液适量,测定峰面积积分,结果苦杏仁苷平均回收率为98.38%,RSD为1.06%(n=6)。
2.2.7 稳定性试验 对同一供试品溶液分别在0、3、6、9、24 h进样,测定其峰面积积分。结果RSD为1.21%,表明供试品溶液在24 h内稳定。
2.2.8 重复性试验 精密称取同一批样品6份,按2.2.3项下方法制备与测定。结果RSD为0.51%(n=6),表明方法重复性良好。
2.2.9 空白试验 以缺桃仁药材的空白样品按供试品溶液的制备与测定,结果见图1,在与苦杏仁苷相同位置无色谱峰出现,表明阴性对照试验对本品的测定无干扰。
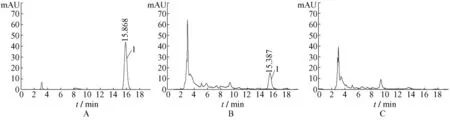
图1 高效液相色谱图
3 实验方法和结果
3.1 药材原提取液的制备与各指标的测定 取莪术、柴胡提取完挥发油后的滤渣与桃仁、王不留行、猫爪草按处方比例混合,按最佳水提工艺 (加8倍量水、浸泡0.5 h、提取3次、每次1.5 h)要求制得水提液,备用。测得浸膏得率为21.69%;浸膏中苦杏仁苷质量分数为1.58%(n=3)。
3.2 乙醇沉淀法[3]为了除去杂质并最大限度地保留有效成分,减小服用剂量,在浓缩的水提液中加入适量乙醇以除去其中的淀粉、树胶等多糖类和蛋白质等杂质,采用单因素试验对醇沉过程中的主要影响因素 (药液浓缩比例、醇沉浓度)进行考察。
3.2.1 药液浓缩比例的考察 取水提液,分别浓缩成 (生药∶水 =g∶mL)2∶1、1.5∶1、1∶1、1∶1.5、1∶2,加入95%乙醇,边加边搅拌,使醇沉浓度达到80%,4℃静置24 h,滤过。滤液按2.1项和2.2项下方法测定浸膏得率和苦杏仁苷含有量,计算浸膏中苦杏仁苷含有量,结果见表1。
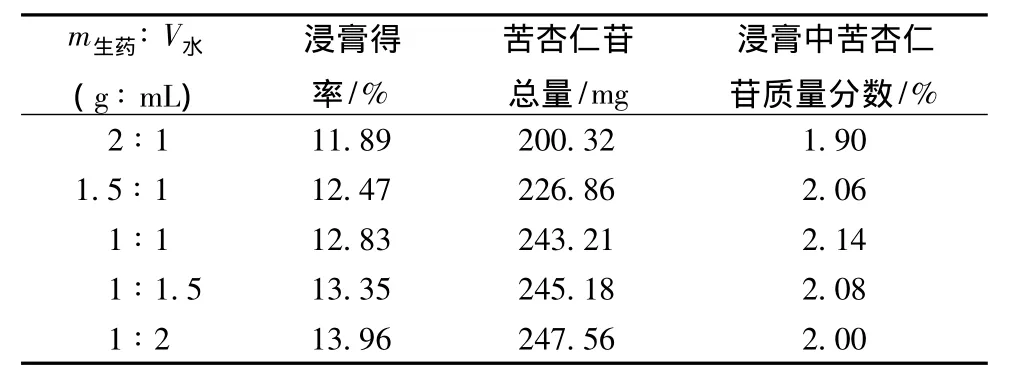
表1 药液浓缩比例的考察结果 (n=3)
表1结果表明:随着药液浓缩比例的减小,浸膏得率和苦杏仁苷总量增加,而浸膏中苦杏仁苷的含有量先增大后减小,当药液浓缩成 (m生药∶V水)为1∶1时,浸膏中的苦杏仁苷含有量最高,因此我们选择药液浓缩比为1∶1。
3.2.2 醇沉浓度的考察 取m生药∶V水=1∶1(g∶mL)水提浓缩液,分别加入95%乙醇适量,边加边搅拌,使各浓缩液醇沉体积分数分别为40%、50%、60%、70%、80%,4℃静置24 h,滤过。滤液按2.1项和2.2项下方法测定浸膏得率和苦杏仁苷含有量,计算浸膏中苦杏仁苷含有量,结果见表2。
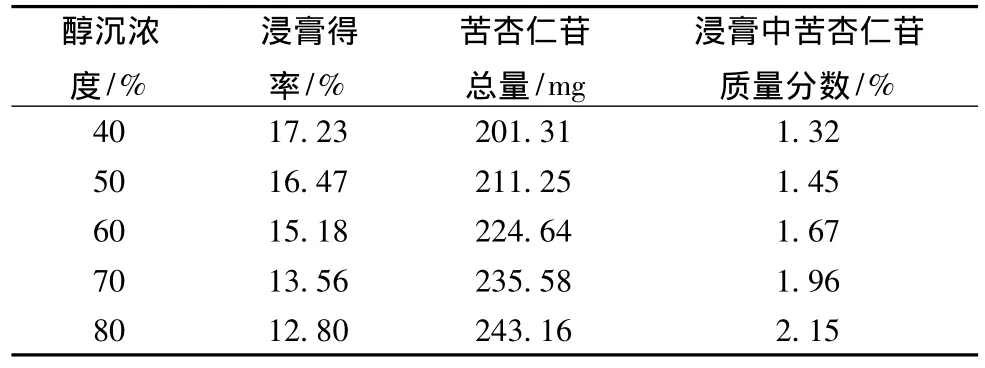
表2 不同浓度醇沉澄清的考察结果 (n=3)
由表2可见,随着醇沉体积分数的增大,浸膏得率减小,苦杏仁苷总量和浸膏中苦杏仁苷的含有量增大,并结合实际生产的需要,我们选择醇沉体积分数为80%。
3.3 壳聚糖澄清技术[4-6]壳聚糖澄清技术为近年来发展起来的一种新的中药纯化方法,具有来源广泛、毒副作用小、生产成本低等优点。因此我们考察了药液浓缩比例、壳聚糖的浓度、壳聚糖的用量、澄清温度等因素对水提液澄清效果的影响。
3.3.1 药液浓缩比例的考察 取水提液,分别浓缩成m生药∶V水(g∶mL)为1∶4、1∶6、1∶8、1∶10、1∶12,放冷至室温,分别于搅拌下按0.8 mL/(g生药)的量加入新鲜配制的1%的壳聚糖溶液,继续搅拌10 min,静置12 h,滤过。滤液按2.1项和2.2项下方法测定浸膏得率和苦杏仁苷含有量,计算浸膏中苦杏仁苷含有量。结果见表3。
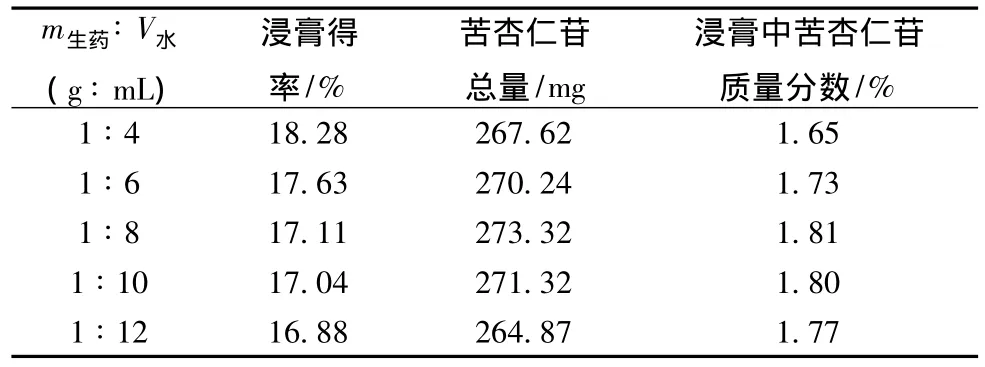
表3 药液浓缩比例的考察结果 (n=3)
由表3可见,苦杏仁苷总量和浸膏中苦杏仁苷的含有量随着药液浓缩比例减小先增大后减小,当药液浓缩比例为m生药∶V水=1∶8时,苦杏仁苷总量和浸膏中苦杏仁苷的含有量均到达最大值,因此选择药液浓缩比例为m生药∶V水(g∶mL)=1∶8。
3.3.2 壳聚糖溶液浓度的考察 取水提液,浓缩至m生药∶V水(g∶mL)为1∶8,放冷至室温,分别于室温搅拌下加入配好的0.25%、0.5%、1.0%的壳聚糖溶液,至溶液中有絮状沉淀产生,继续搅拌10 min,静置12 h,滤过。滤液按2.1项和2.2项下方法测定浸膏得率和苦杏仁苷含有量,计算浸膏中苦杏仁苷含有量。结果见表4。
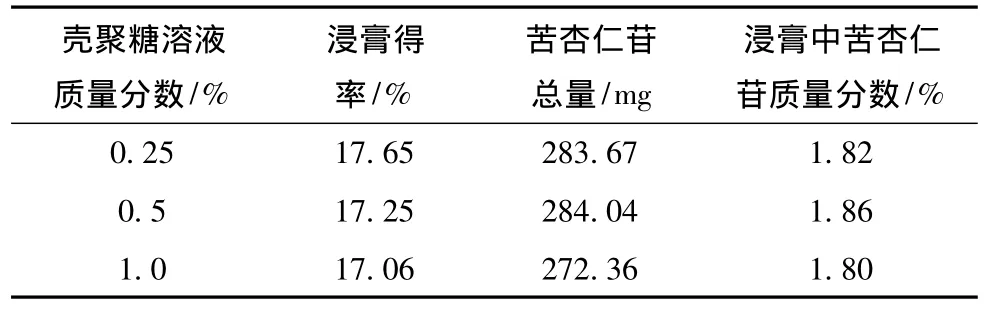
表4 壳聚糖溶液浓度的考察结果 (n=3)
由表4可知,壳聚糖溶液质量分数为0.5%时,苦杏仁苷总量和浸膏中苦杏仁苷的含有量较高,而且在实验过程发现,常用的1%壳聚糖溶液较为黏稠,溶胀时间长,也不方便操作,因此我选择壳聚糖溶液质量分数为0.5%。
3.3.3 壳聚糖用量的考察 取水提液,浓缩至m生药∶V水(g∶mL)为1∶8,放冷至室温,分别于室温搅拌下按0.4、0.8、1.2、1.6、2.0 mL/(g生药)的量加入新鲜配制的0.5%壳聚糖溶液,继续搅拌10 min,静置12 h,滤过。滤液按2.1项和2.2项下方法测定浸膏得率和苦杏仁苷含有量,计算浸膏中苦杏仁苷含有量。结果见表5。
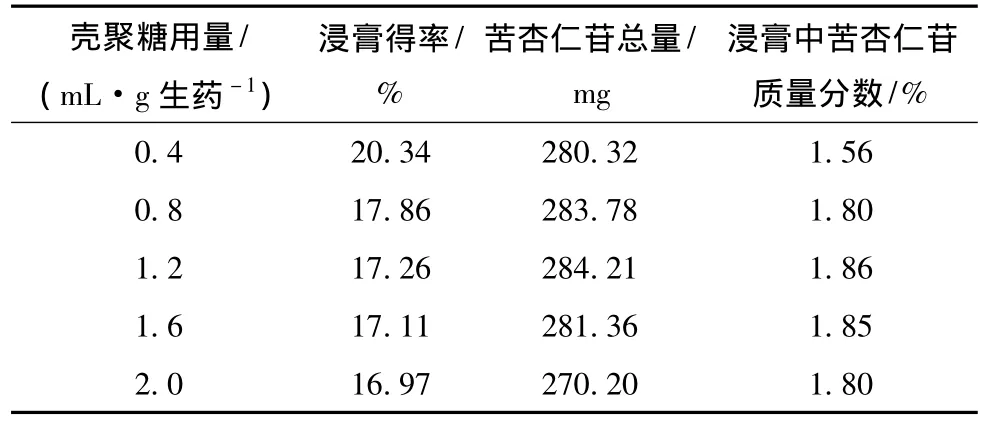
表5 壳聚糖用量的考察结果 (n=3)
表5结果表明:苦杏仁苷总量和浸膏中苦杏仁苷的含有量随着壳聚糖用量的增加先增大后减小,当壳聚糖的用量为1.2 mL/(g生药)时,苦杏仁苷的含有量均到达最大值,因此选择壳聚糖的用量为1.2 mL/(g生药)。
3.3.4 壳聚糖澄清温度的考察 取水提液,浓缩至m生药∶V水(g∶mL)为1∶8,分别于室温25℃、水浴40℃ 、50℃、60℃、70℃搅拌条件下按1.2 mL/(g生药)量加入新鲜配制的0.5%壳聚糖溶液,继续搅拌10 min,静置12 h,滤过。滤液按2.1项和2.2项下方法测定浸膏得率和苦杏仁苷含有量,计算浸膏中苦杏仁苷含有量。结果见表6。
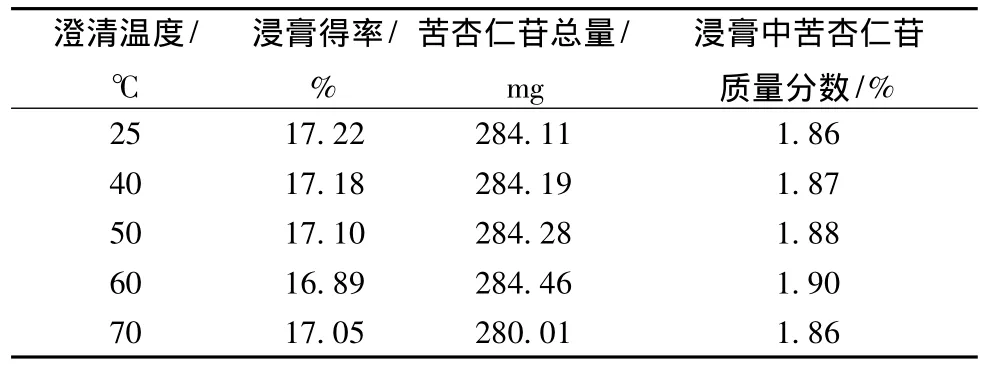
表6 壳聚糖澄清温度的考察结果 (n=3)
表6表明:苦杏仁苷总量和浸膏中苦杏仁苷的含有量随着澄清温度的升高而缓慢增大,实验中澄清时间也随着温度升高而缩短,温度升高到70℃时苦杏仁苷的含有量有下降的趋势,从节省澄清时间和操作方便考虑,我们最终选择澄清温度为60℃。
3.3.5 澄清静置时间的考察 取水提液,浓缩至m生药∶V水(g∶mL)为1∶8,分别于水浴60℃搅拌下按1.2 mL/(g生药)量加入新鲜配制的0.5%壳聚糖溶液,继续搅拌10 min,分别静置4、8、12、16、24 h,滤过。滤液按2.1项和2.2项下方法测定浸膏得率和苦杏仁苷含有量,计算浸膏中苦杏仁苷含有量。结果见表7。
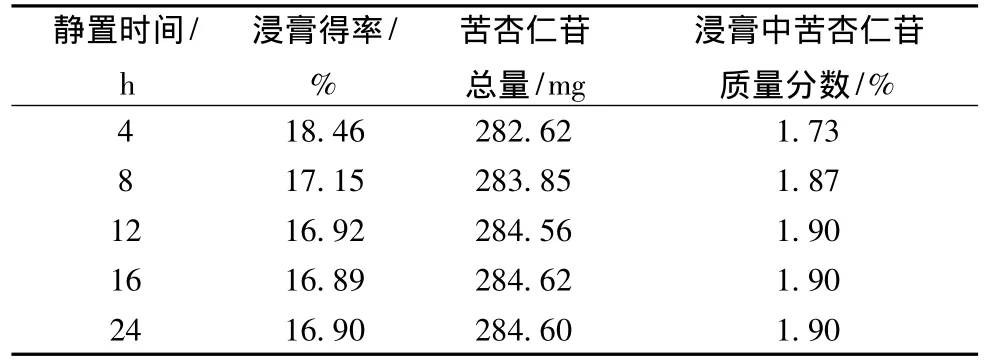
表7 澄清静置时间的考察结果 (n=3)
表7表明:苦杏仁苷总量和浸膏中苦杏仁苷的含有量随着澄清静置时间的延长而增大,到达静置12 h时,含有量基本持平,为了节约时间,我们最终选择澄清静置时间为12 h。
3.4 壳聚糖澄清技术与醇沉工艺的比较
3.4.1 醇沉处理液与壳聚糖澄清剂处理液的制备 精密量取3份1∶1的活血消瘿片水提浓缩液,加乙醇使含醇量达80%,搅匀,静置12 h,滤过,得醇沉的处理液。精密量取3份1∶8的水提浓缩液,在水浴60℃条件下,按1.2 mL/(g生药)的量加入0.5%的壳聚糖溶液,静置12 h,滤过,得壳聚糖澄清液。
3.4.2 固形物保留率、苦杏仁苷保留率的比较 取水提液及以上两种纯化后的处理液,按2.1项和2.2项下方法测定浸膏得率和苦杏仁苷含有量,计算浸膏中苦杏仁苷含有量。结果见表8。

表8 壳聚糖澄清技术与醇沉工艺的比较结果 (n=3)
4 讨论
4.1 将壳聚糖澄清技术与醇沉工艺结果进行比较,壳聚糖澄清技术处理的样品苦杏仁苷保留率及浸膏保留率均比醇沉工艺高,溶液也较澄清;醇沉工艺处理的样品浸膏中苦杏仁苷含有量比壳聚糖澄清技术处理的样品高0.23%,相差不大。考虑到水提醇沉这一中药制药传统工艺,其存在成本高、成品稳定性差、生产周期长、劳动强度高等缺点,而且在醇沉过程中,易于把中药中的无机成分、部分多糖除去,难以保证制剂的有效性。研究已证实了中药所含微量元素与药效、药性、归经及临床疗效之间存在密切联系,不能忽视中药所含微量元素的作用[7];过去被认为是杂质的多糖类也已被证实具有增强免疫作用和多种生物活性[8],我们最终选择壳聚糖澄清技术作为活血消瘿片水提液的澄清工艺。
4.2 絮凝澄清法是在中药提取液或提取浓缩液中加入一种澄清剂以吸附架桥及电中和方式除去溶液中的粗粒子,以达分离纯化的目的。絮凝剂的种类很多,有壳聚糖、鞣酸、明胶、101果汁澄清剂、ZTC澄清剂等,但目前应用最广泛的是壳聚糖澄清剂。壳聚糖为甲壳类动物、昆虫和其他无脊椎动物外壳中的甲壳质脱乙酰化而制得,是生物界唯一的聚阳离子多糖。壳聚糖可明显使带负电性悬浮颗粒反应后凝集、沉淀,去除药液中的较大颗粒提高制剂稳定性及澄明度[9]。
4.3 本实验根据组方中主要有效成分和可量化指标,特选苦杏仁苷含有量、浸膏得率作为澄清效果指标,以保证筛选结果的客观准确。
4.4 苦杏仁苷的测定采用高效液相色谱法,经方法学考察,除阴性无干扰和线性好外,精密度高,重现性、稳定性及回收率均较好,其操作简便、灵敏,测得结果准确。
[1]吴淑琼,左新河,陈如泉,等.活血消瘿片治疗结节性甲状腺肿的临床价值[J].武汉大学学报:医学版,2010,31(3):394-397.
[2]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:260-261.
[3]李 静,张 伟,秦冬梅,等.正交试验法优选健儿消食口服液醇沉工艺的研究[J].中成药,2011,33(4):705-708.
[4]颜 红,夏新华,严建业,等.乙肝宁颗粒絮凝澄清工艺与醇沉工艺的比较研究[J].中成药,2009,31(2):221-223.
[5]李红卫,李 平,骆 勤,等.乳病消片水提液澄清工艺研究[J].中国药房,2009,20(24):1862-1864.
[6]冯年平,郁 威.中药提取分离技术原理与应用[M].北京:中国医药科技出版社,2005:150-176.
[7]曹治权.微量元素与中医药[M].北京:中国中医药出版社,1993.
[8]钱 青,张志勇.植物活性多糖的药理作用及应用研究进展[J].华西医学,2009,24(1):250-252.
[9]张三平.吸附澄清剂在中药制剂中的应用研究[J].中国药房,2008,19(6):461-463.
