IL1B启动子区多态性与癌症风险的meta分析
2012-07-24陈丽萍顾玲聂珍琳许晔琼李瑞高天翼宋国齐王书奎
陈丽萍,顾玲,聂珍琳,许晔琼,李瑞,高天翼,宋国齐,王书奎
1.南京师范大学;2.南京医科大学附属南京第一医院 中心实验室,江苏南京 210006
IL1B启动子区多态性与癌症风险的meta分析
陈丽萍1,2,顾玲1,2,聂珍琳2,许晔琼2,李瑞1,2,高天翼2,宋国齐2,王书奎2
1.南京师范大学;2.南京医科大学附属南京第一医院 中心实验室,江苏南京 210006
IL1B(Interleukin 1 beta)是一种对抗感染的前炎症因子,在肿瘤的发生发展中起着重要的作用。IL1B基因启动子区-31C/T多态性位点通过影响IL1B的转录参与癌症的发生。针对已有的研究存在结论不一致的现状,为了阐明两者之间的关系,我们对47篇发表的病例对照研究进行meta分析,其中包括11125病例和14415例对照。比值比(Odds Ratio,OR)和95%可信区间(CI)用来评估多态性位点与癌症风险的关联程度。在所有的对比中没有发现此多态性位点与所有癌症相关联。通过分层分析发现,携带C等位基因的个体比不带C等位基因的个体患肝癌的风险低(CC vs TT:OR=0.87,95%CI:0.77~0.98,Pheterogeneity=0.103;TC vs TT:OR=0.77,95%CI:0.62~0.95,Pheterogeneity=0.734;TC+CC vs TT:OR=0.74,95%CI:0.61~0.91,Pheterogeneity=0.472 ) 。 同 样, C/C 基 因 型 个体 相 比 T/T 基 因 型 个 体患 胃 癌 风 险 低( OR=0.87 ,95%CI:0.77~0.98,Pheterogeneity=0.103)。运用隐性模型,患胃癌的风险显著下降(OR=0.88,95%CI: 0.80 ~ 0.97 ,Pheterogeneity=0.158 ) , 在 欧 洲 人 群 ( OR=0.84 , 95%CI: 0.73 ~ 0.97 ,Pheterogeneity=0.070)和感染-配对研究(OR=0.75,95%CI:0.60~0.94,Pheterogeneity=0.220)中都发现有显著下降的风险;在乳腺癌中有显著增加的风险(OR=1.34,95%CI:1.18~1.61,Pheterogeneity=0.116)。虽然一些适度偏倚不能消除,此meta分析显示IL1B-31C基因型是癌症发生的保护因素,特别是在感染人群中。
meta分析;癌症;IL1B
0 前言
炎症被认为是参与 癌症发生的重要因素[1-2]。白细胞介素类(ILs)是由单核细胞、巨嗜细胞和上皮细胞产生的前炎症细胞因子,在对抗感染中起着重要的作用。IL1家 族 包 括 IL1a、IL1β 和 IL-1 受 体 拮 抗 剂(IL-1Ra)[3],是固有免疫系统中的重要成员。IL1β 不仅是宿主遗传因子,也是一种重要的前炎症细胞因子,能够调节一些参与炎症反应的分子表达[4]。如 IL1B 启动子区 TATA 盒中 -31T/ C 替 换 显 著 影 响 其 与 一 些 转 录 因 子 的 结 合[5-7], 进 而 影响 IL1B 的转录 活性[6]。在启 动子区两 个重要的 多态性位点 -31T/C(rs1143627)和 -511C/T(rs16944) 是胃癌 发生的风险因素[5]。一些流行病学研究发现这些多态性位点与多种癌症关联,包括肺癌[8]、乳腺癌[9]、肝癌[10],结直肠癌[11]和卵巢癌[12]。但这些结论是有争议的[13-15],部分是由于小的样本量、 种 族 间 基 因 型 分 布的差异[16]、 研 究设计、测定方法等。一些研究证实了在欧洲和亚洲人群中IL1B-31T 等位基因与 -511C 密切关联[17-22]。鉴于 IL1B 多态性的重要性,我们对 IL1B-31 与癌症风险进行了 meta分析。
1 材料和方法
1.1 文献检索与质量评估
以关键词“interleukin-1”“L-1”“polymorphism”“tumour”和“carcinoma” 检 索 PubMed、 EMBASE 和 Cochrane 数据库。检索时间至 2010 年 12 月 23 日。文献检索限制为英文文献和人类相关的研究。同时手工查阅文献并对纳入文献的参考文献进行追溯以保证信息全面,如遇试验报告不详或资料缺乏,通过信件与作者联系获取。当出现一个以上相同或重叠的人口数据,或由同一作者研究的重叠数据,仅在最近或最完整的研究用于这项 meta 分析。研究无论样本大小,按照以下纳入标准纳入文献 :① IL1B-31T/ C多态性与癌症风险的研究 ;② 对照组基因型频率分布符合Hardy-Weinberg 遗传平衡检验 ;③ 可用的基因型频率。
1.2 数据提取
由两人按照纳入标准独立进行数据提取并对任何争议达成共识。对于每项研究,收集以下信息:第一作者姓氏、出版年份、国家、种族、病例组和对照组各基因型人数、对照组的来源、基因分型方法和癌症类型。种族分为欧洲、亚洲和非洲裔或混合的种族。对于没有3种基因型数据的研究,仅计算 IL1B-31 显性遗传模型的比值比(OR)[23]。
1.3 统计分析
OR 值和 95%可信区间(CI)用来评价 IL1B-31 与癌症的风险。相比野生型 T/T 等位基因纯合子,C 等位基因携带者(T/C 和 C/C 基因型)患癌症的风险分别通过显性(T/C + C/C vs T/T)和隐性效应模型(C/C vs T/C+T/T)评估。分层分析分别在种族、研究方法和癌症类型中进行(如果一种癌症类型包含少于 3个独立的研究,纳入“其他癌症”组)。
通过Z检验来检测合并OR值的统计学意义,当P<0.05 时有统计学意义。对纳入的文献首先进行异质性检验,异质性的评估通过基于 Q 检验的 χ2检验[24],当 P<0.1被认为是显著的。如果各项研究间一致性较好则采用固定效应模型(Mantel-Haenszel法),如果存在异质性则采用随机效应模型(D-L 法)计算合并 OR 值及其 95%CI并做森林图。敏感性分析,通过每次剔除不同研究对整体合并OR值的影响来判断结果的可信性。发表偏倚通过漏斗图和Egger线性回归模型检验。采用χ2检验对每项研究中对照组的基因型分布进行 Hardy-Weinberg 遗传平衡检验,基于网络程序(http∶//ihg.gsf.de/cgi-bin/hw/hwa1.pl)。各分析均采用 Stata10 软件(Stata Corporation, College Station, TX, USA)、审查管理器 4.2 版(The Cochrane Collaboration, Oxford, UK)。
1.4 主要方法
本文中所纳入的文献主要运用了以下5种测序方法:
(1)聚合酶链反应和限制性片段长度多态性(PCRRFLP):是用 PCR 仪扩增目的 DNA 片段,扩增产物用特异性识别多态性位点的内切酶消化切割成不同大小片段,经过凝胶电泳,在凝胶成像与分析系统上分辨。
(2)Taqman :每检测 1 个 SNP 位点需要 1 对 Taqman探针和1条位于待测位点上游的引物。这对探针序列仅区别于多态性位点,两端分别标记1个荧光发射基团和1个荧光淬灭基团,探针完整时,发射基团发射的荧光信号被淬灭基团吸收 ;PCR 扩增时,Taq 酶的 5’-3’外切酶活性将探针酶切降解,使荧光发射基团和荧光淬灭基团分离,从而荧光监测系统可接收到荧光信号。如果探针与目标序列间存在错配,就会大大减少荧光的释放量。
(3)直接测序法:是诊断未知突变基因最直接的方法,由于 PCR 技术的应用,使得 DNA 测序技术从过去的分子克隆后测序进入 PCR 直接测序。PCR 产物在自动测序仪上电泳后测序。常用方法有 :Sanger双脱氧末端终止法 ;Maxam-Gilbert化学裂解法 ;DNA 测序的自动化。目前DNA 测序全自动激光测定法是最先进的方法。
(4)单链构象多态性(SSCP):是一种基于单链 DNA构象差别的点突变检测方法。相同长度的单链DNA如果顺序不同,甚至单个碱基不同,就会形成不同的构象。在电泳时泳动的速度不同。将 PCR 产物经变性后,进行单链DNA凝胶电泳时,靶DNA 中若发生单个碱基替换等改变时,就会出现泳动变化,多用于鉴定是否存在突变及诊断未知突变。
1.5 主要仪器设备
仪器 型号 厂商
温度梯度PCR扩增仪 Mastercycler5331 Eppendorf公司
核酸电泳系统 170-4486 BIO-RAD电流系统组合
凝胶成像分析系统 EC3 300 UVP
荧光定量PCR仪 Prism® 7500 美国应用生物系统公司(ABI)
ABI基因分析仪 3130/3130xl 美国应用生物系统公司(ABI)
2 结果
2.1 文献基本情况
共有 47 个研究达到预设的入选标准,包括 11125 个病例和 14415 个对照。所有研究是病例对照研究,其中癌症类型分类包括 26 篇胃癌、4 篇肝癌、4 篇乳腺癌和 13篇归类为“其他癌症”的研究。种族分类包括 25篇亚洲后裔、21 篇欧洲后裔、1 篇混合种族[27]。癌症大多经过病理组织学诊断,其中 12 和 17 篇研究分别运用了 TaqMan方法和 PCR-RFLP 方法。此外,大部分的对照性别和年龄与病例组相匹配,其中有 29篇文献中对照组是以健康人群为基础的,18篇是以医院病人为基础的。此外,7篇研究是调查多态性与感染状况之间的相互作用的配对病例 - 对照研究[18,20,22,27-30]。 所 有 研 究 的 对照组基因型分布没有偏离 Hardy-Weinberg 遗传学平衡。
2.2 Meta分析
观察不同种族间 IL1B-31T 等位基因频率。T 等位基因频率在亚洲对照组为 50.54%(95%CI:46.78~54.29),显著低于欧洲对照(58.06% ;95%CI:52.48~63.63,P=0.022),见图1。
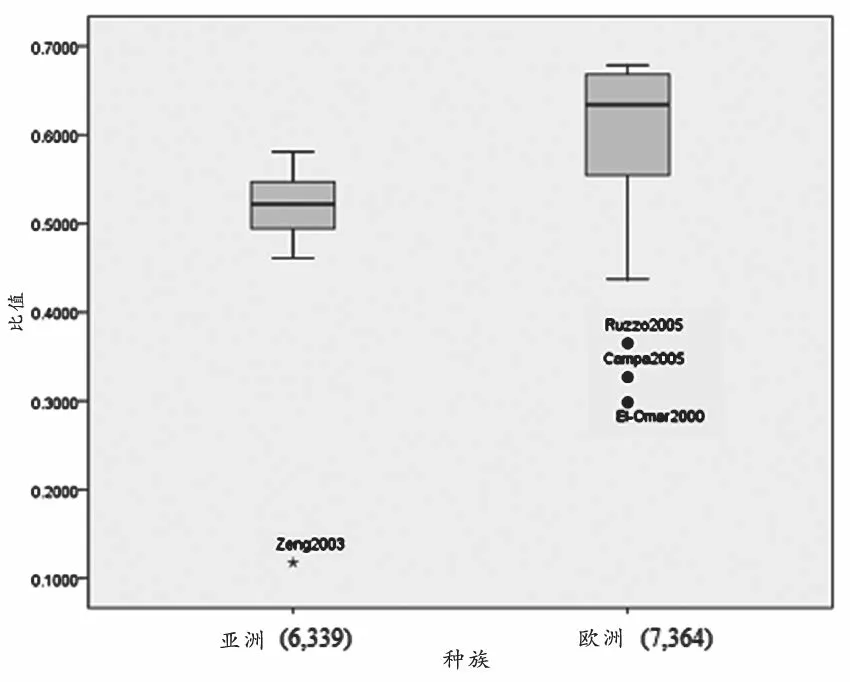
图1 IL1B-31T/C多态性位点基因频率在对照组中种族差异的墨盒图
总体而言,在任何比较中 IL1B-31T/C 和癌症的风险之间无关联。对于纯合子相比的数据,亚组分析显示,IL1B-31T/C 多 态 性 位 点 基 因 能 显 著 降 低 胃 癌(OR=0.87,95%CI :0.77~0.98,Pheterogeneity=0.103) 和 肝 癌(OR=0.68,95%CI:0.52~0.89,Pheterogeneity=0.172) 的 风 险。 在 杂 合 子比 较模型(TC vs TT)和显性 模 型 中(TC+CC vs TT)观 察到同样地能够显著降低肝癌的风险(OR=0.77,95%CI:0.62~0.95,Pheterogeneity=0.734 ;OR=0.74,95%CI :0.61~0.91,Pheterogeneity=0.472)。 相 反, 隐 性 模 型 的 比 较(CC vs TT+TC)显 著 降 低 胃 癌 的 风 险(OR=0.88,95%CI:0.80~0.97,Pheterogeneity=0.158), 同 时 也 降 低 了 在 欧 洲 人 群 中 的 发 病率(OR=0.84,95 %CI :0.73~0.97,Pheterogeneity=0.070)。 在乳 腺 癌 亚 组 中 风 险 增 加(OR=1.34,95%CI:1.18~1.61,Pheterogeneity=0.116),见表 1。
2.3 基因与环境相互作用
有7篇报告调查研究了感染幽门螺旋杆菌的胃癌与感染C型肝炎或B型肝炎病毒的肝癌的病例和感染匹配的对照组的 -31T/C 基因型分布。T 等位基因携带者感染人群相对非感染人群有较高的患癌风险(OR=0.75,95%CI:0.60~0.94,Pheterogeneity=0.220),见表 1、图 2。
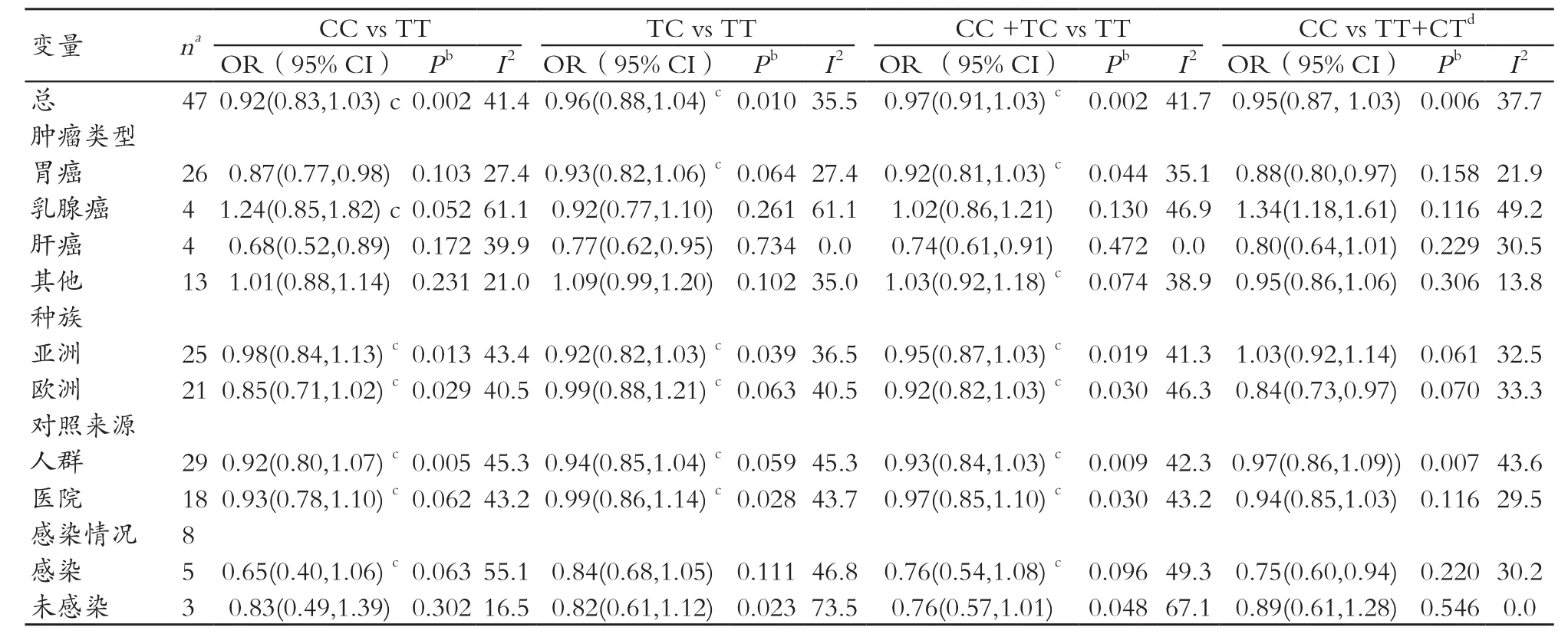
表1 统计分析IL1B-31T/C多态性与癌症相关性

图2 IL1B-31T/C 多态性(CC vs TC+TT) 与癌症风险的森林图
2.4 异质性试验
整个研究在整体比较有显著的异质性。以杂合子比较模型(TC vs TT)从肿瘤种类、种族和对照组来源 3 方面探讨异质性的来源。结果显示癌症类型(χ2=10.73,自由度(d.f.)=3,P=0.013)并非种族(χ2=2.25,d.f. = 1, P = 0.134)和对照来源 (χ2= 0.75,d.f. =1,P= 0.387)对异质性有显著影响。
2.5 敏感性分析
敏感性分析表明,4个独立的研究是异质性的主要来源,两个胃癌项研究[5,27]、两个涉及宫颈癌[31]和慢性淋巴细胞白血病研究[32]。当这 4 个研究删除时异质性下降(CC vs TT :Pheterogeneity=0.126,TC vs TT :Pheterogeneity=0.232,TC vs TT :Pheterogeneity= 0.232, TC+CC vs TT :Pheterogeneity= 0.199,CC vs TT+ TC :Pheterogeneity= 0.191)。此外,根据灵敏度分析没有其他的单一研究发现影响合并OR值。
2.6 发表偏倚
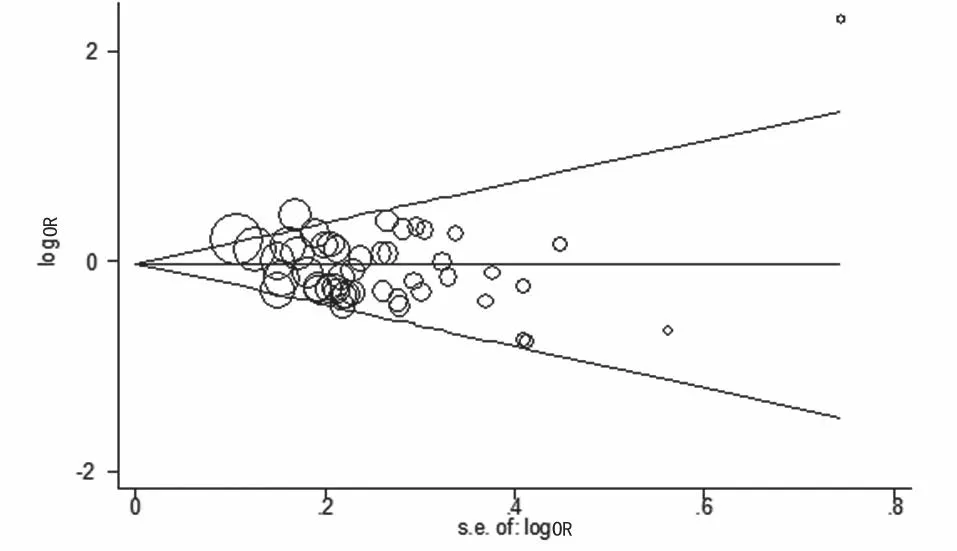
图3 Begger,s发表偏倚检测漏斗图
3 讨论
meta 分析中未发现 IL1B-31T/C 多态性增加癌症发生的风险。对癌症类型进行分层分析发现,在肝癌中C等位基因携带者(即TC和CC)患癌风险降低,T等位基因携带者(即TT 和 TC)和欧洲人群患胃癌的风险增加。鉴于 IL-1B 在调控几种炎症反应分子中的重要作用,IL1B-31T/C 多态性可能参与癌症的发生。
IL-1 在乳腺癌、结肠癌、肺癌、头颈部癌和黑色素瘤中表达升高,高表达 IL-1 的肿瘤患者相对那些没有高表达的 患者预 后 差[33-34]。IL1B-31T 等位 基 因 相 对于 IL1B-31C高表达 IL1B,致使患上癌症的风险增加[33-37]。在本研究中,发现 -31T/C 多态性与患肝癌的风险相关,但并非乳腺癌,表明 IL1B-31T/C 多态性在不同类型的癌症中作用机制不同。在胃癌和肝癌中,隐性模型比较感染-对照研究表明细菌或病毒感染在癌症发生中起着重要的作用[38-44]。此外,3 篇被纳入的肝癌研究均是感染对照匹配的,显示 IL1B-31T/C 可以增强由细菌或病毒感染引起的癌症风险。此外,研究还显示,感染或炎症患者血浆 IL1B 浓度升高,显示了IL1B 在癌症中的重要作用[45]。
另一方面,-31C 等位基因是乳腺癌的风险因素,见表 1。相比肝癌和胃癌,感染不是患乳腺癌的主要因素[46-48],在乳腺癌细胞中 IL1B 可能与雌激素受体结合导致转录激活[49]。Ito等[50]发现 T 等位基因在绝经后妇女乳腺癌的发生中有保护作用,她们对 IL1B 更敏感但雌激素水平低,表明 IL1B 在乳腺癌的发生中发挥重要的作用。但从 meta 分析得出的结果应谨慎解释。① 虽然对合格的研究进行了总结,样本总数可能不足以得出一个令人信服的结论。当分层分析肿瘤的类型、种族或感染状况时,每组的人数更少一些 ;② 由于缺乏原始数据,没有进一步评估潜在的基因-基因和基因 - 环境相互作用关系 ;③ 发表的研究报告的数量不够进行完整的分析,特别是对所有类型的癌症。尽管存在这些缺陷,这个 meta 分析还是具有一定的优势。如病例组和对照组的数量通过汇集研究,能显著增加统计力量。此外,没有检测到发表偏倚。
总之,此 meta 分析表明 IL1B-31T/C 多态性在感染相关的癌症中可能有遗传易感性,如胃癌和肝癌。但进一步的研究需要阐明 1ILB-31T/C 多态性在癌症病因中发挥的作用。
[1] Coussens LM,Werb Z.Inflammation and cancer[J].Nature,2002, 420(6917):860-867.
[2] Mantovani A,Allavena P,Sica A,et al.Cancer-related inflammation[J].Nature,2008,454(7203):436-444.
[3] Demeter J,Messer G,Ramisch S,et al.Polymorphism within the second intron of the IL-1 receptor antagonist gene in patientswith hematopoietic malignancies[J].Cytokines Mol Ther,1996, (2):239-242.
[4] McColl KE,El-Omar E.How does H. pylori infection cause gastric cancer?[J].Keio J Med,2002,51(2):53-56.
[5] El-Omar EM,Carrington M,Chow WH,et al.Interleukin-1 polymorphisms associated with increased risk of gastric cancer[J].Nature,2000,404(6776):398-402.
[6] Chen H,Wilkins LM,Aziz N,et al.Single nucleotide polymorphisms in the human interleukin-1B gene affect transcription according to haplotype context[J].Hum Mol Genet,2006,15(4):519-529.
[7] Lind H,Haugen A,Zienolddiny S.Differential binding of proteins to the IL1B-31 T/C polymorphism in lung epithelial cells[J].Cytokine,2007,38(1):43-48.
[8] Zienolddiny S,Ryberg D,Maggini V,et al.Polymorphisms of the interleukin-1 beta gene are associated with increased risk of nonsmall cell lung cancer[J].Int J Cancer,2004,109(3):353-356.
[9] Liu J,Zhai X,Jin G,et al.Functional variants in the promoter of interleukin-1beta are associated with an increased risk of breast cancer: a case-control analysis in a Chinese population[J].Int J Cancer,2006,118(10):2554-2558.
[10] Hirankarn N,Kimkong I,Kummee P,et al.Interleukin-1beta gene polymorphism associated with hepatocellular carcinoma in hepatitis B virus infection[J].World J Gastroenterol,2006,12(5): 776-779.
[11] Ito H,Kaneko K,Makino R,et al.Interleukin-1beta gene in esophageal, gastric and colorectal carcinomas[J].Oncol Rep,2007,18(2):473-481.
[12] Hefler LA,Ludwig E,Lebrecht A,et al.Polymorphisms of the interleukin-1 gene cluster and ovarian cancer[J].J Soc Gynecol Investig,2002,9(6):386-390.
[13] Campa D,Hung RJ,Mates D,et al.Lack of association between polymorphisms in inammatory genes and lung cancer risk[J].Cancer Epidemiol Biomarkers Prev,2005,14(2):538-539.
[14] Hefler LA,Grimm C,Lantzsch T,et al.Interleukin-1 and interleukin-6 gene polymorphisms and the risk of breast cancer in Caucasian women[J].Clin Cancer Res, 2005,11(16):5718-5721.
[15] Kupcinskas L,Wex T,Kupcinskas J,et al.Interleukin-1B and interleukin-1 receptor antagonist gene polymorphisms are not associated with premalignant gastric conditions: a combined haplotype analysis[J].Eur J Gastroenterol Hepatol,2010,22(10):1189-1195.
[16] Vincenzi B,Patti G,Galluzzo S,et al.Interleukin 1beta-511T gene (IL1beta) polymorphism is correlated with gastric cancer in the Caucasian population: results from a meta-analysis[J].Oncol Rep,2008,20(5):1213-1220.
[17] Kato S,Onda M,Yamada S,et al.Association of the interleukin-1 beta genetic polymorphism and gastric cancer risk in Japanese[J].J Gastroenterol,2001,36(4):696-699.
[18] Yang J,Hu Z,Xu Y,et al.Interleukin-1B gene promoter variants are associated with an increased risk of gastric cancer in a Chinese population[J].Cancer Lett,2004,215(2):191-198.
[19] Hamajima N,Matsuo K,Suzuki T,et al.Low expression myeloperoxidase genotype negatively associated with Helicobacter pylori infection[J].Jpn J Cancer Res,2001,92(5):488-493.
[20] Wang Y,Kato N,Hoshida Y,et al.UDP-glucuronosyltransferase1A7 genetic polymorphisms are associated with hepatocellular carcinoma in Japanese patients with hepatitis C virus infection[J].Clin Cancer Res,2004,10(7):2441-2446.
[21] Zumkeller N,Brenner H,Chang-Claude J,et al.Helicobacter pylori infection, interleukin-1gene polymorphisms and the risk of colorectal cancer: evidence from a case-control study in Germany[J].Eur J Cancer,2007,43(8):1283-1289.
[22] Ruzzo A,Graziano F,Pizzagalli F,et al.Interleukin 1B gene (IL-1B) and interleukin 1 receptor antagonist gene (IL-1RN) polymorphisms in Helicobacter pylori-negative gastric cancer of intestinal and diffuse histotype[J].Ann Oncol,2005,16(6):887-892.
[23] Tatemichi M,Sawa T,Gilibert I,et al.Increased risk of intestinal type of gastric adenocarcinoma in Japanese women associated with long forms of CCTTT pentanucleotide repeat in the inducible nitric oxide synthase promoter[J].Cancer Lett,2005,217(2):197-202.
[24] Handoll HH.Systematic reviews on rehabilitation interventions[J].Arch Phys Med Rehabil,2006,(87):875.
[25] Midgette AS,Wong JB,Beshansky JR,et al.Cost-effectiveness of streptokinase for acute myocardial infarction: a combined metaanalysis and decision analysis of the effects of infarct location and of likelihood of infarction[J].Med Decis Making,1994,14(2):108-117.
[26] Egger M,Davey Smith G,Schneider M,et al.Bias in meta-analysis detected by a simple, graphical test[J].BMJ,1997,315(13):629-634.
[27] Garza-Gonzalez E,Bosques-Padilla FJ,El-Omar E,et al.Role of the polymorphic IL-1B, IL-1RN and TNF-A genes in distal gastric cancer in Mexico[J].Int J Cancer,2005,114(2):237-241.
[28] Chen CC,Yang SY,Liu CJ,et al.Association of cytokine and DNA repair gene polymorphisms with hepatitis B-related hepatocellular carcinoma[J].Int J Epidemiol,2005,34(6):1310-1318.
[29] Sugimoto M,Furuta T,Shirai N,et al.Different effects of polymorphisms of tumor necrosis factor-alpha and interleukin-1 beta on development of peptic ulcer and gastric cancer[J].J Gastroenterol Hepatol,2007,22(1):51-59.
[30] Okamoto K,Ishida C,Ikebuchi Y,et al.The genotypes of IL-1 beta and MMP-3 are associated with the prognosis of HCV-related hepatocellular carcinoma[J].Intern Med,2010,49(10):887-895.
[31] Qian N,Chen X,Han S,et al.Circulating IL-1beta levels, polymorphisms of IL-1B, and risk of cervical cancer in Chinese women[J]. J Cancer Res Clin Oncol,2010,136(5):709-716.
[32] Ennas MG,Moore PS,Zucca M,et al.Interleukin-1B (IL1B) and interleukin-6 (IL6) gene polymorphisms are associated with risk of chronic lymphocytic leukaemia[J].Hematol Oncol,2008,26(2):98-103.
[33] Lewis AM,Varghese S,Xu H,et al.Interleukin-1 and cancer progression: the emerging role of interleukin-1receptor antagonist as a novel therapeutic agent in cancer treatment[J].J Transl Med,2006,(4):48.
[34] Landvik NE,Har K,Skaug V,et al.A specific interleukin-1B haplotype correlates with high levels of IL1B mRNA in the lung and increased risk of non-small cell lung cancer[J].Carcinogenesis,2009,30(7):1186-1192.
[35] Huang YT,Liu MY,Tsai CH,et al.Upregulation of interleukin-1 by Epstein-Barr virus latent membrane protein 1 and its possible role in nasopharyngeal carcinoma cell growth[J].Head Neck,2010,32(7):869-876.
[36] Chang YW,Jang JY,Kim NH,et al.Interleukin-1B (IL-1B) polymorphisms and gastric mucosal levels of IL-1beta cytokine in Korean patients with gastric cancer[J].Int J Cancer,2005,114(3):465-471.
[37] Hulkkonen J,Vilpo J,Vilpo L,et al.Interleukin-1 beta, interleukin-1 receptor antagonist and interleukin-6 plasma levels and cytokine gene polymorphisms in chronic lymphocytic leukemia:correlation with prognostic parameters[J].Haematologica,2000,85(6):600-606.
[38] Zur HA,Crusius J B,Murillo LS,et al.IL-1B promoter polymorphism and Epstein-Barr virus in Dutch patients with gastric carcinoma[J].Int J Cancer,2003,107(5):866-867.
[39] Yeo AE,Tanaka Y,Furuta T.Interleukin 1beta gene polymorphism and hepatitis C virus-related hepatocellular carcinoma[J].Hepatology,2003,38(5):267-268.
[40] Sakuma K,Uozaki H,Chong JM,et al.Cancer risk to the gastric corpus in Japanese, its correlation with interleukin-1beta gene polymorphism(+3953*T) and Epstein-Barr virus infection[J].Int J Cancer,2005,115(1):93-97.
[41] Wang SK,Zhu HF, He BS,et al.CagA+ H pylori infection is associated with polarization of T helper cell immune responses in gastric carcinogenesis[J].World J Gastroenterol,2007,13(21):2923-2931.
[42] Li C,Xia HH,Xie W,et al.Association between interleukin-1 gene polymorphisms and Helicobacter pylori infection in gastric carcinogenesis in a Chinese population[J].J Gastroenterol Hepatol,2007,22(2):234-239.
[43] Xuan J,Deguchi R,Watanabe S,et al.Relationship between IL-1beta gene polymorphism and gastric mucosal IL-1beta levels in patients with Helicobacter pylori infection[J].J Gastroenterol,2005,40(8):796-801.
[44] Gehmert S,Velapatino B,Herrera P,et al.Interleukin-1 beta single-nucleotide polymorphism,s C allele is associated with elevated risk of gastric cancer in Helicobacter pylori-infected Peruvians[J].Am J TropMed Hyg,2009,81(5):804-810.
[45] Dinarello CA. Biologic basis for interleukin-1 in disease[J].Blood,1996,87(6):2095-2147.
[46] Tirona MT,Sehgal R,Ballester O.Prevention of breast cancer (part I):epidemiology, risk factors, and risk assessment tools[J].Cancer Invest,2010,28(7):743-750.
[47] Willett W.The search for the causes of breast and colon cancer[J].Nature,1989,338(6214):389-394.
[48] Press DJ,Pharoah P.Risk factors for breast cancer:a reanalysis of two case-control studies from 1926 and 1931[J].Epidemiology,2010,21(4):566-572.
[49] Speirs V,Kerin MJ,Newton CJ,et al.Evidence for transcriptional activation of ERalpha by IL-1beta in breast cancer cells[J].Int J Oncol,1999,15(6):1251-1254.
[50] Ito LS,Iwata H,Hamajima N,et al.Significant reduction in breast cancer risk for Japanese women with interleukin 1B -31 CT/TT relative to CC genotype[J].Jpn J Clin Oncol,2002,32(10):398-402.
meta Analysis of IL1b Promoter Region Polymorphism and Cancer Risk
CHEN Li-ping1,2, GU Ling1,2, NIE Zhen-lin2, XU Ye-qiong2, LI Rui1,2, GAO Tian-yi2, SONG Guo-qi2, WANG Shu-kui2
1. Nanjing Normal University; 2. Central Laboratory, Nanjing First Hospital, Nanjing Medical University, Jiangsu Nanjing 210006, China
IL1B (Interleukin 1beta) is a pro-inflammatory cytokine against infection, playing an important role in the growth of cancers. The -31T/C polymorphism sites of the IL1B gene promoter region have participated in cancer occurrence through its influence on IL1B transcription. However, informed reasearch has different results. To clarify the association, a meta analysis has been performed for 11125 cases and 14415 controls from 47 published case–control studies. Odds ratio (OR) and 95% confidence interval (CI) could assess connection degree of polymorphic site and cancer risk. The polymorphic site has not connected with all cancers in all comparisons. Through stratified analyses, the individual carrying C allele has lower risk than non-carrier (CC vs TT: OR = 0.87, 95%CI: 0.77~0.98, Pheterogeneity= 0.103; TC vs TT: OR = 0.77, 95%CI: 0.62~0.95, Pheterogeneity= 0.734; TC+CC vs TT: OR = 0.74, 95%CI: 0.61~0.91, Pheterogeneity= 0.472). Similarly, the T/T genotype individual is easier to get gastric cancer compared with the C/C genotype (OR = 0.87, 95%CI: 0.77~0.98, Pheterogeneity= 0.103). Using the recessive model, the risk of gastric cancer observably reduces (OR = 0.88, 95%CI: 0.80~0.97, Pheterogeneity= 0.158). In European population(OR = 0.84, 95%CI: 0.73~0.97, Pheterogeneity= 0.070) and infection-matched studies(OR = 0.75, 95%CI: 0.60~0.94, Pheterogeneity= 0.220), the risk also notablely decreases; however, an increasing risk is found from breast cancer (OR=1.34, 95%CI: 1.18~1.61, Pheterogeneity=0.116). Although some modest biases could not be eliminated, this meta-analysis shows that the IL1B-31C allele is a protective factor for cancer, particularly the infections.
meta analysis; cancer; interleukin 1beta
R730.2
A
10.3969/j.issn.1674-1633.2012.11.005
1674-1633(2012)11-0031-06
2012-10-25
国家自然科学基金(81172141)。
王书奎,教授。
通讯作者邮箱: shukwang@163.com
