干旱胁迫下外生菌根真菌对马尾松幼苗生长和微量元素吸收的影响
2012-07-24丁贵杰
王 艺, 丁贵杰
(贵州大学 造林生态研究所, 贵州 贵阳550025)
菌根菌通过大量伸展到土壤中的根外菌丝把土壤中的矿质元素、 水分等运送到植物根内供植物吸收利用[1-2], 同时通过根内菌丝从植物获得其生长繁殖所需的碳水化合物, 从而与植物形成一种营养上的共生关系[3], 有利于植物的生长发育, 提高植物的抗性[4]。 植物正常生长过程中, 不仅需要氮磷钾等大中量营养元素, 还需要必要的微量元素。 微量元素在植物生命周期中扮演着非常重要的角色, 它们与植物的光合作用、 碳水化合物的运转和积累密切相关, 对植物的干物质积累起着重要的作用。 目前, 在干旱胁迫下外生菌根对苗木微量元素的影响方面研究甚少。 本试验通过在干旱胁迫下, 研究外生菌根对马尾松Pinus massoniana 苗木微量元素吸收及分布情况, 揭示菌根化苗木在干旱胁迫下生长发育的营养状况, 从而因地制宜地选择优良的菌种进行植树造林, 使菌根生物技术更好地应用到生产实践中。
1 材料及方法
1.1 试验材料
试验菌种包括: 褐环乳牛肝菌Suillus luteus Sp7 (简称S7), 褐环乳牛肝菌Sp1 (简称S1), 鸡油菌Cantharellus cibarius(简称G), 彩色豆马勃Pisolithus tinctorius(简称C), 土生空团菌Cenococcum geophilum(简称T), 对照不接菌(ck)。 试验树种为马尾松, 种子采自贵州省都匀市优良林分。
1.2 菌剂制备及培养
[5]。
1.3 种子及土壤处理
选择籽粒饱满的马尾松种子, 流水冲洗。 然后用体积分数为75%的乙醇表面消毒1 min, 无菌水冲洗4 次, 再用初始温度45 ℃温水浸种24 h, 湿纱布包裹, 置于25 ℃恒温箱催芽, 待种子裂嘴露白时即可播种。 试验基质是由第四纪红色黏土发育的黄壤与干净的河砂, 按体积9∶2 比例混合而成。 苗床上的土壤用甲醛溶液进行消毒10 d 后播种。 盆栽土壤在高压灭菌锅内(压力0.14 Mpa, 124~126 ℃)连续灭菌2 h 后备用。 塑料花盆规格为25 cm × 28 cm, 用体积分数为95%的乙醇擦拭后晾干。 将灭菌基质称取5 kg·盆-1, 装入灭菌好的花盆内备用, 供试土壤的基本理化性质: 全氮为0.060 g·kg-1, 全磷0.360 g·kg-1, 全钾1.496 g·kg-1, 有效氮66 mg·kg-1, 有效磷11 mg·kg-1, 有效钾164 mg·kg-1, 铁16.3 mg·kg-1,锰8.2 mg·kg-1, 铜1.6 mg·kg-1, 锌5.6 mg·kg-1, 交换性钙2.9 g·kg-1, 交换性镁0.4 g·kg-1, 有机质58.8 g·kg-1。
1.4 播种和接种
播种和接种同时进行, 采用条播方式, 先将培养好的菌丝液喷洒在苗床上, 然后将已催芽的种子播种于苗床上, 最后再将菌液喷洒于种子周围, 覆土。
1.5 试验设计
试验采用双因素随机区组试验设计。 因素A 为接种处理, 分别为S7, G, S1, C, T 和ck; 因素B为干旱胁迫处理, 分别为正常水分(65±5)%, 轻度胁迫(50±5)%, 中度胁迫(35±5)%, 重度胁迫(25±5)%。重复3 次, 5 盆·处理-1, 2 株·盆-1。
选取各处理生长一致的1 年生苗木移栽至花盆中, 统一浇水管理, 全部恢复正常生长后, 开展干旱胁迫试验。 最初使每盆的土壤含水量均达到饱和状态, 然后在温室内模拟自然干旱胁迫。 每天通过称量法维持土壤相对含水量保持在试验设计的范围内。 60 d 后进行指标测定。
1.6 指标测定
干旱胁迫开始后每隔10 d 测定1 次苗高和地径, 直至胁迫试验结束。 在胁迫试验结束后测定生物量和微量元素。 生物量的测定是将植株冲洗干净, 然后置80 ℃烘箱烘至恒量, 称干质量。 菌根依赖性(%)=(接种处理干质量-不接种处理干质量)/接种干质量×100[6]。 土壤基本分析采用常规分析方法[7]。
1.7 数据处理
数据采用Excel 和SPSS 18.0 统计软件进行数理统计分析。
2 结果与分析
2.1 干旱胁迫下外生菌根真菌对马尾松幼苗生长的影响
2.1.1 苗高和地径 外生菌根真菌与干旱胁迫对幼苗生长均产生了显著影响(图1 和表1)。 处理间差异极显著(P<0.01)。 在相同水分条件下, 菌根化苗高和地径均高于对照。 随干旱胁迫程度的加剧, 对照苗高和地径逐渐降低, 而菌根化苗木苗高、 地径则先增后降, 均在中度胁迫时达最大, 彼此间差异随胁迫的加剧而增大。 接种处理T 的苗高和地径最高, 较对照分别提高27.8%和52.9%。 说明在干旱胁迫条件下, 接种外生菌根真菌能显著提高苗木生长和抗旱能力, 其中以菌种T 和G 效果最好。
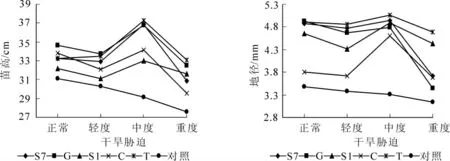
图1 接种外生菌根真菌对马尾松苗高和地径的影响Figure 1 Effects of different ectomycorrhizal fungi on the heights and ground diameters of Pinus massoniana seedlings

表1 马尾松幼苗菌根真菌和干旱胁迫二因素试验方差分析Table 1 Two factor analysis of Pinus massoniana seedlings in mycorrhizal fungi and drought stress
2.1.2 生物量 接种外生菌根真菌能显著促进幼苗生物量的增加(表2)。 在相同水分条件下, 菌根化苗木地上部分、 地下部分和总生物量均高于对照, 且处理间差异极显著(P<0.01)。 随水分胁迫加剧, 接种S7 和G 的苗木总生物量逐渐降低, 而接种S1, C 和T 的苗木总生物量则先增后降, 其中, 接种S1和C 的苗木在中度胁迫时达最大, 分别比对照增加230%和111%; 接种T 的苗木在轻度胁迫时达最大,比对照增加268%。 综合在各种水分胁迫条件下的表现, 以菌种S1 效果最好。 说明在干旱缺水条件下,接种S1 更能增强幼苗的吸收功能, 增加干物质的积累, 进而促进苗木的生长。
在干旱条件下, 外生菌根真菌能显著促进苗木的地上和地下部分生长, 特别是对根系的促进作用效果更加明显, 因此, 菌根化苗木的根冠比显著高于对照。 在干旱条件下, 外生菌根真菌能显著提高苗木生物量, 并通过增加根系生长, 增强苗木对水分的吸收, 提高苗木抗旱能力。
2.2 干旱分胁迫下外生菌根真菌对幼苗微量元素的影响
2.2.1 对铁质量分数的影响 由表3 可见: 相同水分条件下, 菌根化幼苗铁质量分数均高于对照, 各菌种间差异显著(P<0.05)。 然而随干旱胁迫加剧, 苗木铁质量分数总体呈现下降趋势。 在轻度、 中度和重度胁迫时, 分别以接种C, S1, G 的苗木铁质量分数最高, 分别较对照增加了126%, 135%和100%。在同一菌种, 不同干旱胁迫处理间苗木铁质量分数差异显著(P<0.05)。 与正常水分条件相比, 轻度干旱胁迫时, 接种S7 苗木的铁质量分数增幅最大, 达55.5%; 在中度干旱胁迫时, 接种S1 苗木的铁质量分数增幅最大, 达47.9%; 在重度干旱胁迫时, 仅接种G 的苗木铁质量分数高于正常水分条件, 增幅达20.9%。 说明接种后, 这些菌种既促进了苗木生长, 又显著促进了苗木对铁的吸收, 进而增强的苗木的抗旱性。
2.2.2 对锰质量分数的影响 在相同水分条件下, 菌根化马尾松幼苗锰质量分数均高于对照, 且各菌种间差异显著(P<0.05)。 随干旱胁迫的加剧, 除接种C 外, 其他苗木锰质量分数总体呈现上升趋势。 在轻度干旱胁迫时以接种S7 的苗木锰质量分数最高, 较对照增加了34.5%; 中度和重度胁迫时, 以接种S1 的苗木质量分数最高, 分别较对照增加了33.1%和59.6%。 在同一菌种, 不同干旱胁迫处理间苗木锰质量分数差异显著(P<0.05)。 与正常水分条件相比, 在轻度胁迫下, 接种C 苗木的锰质量分数增幅最大, 达50.1%; 在中度和重度胁迫下, 接种S1 苗木的锰质量分数增幅最大, 分别比对照增加了46.1%和79.0%。 说明外生菌根真菌能促进苗木对锰的吸收, 且在中度和重度干旱胁迫下, 接种S1 对促进苗木锰吸收效果最好。
2.2.3 对铜质量分数的影响 外生菌根真菌对苗木铜吸收有一定影响, 且不同菌根化苗木表现不一致,各菌种间差异显著(P<0.05)。 随水分胁迫的增加, 接种S1 和T 的苗木铜质量分数逐渐增加; 接种S7,G 和C 的苗木铜质量分数先增后减, 在轻度干旱胁迫时达最大。 在轻度胁迫时, 接种C 的苗木铜质量分数最高, 较对照增加了128%; 中度和重度干旱胁迫时, 接种S1 的苗木铜质量分数最高, 较对照分别增加155%和3.75%。 在同一菌种, 不同干旱胁迫处理间苗木铜质量分数差异显著(P<0.05)。 与正常水分条件相比, 在轻度干旱胁迫下, 接种C 的苗木铜质量分数增幅最大达21.9%; 在中度胁迫和重度胁迫下, 接种S1 苗木铜质量分数增幅最大, 分别为130.7%和14.5%。 说明中度和重度干旱胁迫下, 接种S1能显著促进了苗木对铜的吸收。
2.2.4 对锌质量分数的影响 外生菌根真菌对马尾松幼苗锌吸收有一定的影响, 各处理间差异显著(P<0.05)。 随干旱胁迫的加剧, 除接种S1 和T 外, 其他苗木锌质量分数逐渐降低。 在轻度、 中度和重度胁迫时, 分别以接种C, S1, T 的苗木锌质量分数最高, 分别较对照增加了106%, 96%, 22%。 轻度干旱胁迫下, 菌根化苗木锌质量分数均低于正常水分条件, 其中接种C 的苗木降幅最小(2.56%)。 在中度和重度干旱胁迫下, 接种S1 苗木锌质量分数与正常水分条件相比增幅最大, 分别为达49.0%和29.3%。 说明在中度和重度胁迫下, 接种S1 能显著提高苗木锌质量分数。
2.2.5 对钙质量分数的影响 外生菌根的形成对苗木钙的吸收无明显促进作用, 但处理间差异显著(P<0.05)。 随干旱胁迫加剧, 苗木钙质量分数总体呈现下降趋势。 在轻度胁迫时, 接种S7 的苗木钙质量分数最高, 比对照增加了152%。 中度和重度胁迫时, 接种G 的苗木钙质量分数最高, 分别比对照增加了90%和127%。 在同一菌种, 不同干旱胁迫处理间苗木钙质量分数差异显著(P<0.05)。 与正常水分条件相比, 在轻度干旱胁迫下, 接种S7 苗木钙质量分数增幅最大达147.4%; 在中度干旱胁迫下, 接种S7 苗木钙质量分数增幅最大达55.5%; 在重度干旱胁迫下, 菌根化苗木钙质量分数均低于正常水分条件, 且接种S7 苗木降幅最小(37.1%)。 可见, 在轻度干旱胁迫下, 接种S7 能促进苗木对钙的吸收, 而在重度干旱胁迫下, 外生菌根真菌不能促进苗木对钙的吸收。 说明较低的土壤含水量会抑制苗木对钙的吸收。
2.2.6 对镁质量分数的影响 除轻度干旱胁迫时, 接种C 的苗木镁质量分数显著低于对照外, 菌根化苗木在各水分处理下镁质量分数均高于对照, 且各处理间差异显著(P<0.05)。 随干旱胁迫的加剧, 除接种C 外其他苗木镁质量分数逐渐增加。 在轻度、 中度和重度胁迫时, 分别以接种S1, G, T 的苗木镁质量分数最高, 分别较对照增加了35.6%, 56.2%, 67.6%。 在同一菌种, 不同干旱胁迫处理间苗木镁质量分数差异不显著(P<0.05)。 与正常水分条件相比, 在轻度干旱胁迫下, 接种S1 苗木镁质量分数增幅最大达12.8%; 在中度干旱胁迫下, 接种S1 苗木镁质量分数增幅最大达20.3%。 在重度干旱胁迫下, 接种T 苗木镁质量分数增幅最大达23.2%。 可见, 在中度干旱胁迫时, 接种S1 能促进苗木对镁的吸收;而在重度干旱胁迫时, 接种T 仍能促进苗木对镁的吸收。
3 结论与讨论
外生菌根能促进苗木生长[8-9]。 外生菌根真菌侵染植株根系后, 改变了其根形态, 增加了植株根系的适应性, 拓宽了植株获取营养的渠道, 有利于根系在土壤中的生长[10]。 本研究进一表明: 在一定干旱条件, 菌根化苗木可通过促进根系生长, 促进苗木对水分的吸收来提高苗木抗旱能力, 进而促进苗木生长。 但不同菌种促生效果不同, 在中度胁迫时菌种土生空团菌对苗高、 地径促生效果最好, 分别比对照提高了27.8%和52.9%, 而菌种褐环乳牛肝菌Sp1 对苗木生物量促进效果最明显, 较对照增加了230%。
干旱胁迫下, 外生菌根真菌对苗木微量元素的吸收有一定影响, 这与前人的研究结果相一致[11-12]。轻度干旱胁迫时, 接种彩色豆马勃的苗木的铁、 锰、 铜和锌质量分数最高, 钙和镁最低; 在中度干旱胁迫时, 接种褐环乳牛肝菌Sp1 苗木铁、 锰、 铜和锌质量分数最高, 钙和镁较低。 从微量元素含量的变化来看, 菌种N1 对干旱胁迫的适应性很强, 随着干旱胁迫的加重, 菌种褐环乳牛肝菌Sp1 能迅速适应干旱胁迫, 各种微量元素质量分数逐渐增加。 在中度胁迫时, 接种褐环乳牛肝菌Sp1 的苗木微量元素质量分数仍能维持在较高水平, 这些都有助于增强苗木抵御干旱的能力, 也就是说接种S1 的苗木能通过对自身营养元素调节的方式, 来增强苗木叶绿素含量和各种酶活性, 从而更有利于苗木光合作用的正常进行, 提高菌根化苗木的抗旱性。

表3 干旱胁迫下外生菌根真菌对苗木微量元素质量分数的影响Table 3 Effect of ectomycorrhizal fungi on contents of microelements in Pinus massoniana seedlings under drought stress
综上所述: 在干旱条件下, 外生菌根真菌促进了马尾松幼苗的吸收功能, 增加了干物质的积累, 进而促进了植株的生长, 该结果与其他学者的发现一致[13-15]。 其中, 在中度干旱胁迫时, 接种褐环乳牛肝菌Sp1 在生物量积累和促进苗木微量元素吸收方面综合效果最好。 需要指出的是, 在干旱胁迫下, 由于不同菌株促进马尾松苗木生长、 改善营养的效应有所差异, 故在推广使用过程中应根据具体情况酌情选择。
参考文献:
[1] 朱教君, 徐慧, 许美玲, 等. 外生菌根菌与森林树木的相互关系[J]. 生态学杂志, 2003, 22 (6): 70-76.ZHU Xiaojun, XU Hui, XU Meilin, et al. Review on the ecological relationships between forest trees and ectomycorrhizal fungi [J]. Chin J Ecol, 2003, 22 (6): 70-76.
[2] 张小龙, 张洪, 张香, 等. 外生菌根菌剂对白皮松幼苗生长效应的研究[J]. 林业科学研究, 2005, 18 (2): 133- 136.ZHANG Xiaolong, ZHANG Hong, ZHANG Xiang, et al. Study on the effects of ectomycorrhizal preparation on seedling growth of Pinus bungeana [J]. For Res, 2005, 18 (2): 133-136.
[3] 郑来友, 李文钿, 成小飞, 等. 彩色豆马勃与松树形成内外生菌根的研究[J]. 林业科学研究, 2003, 16 (3):262-268.ZHENG Laiyou, LI Wendian, CHENG Xiaofei, et al. Study on ecto-endomycorrohizae associated by Pisolithus tinctorius with pine [J]. For Res, 2003, 16 (3): 262-268.
[4] 姜学艳, 黄艺. 菌根真菌增加植物抗盐碱胁迫的机理[J]. 生态环境, 2003, 12 (3): 353-356.JIANG Xueyan, HUANG Yi. Mechanism of contribution of mycorrhizal fungi to plant saline-alkali tolerance [J].Ecol Environ, 2003, 12 (3): 353-356.
[5] 周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 1993.
[6] PLENCHETTE C, FORTIN J A, FURLAN V. Growth responses of several plant species to mycorrhizae in a soil of moderateP-fertility (I) Mycorrhizal dependency under field conditions [J]. Plant Soil, 1983, 70 (2): 199-209.
[7] 李酉开. 土壤农业化学常规分析方法[M]. 北京: 科学出版社, 1983: 1-243.
[8] 高悦, 吴小芹, 孙民琴. 马尾松不同菌根苗对氮磷钾的吸收利用[J]. 南京林业大学学报: 自然科学版, 2009, 33(4): 77-80.GAO Yue, WU Xiaoqin, SUN Minqin. Effects of ectomycorrhizal seedlings of masson pineon absorpti on and utilization of N, P and K [J]. J Nanjing For Univ Nat Sci Ed, 2009, 33 (4): 77-80.
[9] 付瑞, 郭素娟, 马履一. 菌根化栓皮栎苗木对不同土壤水分条件的形态和生理响应[J]. 西北林学院学报, 2011, 26(2): 101-104.FU Rui, GUO Sujuan, MA Lüyi. The morphology and physiological response of mycorrhizal seedlings of Quercus variabilis under different soil moisture levels [J]. J Northwest For Univ, 2011, 26 (2): 101-104.
[10] MARULAND A A, AZC N R, RUIZ-LONAZO J M. Contribution of six arbucular mycorrhizal fungal isolates to water uptake by Lactuna sativaplants under drought stress [J]. Physiol Plant, 2003, 19: 526-533.
[11] 李晓林, 姚青. VA 菌根与植物的矿质营养[J]. 自然科学进展, 2000, 10 (6): 524-531.LI Xiaolin, YAO Qing.Vesicular-arbuscular mycorrhizal fungi and mineral nutrition of plants [J].Prog Nat Sci, 2000,10 (6): 524 - 531.
[12] AL-KARAKI G N, AL-RADDADA A. Drought stress and VA mycorrhizal fungi effects on growth and nutrient uptake of two wheat genotypes differing in drought resistance [J]. Mycorrhiza, 1997, 7 (2): 83-88.
[13] HARLEY J L. The significance of mycorrhiza [J]. Mycol Res, 1989, 92: 129-139.
[14] LI Xiaolin, MARSHNER H, GEORGE E. Acquisition of phosphorus and copper by VA-mycorrhizal hyphae and rootto-shoot transport in white clover [J]. Plant Soil, 1991, 136: 49-57.
[15] DENNY H J A, RIDGE I. Fungal slime and its role in the mycorrhizal amelioration of zinc toxicity to higher plants[J]. New Phytol, 1995, 130: 252-257.
