恩度联合放疗对鼻咽癌裸鼠成瘤的抑制作用及机制*
2012-07-21徐晓婷李金利秦颂兵周菊英
徐晓婷 李金利 秦颂兵 周菊英
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国常见的恶性肿瘤之一,放疗是目前根治鼻咽癌的公认和有效的手段。20余年来,随着鼻咽癌影像学、放疗技术及设备研发的进展,鼻咽癌早期的局部控制率可达70%~90%,但晚期(Ⅲ、Ⅳ期)仅为50%,5年总生存率(OS)仅40%~70%[1]。因此,如何提高鼻咽癌放射治疗的敏感性始终是该领域的研究热点。20世纪70年代,Folkman[2]首次提出通过抑制血管生长、切断营养供给而达到抑制并消除肿瘤的设想。重组人血管内皮抑制素注射液(商品名:恩度)是在内皮抑素的结构基础上,在母体的N端添加了9个氨基酸残基序列,较内皮抑素对蛋白酶、酸、热的稳定性更佳[3]。本研究旨在研究恩度联合放疗对鼻咽癌的抑制作用及其作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞株和裸鼠 人鼻咽癌细胞株CNE1购于中国科学院上海细胞研究所,BALB/c(nu/nu)裸鼠24只,雌性,4周龄,体质量15~18 g,购于中国科学院上海动物中心[动物合格证号:SCXK(沪)2008-0005],苏州大学动物中心SPF级条件下统一饲养。
1.1.2 药品与试剂 RPMI-1640培养基和胰蛋白酶(美国GIBCO公司),小牛血清(杭州四季青公司);恩度注射液(南京先声药业有限公司);Trizol(美国Invitrogen公司);MMLV(Promega公司);DEPC(BBI公司);Ex TaqTMR-PCR Version 2.1(大连宝生物公司,DRR031);血管内皮生长因子(vascular endothelial growth factor,VEGF)、Survivin和6对随机引物(上海生工生物公司)。
1.1.3 主要仪器 CO2培养箱(上海HERAEUS BB5060型);倒置显微镜(日本OLYMPUS CK-2型);ABI 9600低温高速离心机(德国Heraeus公司)。
1.2 方法
1.2.1 建立鼻咽癌裸鼠成瘤模型 在CNE1细胞处于指数生长期,细胞总量充足,以0.25%胰蛋白酶将细胞消化后,调整细胞浓度至2.5×107个/mL,按0.2 mL/只推注入裸鼠右后肢腹股沟皮下。
1.2.2 成瘤后随机分组并实施干预 接种瘤细胞后每天观察裸鼠精神状态、饮食、对外界的反应及成瘤情况等,成瘤后每4 d测量肿瘤体积V=LD×SD2×0.5(LD:肿瘤最长径,SD:肿瘤最短径)。当成瘤体积增至300~500 mm3时,随机将裸鼠分为对照组、恩度组、放疗组及恩度+放疗联合组(联合组),每组6只。对照组:瘤周注射生理盐水0.2 mL/次,1次/d,连续10 d;恩度组:每只裸鼠20 mg/(kg·d)瘤周注射恩度注射液,连续10 d;放疗组:成瘤处以5 MeV局部单次20 Gy照射;联合组:将恩度组和放疗组的处理方法同时处理此组。
1.2.3 观察肿瘤生长延迟情况 计算绝对延迟时间和标准化延迟时间[4]。绝对延迟时间是指每个实验组肿瘤增大至原来体积的2倍所需的时间减去对照组肿瘤增大至原来体积的2倍所需时间;而标准化延迟时间是指联合组的绝对延迟时间减去对应单纯治疗组的绝对延迟时间。在此基础上,计算联合组内的恩度对放射的增效因子(enhencement factor,EF),即联合组的标准化生长延迟时间与放疗组的绝对生长延迟时间的比值。28 d后采用颈椎脱位处死裸鼠,摘取瘤体并称瘤重。电镜下观察肿瘤组织的形态学变化。
1.2.4 实时荧光定量PCR(Real time-PCR)检测VEGF和Sur⁃vivin的表达 (1)VEGF和Survivin引物的设计。VEGF上游:5′-ATGAACTTTCTGCTGTCTTGG-3 ′,下游:5′-TCACCGC CTCGGCTTGTCACA-3′;Survivin上游:5′-GCCAGATTTGAA TCGCGGGA-3′,下游:5′-GCAGTGGATGAAGCCAGCCT-3′。(2)瘤组织RNA的提取及cDNA的合成。管1:随机引物2 μL,RNA 4 μL,DEPC H2O 9 μL 70 ℃,5 min,4 ℃,12 000 r/min离心5 min;管2:5×Buffer 8 μL,MMLV 1 μL,Rnasin 0.5 μL,dNTP 1.25 μL,加H2O 14.25 μL;将管2加入管1中,37 ℃ 1 h,95 ℃ 5 min,4℃,12 000 r/min离心5 min。(3)Real time-PCR。5×buffer 5 μL,Mg2+0.25 μL,dNTP 0.75 μL,TaqMen 0.25 μL,Primer 1,0.5 μL,Primer 2,0.5 μL,Probe 0.3 μL,dH2O 15.45 μL,ample 2 μL 95 ℃ 5 min,95 ℃ 15 s 60 ℃ 60 s,50个循环4℃,12 000 r/min离心5 min。(4)Real time-PCR结果判定与分析。采用GAPDH作为内参,根据标准曲线得出待测基因mRNA的分子拷贝数。经可行性试验验证目的基因与内参的扩增斜线差值小于0.1,应用△△Ct法进行定量分析。基因相对量=2-△Ct,△Ct=Ct目的基因-Ct内参基因;实验组/对照组的相对量为2-△△Ct,△△Ct=实验组△Ct-对照组△Ct,2-△△Ct值越大,目标基因VEGF和Survivin mRNA的相对量越小。
1.3 统计学处理 所有数据均利用SPSS 12.0统计软件进行分析。计量资料采用x ±s表示;多组数据组间分析分别应用方差分析,组内两两比较采用LSD-t法;相关性的判定用Pearson直线相关分析;以P<0.05为差异有统计学意义。
2 结果
2.1 裸鼠接种后成瘤及生长状况 裸鼠接种后12~15 d形成肉眼可见的皮下移植瘤,成瘤率100%;移植瘤早期多呈类球形,随着肿瘤的生长,逐渐呈不规则形,表面出现结节或分叶状突起;成瘤初期各组裸鼠饮食、活动及对外界的反应无明显改变,随着肿瘤的不断增长,逐渐出现进食活动减少,体质量减轻,对外界反应迟钝等异常。
2.2 成瘤生长情况 联合组肿瘤体积增长受到明显抑制,少数肿瘤停止生长,但均未出现肿瘤消退情况;对照组生长迅速;恩度组与放疗组居中,见图1。联合组的肿瘤倍增时间长于其他3组,放疗组的肿瘤倍增时间长于对照组,差异有统计学意义(P<0.05或P<0.01),恩度组的肿瘤倍增时间与对照组比较差异无统计学意义(P>0.05);增效因子为1.23,见表1。
2.3 电镜观察肿瘤组织凋亡情况 对照组瘤细胞形态不规则,绒毛丰富,细胞器结构清晰,核形态不规则,核浆比大,核内异染色质丰富;恩度组癌细胞数量较多,肿瘤细胞呈现凋亡形态改变少见;放疗组癌细胞数量减少,部分肿瘤细胞可见典型的凋亡改变;联合组在电镜视野里肿瘤细胞数稀少,肿瘤细胞损伤严重,核固缩,核均质化溶解及核碎裂,细胞膜破裂形成细胞碎片,见图2。
2.4 4组裸鼠成瘤组织中VEGF、Survivin表达水平比较 恩度组、放疗组和联合组的VEGF表达水平均低于对照组,联合组低于放疗组和恩度组,差异均有统计学意义(P<0.05或P<0.01),恩度组、放疗组和联合组的Survivin表达水平均小于对照组,联合组小于放疗组和恩度组,差异均有统计学意义(P<0.05或P<0.01),见表2。
2.5 VEGF与Survivin表达的相关性 成瘤组织中VEGF与Survivin的表达呈正相关(r=0.679,P<0.01)。
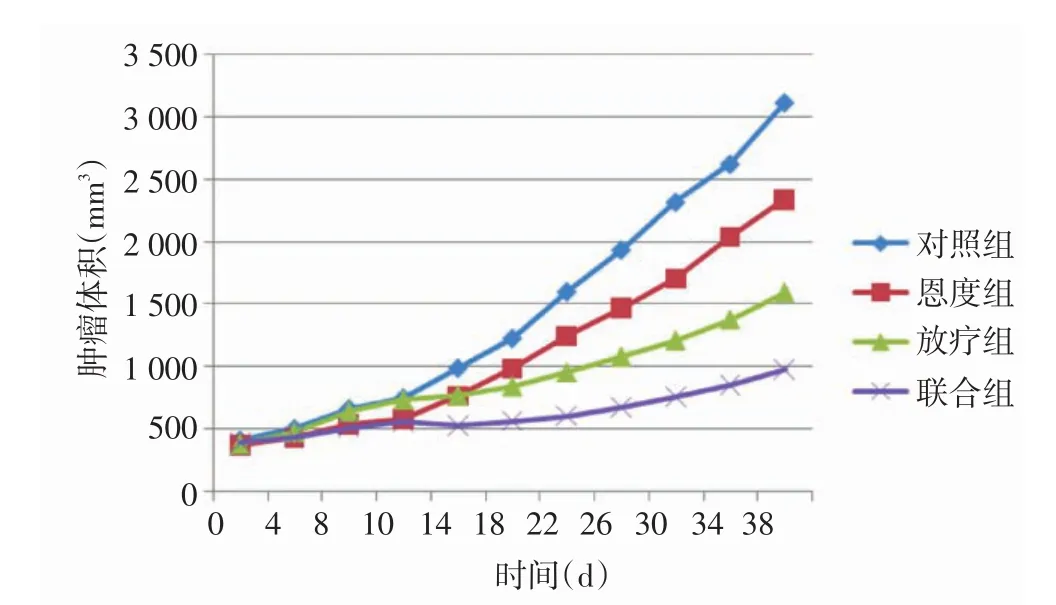
Figure 1 Growth curves of different treatment groups图1 治疗后各组成瘤生长曲线
Table 1 Inhibitory effects of endostar combined with radiotherapy on transplanted CNE1 nasopharyngeal carcinoma表1 放疗联合恩度对鼻咽癌CNE1成瘤的抑制效应(±s)
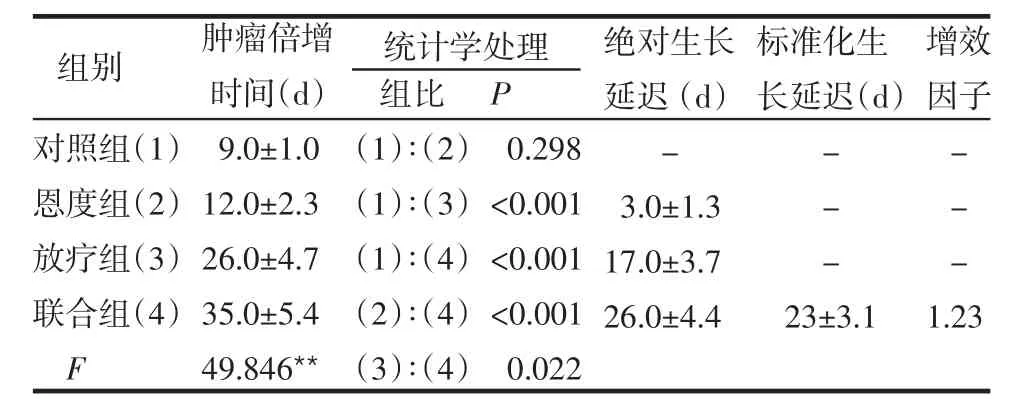
Table 1 Inhibitory effects of endostar combined with radiotherapy on transplanted CNE1 nasopharyngeal carcinoma表1 放疗联合恩度对鼻咽癌CNE1成瘤的抑制效应(±s)
**P<0.001
对照组(1)恩度组(2)放疗组(3)联合组(4)F肿瘤倍增时间(d)9.0±1.0 12.0±2.3 26.0±4.7 35.0±5.4 49.846**绝对生长延迟(d)-3.0±1.3 17.0±3.7 26.0±4.4标准化生长延迟(d)---23±3.1增效因子---1.23组比(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(4)(3)∶(4)P 0.298<0.001<0.001<0.001 0.022统计学处理组别
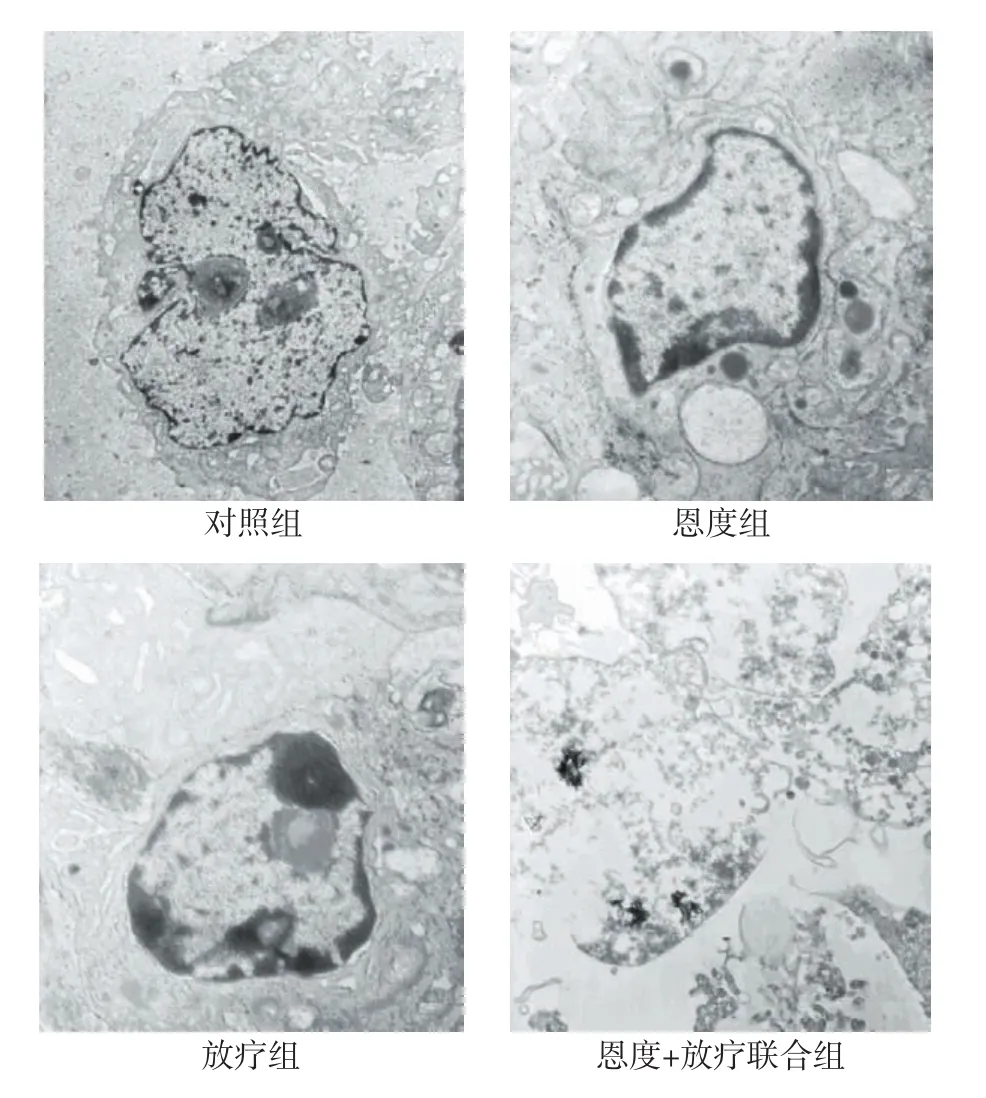
Figure 2 The cell apoptosis of tumor tissues detected by electron microscope(×4 800)图2 各组瘤细胞凋亡的电镜图(×4 800)
Table 2 Expression levels of VEGF andSurvivin mRNA in tumor tissues表2 各组裸鼠鼻咽癌成瘤组织中VEGF和Survivin的表达水平 (n=6±s)

Table 2 Expression levels of VEGF andSurvivin mRNA in tumor tissues表2 各组裸鼠鼻咽癌成瘤组织中VEGF和Survivin的表达水平 (n=6±s)
**P<0.01
VEGF(2-△△Ct)1.000±0.787 2.128±0.399 2.473±0.577 5.319±1.014 31.532**组比(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(4)(3)∶(4)P 0.027<0.001<0.001<0.001<0.001 Survivin(2-△△Ct)1.000±0.864 2.990±1.072 3.624±1.182 7.868±2.995 13.619**组比(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(4)(3)∶(4)P 0.019 0.031<0.001<0.001<0.001统计学处理 统计学处理对照组(1)恩度组(2)放疗组(3)联合组(4)F组别
3 讨论
局部晚期鼻咽癌患者鼻咽部肿瘤和颈部转移淋巴结较大,肿瘤内乏氧细胞多,放疗效果差,且远处转移率高达20%~40%[1]。乏氧的环境促进肿瘤血管的生成,肿瘤血管的生成又可以促进肿瘤放疗后的加速再增殖[5]。因此,如何提高肿瘤乏氧细胞的放射敏感性是本领域最为关注的问题之一。VEGF能特异性刺激血管内皮细胞的增殖,抑制其凋亡,促进血管构建,还具有促进淋巴管形成及肿瘤细胞淋巴转移的作用。抗血管生成疗法能改建肿瘤紊乱的血管网,使之结构、功能趋于正常化,从而改善血液循环,改善肿瘤的乏氧状态,提高乏氧细胞的放射敏感性[6]。本实验选取拮抗VEGF受体的有效抗体恩度进行鼻咽癌放射增敏实验,移植瘤生长抑制实验结果表明:联合组的肿瘤生长速度明显低于其他实验组,肿瘤生长延迟时间较放疗组明显延长(增效因子=1.23),说明恩度对裸鼠皮下成瘤的鼻咽癌有良好的放疗增敏效应。
Winkler等[7]发现,抗VEGF受体抗体能诱导肿瘤血管出现一个“血管正常化的窗口期”,窗口期内肿瘤血管与正常血管功能相似,肿瘤含氧量高,肿瘤细胞对放射线敏感,在窗口期内放疗能起到较好的协同抗肿瘤作用。达到肿瘤“血管正常化窗口期”正是目前临床应用恩度所关注的焦点。本实验在连续使用恩度10 d后再进行肿瘤的放疗,取得了较好的放疗增敏效果,提示连续给药10 d后可能是肿瘤血管正常化的“窗口期”,这种药物和放疗序贯使用的方式为临床使用恩度增敏放疗提供一定的参考。
VEGF表达的高低体现头颈部肿瘤放疗的疗效,VEGF表达越高,肿瘤放疗预后效果越差[8]。本实验结果表明:联合组与恩度组、放疗组相比,VEGF的表达都明显降低,提示恩度和放疗的联合使用对抑制肿瘤中VEGF的表达有协同作用。研究发现各种肿瘤组织在放疗后表现为VEGF表达水平上调,可能是机体在受到照射后产生的一种保护机制,诱导肿瘤产生放疗抗拒[9]。VEGF保护放疗诱导的血管内皮细胞凋亡,而此作用可以被抗VEGF抗体阻滞,因而恩度可能通过下调VEGF的表达提高肿瘤细胞的放射敏感性,强化了放疗的细胞毒作用。本实验中放疗组VEGF的表达也低于对照组,这可能与单次大剂量放疗后肿瘤负荷降低,VEGF的表达出现下降有关。
抗凋亡蛋白Survivin在所有人类肿瘤和转化的细胞系中大量表达,其可抑制肿瘤细胞的凋亡,促进细胞的异常增殖和恶性转化,且还被证实参与血管的形成,可能的作用机制是介导VEGF促进血管生成,抑制血管内皮细胞的凋亡,降低放化疗的敏感性[10]。本实验结果显示联合组与恩度组、放疗组相比,Survivin的表达明显降低,同时联合组的VEGF和Survivin表达均低于对照组,且两者的表达呈正相关。可见恩度与放疗联合作用于裸鼠的鼻咽癌成瘤组织,通过下调Survivin的表达,从而抑制VEGF的抗凋亡活性,增加了放疗后肿瘤细胞的凋亡,起到放射增敏的作用。
[1]殷蔚伯,谷铣之.肿瘤放疗治疗学[M].第4版.北京:中国协和医科大学出版社,2007:480.
[2]Folkman J.Antiangiogenesis in cancer therapy-endostatin and its mechanisms of action[J].Exp Cell Res,2006,312(5):594-607.
[3]Ling Y,Yang Y,Lu N,et al.Endostar,a novel recombinant human endostatin,exerts antiangiogenic effect via blocking VEGF-in⁃duced tyrosine phosphorylation of KDR/Flk-1 of endothelial cells[J].Biochem Biophys Res Commun,2007,361(1):79-84.
[4]Milas L,Mason K,Hunter N,et al.In vivo enhancement of tumor ra⁃dioresponse by C225 antiepidermal growtathyh factor receptor anti⁃body[J].Clin Cancer Res,2000,6(2):701-708.
[5]Mizukami Y,Kohgo Y,Chung DC,et al.Hypoxia inducible factor-1 independent pathways in tumor angiogenesis[J].Clin Cancer Res,2007,13(19):5670-5674.
[6]Goel S,Duda DG,Jain RK,et al.Normalization of the vasculature for treatment of cancer and other diseases[J].Physiol Rev,2011,91(3):1071-1121.
[7]Winkler F,Kozin SV,Tong RT,et al.Kinetics of vascular nor real⁃ization by VEGFR2 blockade governs brain tumor response to radia⁃tion:role of oxygenation,angiopoietin-1,and matrix metalloprotein⁃ases[J].Cancer Cell,2004,6(12):553-563.
[8]Martin SG,Orridge C,Mukherjee A,et al.Vascular endothelial growth factor expression predicts outcome after primary radiothera⁃py for head and neck squamous cell cancer[J].Clin Oncol(R Coll Radiol),2007,19(1):71-76.
[9]Chung YL,Jian JJ,Cheng SH,et al.Sublethal irradiation induces vascular endothelial growth factor and promotes growth of hepatoma cells:implications for radiotherapy of hepatocellular carcinoma[J].Clin Cancer Res,2006,12(9):2706-2715.
[10]Kelly RJ,Lopez-Chavez A,Citrin D,et al.Impacting tumor cell-fate by targeting the inhibitor of apoptosis protein survivin[J].Molecular Cancer,2011,6(10):35-46.
