防御素5和LL37真核重组质粒构建及转染人阴道上皮细胞的研究
2012-07-21尹利荣
王 芳 尹利荣 孙 蓓
人类的机体时刻被来自外在和内在的多种微生物围攻,先天免疫系统可以抵抗一些潜在的病原体,这类具有抗菌活性的肽和微量蛋白的产物统称为抗菌肽(antimicrobial peptides,AMPs),AMPs是宿主先天免疫的一部分[1]。女性下生殖道为开放性腔道,当受到内源或外源性因素影响时,以乳杆菌等优势菌为主要组成的微生态系统很容易发生改变,导致疾病的发生[2]。本研究通过构建AMPs中防御素5(HD5)和LL37的真核重组质粒,并瞬时转染人阴道上皮细胞,以期探讨阴道上皮细胞抵抗微生物感染的机制。
1 材料与方法
1.1 试剂与仪器 pcDNA3.1(+)表达质粒购自Invitrogen公司;pcDNA3.1(+)-EGFP表达质粒由天津医科大学内分泌研究所构建;T4连接酶、限制性内切酶EcoRⅠ、KpnⅠ、NotⅠ购自TaKaRa公司;KOD dash酶购自TOYOBA公司;pGEM-T Easy载体、质粒抽提试剂盒、M-MLV逆转录酶及RNA酶抑制剂为Promega公司产品;Oligo(dT)18购自上海生工生物工程有限公司;Trizol和细胞转染用Lipofectamine 2000试剂盒购自Invitrogen公司;氨苄青霉素、卡那霉素、异丙基硫代-β-D-半乳糖苷(IPTG)、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)购自华美生物工程公司;β-巯基乙醇、琼脂糖、甘氨酸、溴化乙锭(EB)为美国Sigma公司产品;酵母提取物(Yeast Extract)、胰蛋白胨(Tryptone)、琼脂(Agar)、角质形成细胞无血清培养基(K-SFM)、胎牛血清、DMEM/F12培养基均为GIBCO公司产品。DNA快速纯化回收试剂盒,高纯质粒提取试剂盒均购自Biomega生物技术公司;BCA蛋白浓度测定试剂盒购自PIERCE公司。大肠杆菌E.coli JM109菌株为天津医科大学内分泌研究所保存。人HD5定量酶联免疫吸附(ELISA)试剂盒最小可测浓度为0.1 μg/L,人LL37定量ELISA试剂盒最小可测浓度为0.14 μg/L,以上2种试剂盒均购自瑞科生物技术有限公司。GeneAmp PCR System 9600扩增仪为美国Perkin Elmer Cetus公司产品。
1.2 重组pcDNA3.1(+)/HD5-EGFP及pcDNA3.1(+)/LL37-EGFP真核表达载体的构建
1.2.1 提取阴道总RNA并逆转录为cDNA 本研究获得我院伦理委员会批准,组织提供者均鉴署知情同意书。采用Trizol试剂一步法提取健康育龄女性阴道黏膜上皮细胞(细胞取自我院妇科门诊体检女性)的总RNA,经甲醛变性琼脂糖凝胶电泳检测RNA的完整性。在不同波长下检测电泳条带的光密度(OD)值,若OD260/OD280介于1.8~2.0,OD260/OD230介于1.5~1.9,说明RNA纯度较高。然后逆转录成cDNA。
1.2.2 扩增获编码HD5和LL37成熟肽的DNA序列 PCR引物根据Gene Bank核酸数据库应用Primer 5.0设计,委托北京奥科生物公司合成。并在引物的两端加入限制性内切酶的酶切序列。引物序列为:HD5-正义5′-CGGGGTACC ATGAGGACCATCGCC-3′;HD5-反义5′-ATAAGAATGCGG CCGCGCGACAGCAGAGTCTG-3′。LL37-正义5′-CGGGGT ACCATGAAGACCCAAAG-3′;LL37-反义 5′-ATAAGAATGC⁃GGCCGCGGACTCTGTCCTGG-3′。GGTACC为KpnⅠ的酶切位点,GCGGCCGC为NotⅠ的酶切位点。PCR条件:以cDNA为模板,预变性95℃5 min,随后按94℃变性30 s,56℃退火45 s,72℃延伸30 s。35次循环后,72℃继续延伸5 min,最后加入1U普通Taq DNA聚合酶72℃反应1 h。1.2%琼脂糖凝胶电泳检测结果。
1.2.3 目的基因转入pGEM-T Easy载体 用DNA快速纯化回收试剂盒按使用说明进行操作,将上述PCR产物进行回收。将目的基因与pGEM-T载体连接,反应体系为:pGEM-T载体1 μL;T4 DNA连接酶1 μL;2×Ligase Buffer 5 μL;PCR回收产物3 μL,共计10 μL。加入离心管,4℃连接过夜。将连接产物转化感受态E.coliJM109,经蓝白斑筛选,挑取阳性菌落,培养后进行PCR检测。检测为阳性者,将菌液扩大培养,提取质粒。
1.2.4 构建 pcDNA3.1(+)/HD5-EGFP和 pcDNA3.1(+)/LL37-EGFP真核重组质粒 含有目的基因的克隆载体和pcDNA3.1(+)质粒分别用内切酶KpnⅠ、NotⅠ双酶切过夜(37℃)。将酶切后分别回收的基因片段和pcDNA3.1(+)质粒混合,加入T4 DNA连接酶,置于16℃水浴中连接过夜。10 μL连接产物转化大肠杆菌E.coli JM109 100 μL(方法同前),涂布于LB平板培养基上,37℃过夜培养,挑选单个菌落,经LB液体培养基培养后进行PCR检测。检测为阳性者,将菌液扩大培养,提取重组质粒。
1.2.5 重组质粒的酶切鉴定和序列分析 将重组质粒用限制性内切酶KpnⅠ和NotⅠ酶切鉴定,反应体系为:重组质粒DNA 3 μL,10×Buffer 2 μL,内切酶KpnⅠ和NotⅠ各0.5 μL,加去离子水4 μL,37℃酶切过夜。阳性重组质粒由北京奥科生物技术有限责任公司测序。
1.3 人阴道上皮细胞的培养和传代 人阴道上皮细胞取材于因子宫肌瘤或子宫腺肌病行全子宫切除的育龄期患者阴道壁组织。术前宫颈细胞学检查无异常,抗感染筛查为阴性,术后病理检查为良性疾病。参考吴文湘等[3]的方法采用K-SFM和组织块法进行阴道上皮细胞体外培养,将新鲜阴道组织放入加有抗生素(庆大霉素50 μg/L,青霉素100 U/mL,链霉素100 U/mL)的4℃D.Hank’s液无菌小瓶内。经消毒、分离后将组织碎块接种于一次性培养瓶中,加入含抗生素的K-SFM培养基(两性霉素B 0.25 mg/L,青霉素100 U/mL,链霉素100 U/mL),在37℃,6%CO2孵育箱中培养。当上皮细胞接近90%以上融合时,用质量分数0.1%的胰蛋白酶/质量分数0.01%的乙二胺四乙酸消化液按体积比1∶2或1∶3进行传代,传至第4代准备试验。苔盼蓝染色检测细胞活力。
1.4 AMPs真核重组质粒转染阴道上皮细胞 以0.5×105的密度将细胞接种于24孔细胞培养板,加入500 μL无抗生素K-SFM培养基至细胞融合率达80%~90%时,分别将质粒pcDNA3.1(+)-EGFP、pcDNA3.1(+)/HD5-EGFP及pcDNA3.1(+)/LL37-EGFP与Lipofectamine2000混合后按转染试剂盒的操作说明转染细胞。转染pcDNA3.1(+)/HD5-EGFP为HD5组、转染 pcDNA3.1(+)/LL37-EGFP为LL37组、转染pcDNA3.1(+)/HD5-EGFP和pcDNA3.1(+)/LL37-EGFP为联合转染组、未转染质粒细胞为未转染组,同时设置一空载质粒为空白对照组。每孔设2个复孔。
1.5 抗菌肽LL37及HD5表达情况检测 分别于转染后6、12、24及48 h用荧光显微镜观察真核重组质粒瞬时转染阴道上皮细胞情况,收集各组细胞培养上清液冻存于-80℃,收齐标本后用ELISA方法检测LL37及HD5含量,实验步骤按试剂盒说明进行。
1.6 统计学方法 采用SPSS 17.0统计软件进行分析,计量资料结果以±s表示。多组各时点HD5、LL37值的比较采用重复测量资料的方差分析。检验水准α=0.05。
2 结果
2.1 pcDNA3.1(+)/HD5-EGFP 和 pcDNA3.1(+)/LL37-EGFP真核表达载体的构建
2.1.1 人阴道上皮细胞总RNA的提取 经甲醛变性琼脂糖凝胶电泳,28 s与18 s的密度比值约为2,总RNA的完整性较好,基本无降解,见图1。
Figure 1 Electrophoresis of RNA in denaturing formaldehyde agarose gels图1 RNA甲醛变性电泳图
2.1.2 人HD5和LL37基因的获取 以cDNA为模板,分别扩增出产物长度约为307 bp的HD5和538 bp的LL37成熟肽编码序列,见图2。

Figure 2 Agarose gel electrophoresis of PCR amplification products图2 PCR扩增产物琼脂糖凝胶电泳图
2.1.3 真核重组质粒pcDNA3.1(+)/HD5-EGFP及pcDNA3.1(+)/LL37-EGFP的酶切鉴定 经限制性内切酶KpnⅠ和NotⅠ对重组质粒酶切可见约307 bp、538 bp左右2条片段,经测序证实其结果与GenBank上报道的HD5cDNA和LL37cDNA序列完全一致,目的基因全已连入pcDNA3.1(+)-EGFP载体,序列完全正确,读码框架正确,质粒构建成功,见图3。

Figure 3 Identification of the recombinant plasmid pcDNA3.1(+)/HD5-EGFP and pcDNA3.1(+)/LL37-EGFP图 3 pcDNA3.1(+)/HD5-EGFP和pcDNA3.1(+)/LL37-EGFP重组质粒酶切鉴定
2.2 人阴道上皮原代培养的细胞特点、活性及纯度鉴定 阴道上皮组织接种后4~6 d,从小组织块周边可见生长出来的阴道上皮原代细胞呈多角形,如铺路石状,细胞体积较小,大小均一,胞质均匀明亮,轮廓清晰光滑,折光性强,倒置相差显微镜下有立体感。上皮细胞逐渐生长融合成片,原代培养10 d左右细胞融合。每代细胞生长至85%~90%融合时传代。第3~6代细胞形态良好,与原代无明显区别,是细胞生长的黄金时期,细胞传代的贴壁率明显提高,在增殖期间细胞核分裂象多见,见图4。传代至第3代即可进行转染。苔盼蓝排斥试验检测细胞活力可达90%~95%,显微镜下计数上皮细胞纯度达99%以上。

Figure 4 The growth status of cultured primary human vaginal epithelial cells(×10)图4 原代培养的阴道上皮细胞生长情况(×10)
2.3 重组质粒pcDNA3.1(+)/HD5-EGFP及pcDNA 3.1(+)/LL37-EGFP的瞬时转染效率及目的基因的表达
2.3.1 阴道上皮细胞的转染情况 在转染细胞的胞膜和胞内有较强的绿色荧光,且转染细胞阳性率近100%,24 h时转染率最高,见图5。

Figure 5 The LL37 and HD5 gene expression of human vaginal epithelial cells after transfection of recombinant plasmid pcDNA3.1(+)/LL37-EGFP(A)and pcDNA3.1(+)/HD5-EGFP(B)for 24 hours(×20)图5 转染质粒pcDNA3.1(+)/LL37-EGFP(A)和pcDNA3.1(+)/HD5-EGFP(B)时阴道上皮细胞LL37和HD5的基因表达(×20)
2.3.2 各组细胞不同时段LL37及HD5的表达水平 同一时段各组组间LL37水平差异有统计学意义(F组间=849.138,P<0.001)。联合转染组高于LL37组,LL37组高于未转染组,差异均有统计学意义(均P<0.001)。组内不同时间LL37水平差异均有统计学意义(F时间=3 410.030,P<0.001),除未转染组外,其他2组均是6 h时分泌最低,24 h达高峰,然后呈下降趋势。组间和处理时间之间存在交互效应(F交互=13 211.408,P<0.001),见表1。同一时段各组组间HD5水平差异有统计学意义(F组间=609.262,P<0.001)。联合转染组高于HD5组,HD5组高于未转染组,差异均有统计学意义(均P<0.001)。组内不同时间HD5水平差异均有统计学意义(F时间=1 086.068,P<0.001),HD5组随时间增加,HD5水平呈增加趋势;联合转染组6 h时分泌最低,24 h达高峰,然后呈下降趋势。组间和处理时间之间存在交互效应(F交互=6 130.852,P<0.001),见表2。
Table 1 Comparison of LL37 levels in different time points between three groups表1 不同时段各组LL37水平比较 (μg/L ±s)
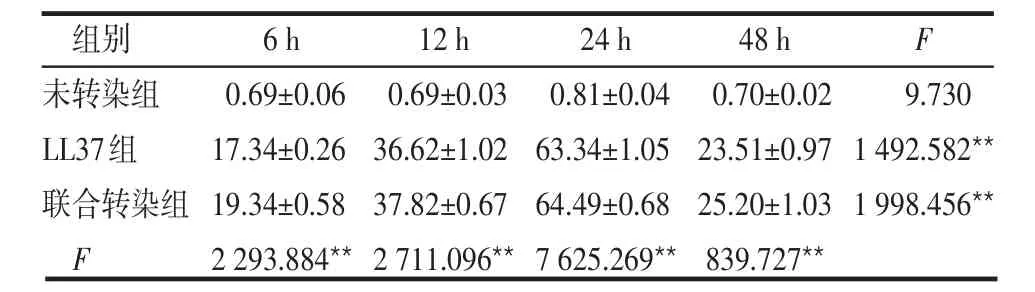
Table 1 Comparison of LL37 levels in different time points between three groups表1 不同时段各组LL37水平比较 (μg/L ±s)
F组间=849.138**,F时间=3 410.030**,F交互=13 211.408**;**P<0.001
组别未转染组LL37组联合转染组F 6 h 0.69±0.06 17.34±0.26 19.34±0.58 2 293.884**12 h 0.69±0.03 36.62±1.02 37.82±0.67 2 711.096**24 h 0.81±0.04 63.34±1.05 64.49±0.68 7 625.269**48 h 0.70±0.02 23.51±0.97 25.20±1.03 839.727**F 9.730 1 492.582**1 998.456**
Table 2 Comparison of HD5 levels in different time points between three groups表2 不同时段各组HD5水平比较 (mg/L, ±s)

Table 2 Comparison of HD5 levels in different time points between three groups表2 不同时段各组HD5水平比较 (mg/L, ±s)
F组间 =609.262**,F时间 =1 086.068**,F交互 =6 130.852**;**P<0.001
组别未转染组HD5组联合转染组F 6 h 1.17±0.04 8.22±0.30 17.10±0.14 5 031.095**12 h 1.12±0.08 12.02±0.61 28.01±1.26 835.694**24 h 1.10±0.03 14.94±0.42 50.07±1.19 3 592.806**48 h 1.11±0.04 16.94±0.42 37.76±0.41 8 784.427**F 2.145 238.871**917.759**
3 讨论
人体上皮细胞可产生3大类AMPs,包括防御素、Cathelicidins和富组蛋白。防御素是一种兼两性的阳离子多肽,HD5属于防御素α亚家族,除了由人肠道潘氏细胞分泌,HD5也可在雌性生殖道复层上皮细胞表达,包括阴道、子宫颈、子宫内膜和输卵管,在胎盘和胎膜中也有HD5存在[4]。Dürr等[5]观察到女性生殖道不同位置都有HD5的表达,并且在阴道冲洗液中检测到高浓度的HD5。人源性阳离子抗菌肽-18(hCAP-18)是Cathelicidins家族中唯一存在于人体的AMPs,hCAP-18经丝氨酸蛋白酶3裂解产生LL37。LL-37由中性粒细胞、巨噬细胞及各种不同的上皮细胞产生。
AMPs抗致病原微生物种类广泛,包括革兰阳性菌、革兰阴性菌、真菌、寄生虫、包膜病毒,甚至非微生物类的肿瘤细胞[6]。这些天然分子杀灭多重耐药微生物的能力已得到相当重视和临床关注[1]。AMPs的作用机制是通过肽-膜质作用攻击靶细胞膜形成离子通道,使细胞内容物外渗而杀菌,可有效杀灭病原体[7]。作为一种阳离子小肽,AMPs以其高效、广谱、抗菌机制独特等优点,日益成为最具开发前景的新型抗菌药物。但从天然资源中提取AMPs成本高、获得率低、工序繁琐;化学合成则价格昂贵,也难以应用于临床,这成为AMPs开发的瓶颈,因此利用基因工程技术生产AMPs具有重要意义和广阔前景。
AMPs出现在人体所有接触微生物的部位如皮肤和黏膜,多由感染或损伤导致[8]。女性阴道是一个复杂的微生态系统,是由多种微生物构成的动态平衡体系[2]。阴道微生态平衡一旦被破坏,如菌群失调、免疫功能低下、大量使用抗生素等,阴道上皮细胞可以合成AMPs抵御病原体。研究发现阴道内HD5水平在不同的感染状态下均有明显升高[9],提示了先天性免疫因子HD5参与了下生殖道感染的发病过程。Valore等[10]研究显示正常对照组阴道灌洗液中HD5的水平范围为10~40 μg/L。这些宫颈阴道分泌物的成分随着月经周期、雌激素治疗及感染情况而改变[11]。然而天然合成的量有限,往往不足以抵御病原体感染而导致疾病的发生。通过人工方法增加AMPs的分泌,为增强阴道上皮细胞抗菌性进行基因干预是本实验的目的。
本研究24 h转染细胞阳性率近100%,荧光显微镜下可见大量绿色荧光,证明成功构建了重组质粒 pcDNA3.1(+)/HD5-EGFP 及 pcDNA3.1(+)/LL37-EGFP转染阴道上皮细胞。细胞上清液结果证明,抗菌肽LL-37及HD5能够在阴道上皮细胞中表达,阴道上皮细胞转染pcDNA3.1(+)/LL37-EGFP或(和)pcDNA3.1(+)/HD5-EGFP质粒后,LL37及HD5分泌水平均显著高于未转染组,且联合转染高于单独转染组,说明LL37及HD5的分泌具有协同促进作用。未转染组不同时段的LL3及HD5均保持在低水平稳定状态,证实阴道上皮细胞在自然状态下有一定量AMPs分泌,但这种分泌是一种持续的低水平状态。人工转染质粒后阴道上皮细胞分泌AMPs的量明显增加,分泌量在24 h达峰值。瞬时转染48 h后,基因转染效率开始降低,推测可能与瞬时转染本身的特点有关,也可能是重组基因引起了阴道上皮细胞凋亡。
有研究发现HD5及LL37不仅对病原体有直接的抵抗作用,而且具有调节宿主免疫功能的作用,HD5可以诱导结肠细胞系分泌IL-8[12]。LL37也可刺激髓细胞及上皮细胞的细胞因子尤其是IL-8的产生,调节细胞免疫反应,增强炎症感染部位中性粒细胞的宿主防御功能[13]。HD5及LL37的表达增加能否同时刺激阴道上皮细胞炎性趋化因子的表达有待进一步研究。
[1]Giuliani A,Pirri G,Nicoletto S.Antimicrobial peptides:an overview of a promising class of therapeutics[J].Cent Eur J Biol,2007,2(1):1-33.
[2]李奎,刘朝晖.外阴阴道假丝酵母菌病与阴道局部环境[J].实用妇产科杂志,2010,26(2):87-89.
[3]吴文湘,李颖,刘朝晖,等.人阴道上皮鳞状细胞的体外培养及其生物学特性[J].中华妇产科杂志,2007,42(10):711-712.
[4]Midorikawa K,Ouhara K,Komatsuzawa H,et al.Staphylococcus au⁃reus susceptibility to innate antimicrobi al peptides,β-defensins and CAP18,expressed by human keratinocytes[J].Infect Immun,2003,71(7):3730-3739.
[5]Dürr UH,Sudheendra US,Ramamoorthy A.LL-37,the only human member of the cat helicidin family of antimicrobial peptides[J].Bio⁃chim Biophys Acta,2006,1758(9):1408-1425.
[6]Suttmann H,Retz M,Paulsen F,et al.Antimicrobial peptides of the Cecropin-family show potent antitumor activity against bladder can⁃cer cells[J].BMC Urol,2008,8:5.
[7]Roland Pálffy,Roman Gardlík,Michal Behuliak,et al.On the physi⁃ology and pathophysiology of antimicrobial peptides[J].Mol Med,2009,15(1-2):51-59.
[8]Wiesner J,Vilcinskas A.Antimicrobial peptides:the ancient arm of the human immune system[J].Virulence,2010,1(5):440-464.
[9]张岱,刘朝晖,廖秦平,等.下生殖道感染患者阴道局部免疫状态的研究[J].中华妇产科杂志,2009,44(1):13-15.
[10]Valore EV,Wiley DJ,Ganz T.Reversible deficiency of antimicrobi⁃al polypeptides in bacterial vaginosis[J].Infect Immun,2006,74(10):5693-5702.
[11]Cole AM,Cole AL.Antimicrobial polypeptides are key anti-HIV-1 effector molecules of cervicovaginal host defense[J].Am J Reprod Immunol,2008,59(1):27-34.
[12]Ishikawa C,Tanabe H,Maemoto A,et al.Precursor processing of hu⁃man defensin-5 is essential to the multiple functions in vitro and in vivo[J].J Innate Immun,2010,2(1):66-76.
[13]Khine AA,Del Sorbo L,Vaschetto R,et al.Human neutrophil pep⁃tides induce interleukin-8 production through the P2Y6 signaling pathway[J].Blood,2006,107(7):2936-2942.
