亲和层析纯化重组中性粒细胞激活蛋白
2012-07-20丁亚骏何璐云王亚楠张亚娟康巧珍
丁亚骏,何璐云,王亚楠,张亚娟,康巧珍
(郑州大学生物工程系 河南郑州 450001)
中性白细胞和单核细胞的浸润往往会伴随着幽门螺杆菌(Helicobacter pylori,H.pylori)在人的胃黏膜定植而产生,中性白细胞浸润与胃黏膜损伤程度有一定的相关性。在H.pylori的水抽提物中含有一种能趋化并激活白细胞的成分,称为中性白细胞激活蛋白(neutrophil-activating protein,NAP)[1-4]。几乎在所有 H.pylori菌株中都含有编码HP-NAP的基因HP-napA,Satin等[5]提出NAP是H.pylori的主要毒力因子并且可以作为疫苗研究中的免疫保护性候选抗原。目前HP-NAP在H.pylori免疫反应中的作用正在逐步的研究与探索之中。但从H.pylori菌株中直接大规模纯化这一组分存在一定难度。随着研究深入传统的纯化方法无法满足科研需求。如今科研工作者从与大肠杆菌麦芽糖结合蛋白(maltose-binding protein,MBP)融合表达 HP-NAP工程菌 E.coli TB1(pMAL-c2X-napA)中快速高效分离纯化重组融合蛋白。然而以往对rMBP-NAP的分离纯化大多采用FPLC分子排阻层析法,该方法廉价,但伴随的是提取蛋白浓度、纯度有限,且耗时较长、消耗精力较大,无法满足后期实验对该蛋白的质与量上的需求。本实验采用直链淀粉树脂亲和层析法对rMBP-NAP进行分离纯化,快速分离纯化出高浓度、高纯度的融合蛋白rMBP-NAP,为HP-NAP的疫苗研究等后续实验提供材料。
1 材料与方法
1.1 工程菌及主要试剂 基因工程菌 E.coli TB1(pMAL-c2X-napA);直链淀粉树脂层析柱。
1.2 rMBP-NAP的诱导表达 挑取工程菌单菌落接种于氨苄青霉素培养液中,37℃ 200 r/min过夜培养,取菌液接种于丰富培养基中(含氨苄),37℃ 230 r/min振荡培养至对数生长期,加入诱导剂IPTG至终度浓度0.3 mmol/L,继续培养 3 h。取菌液 200 μL 离心,10%分离胶(SDS-PAGE)检测诱导表达效果。
1.3 菌体的收获及超声破碎 IPTG诱导后的培养物分装于离心管,4℃ 4 000 g离心20 min,弃上清,用5 ml过柱缓冲重悬沉淀,-20℃冻存过夜,室温解冻,于冰水浴中300 W 短脉冲超声破碎(超声5 s,间隔15 s,重复20次左右)至菌液透明。4℃ 9 000 g离心30 min,转移上清,分别取超声上清和沉淀行 SDSPAGE,分析融合蛋白rMBP-NAP的可溶性。
1.4 SDS-PAGE 凝胶图像分析仪照相。
1.5 亲和层析分离纯化rMBP-NAP
1.5.1 亲和层析柱的制备:将直链淀粉树脂灌入层析柱。以8倍柱子体积的过柱缓冲液(20 mmol Tris-HCl,200 mmol/L NaCl,1 mmol/L EDTA)平衡柱子。
1.5.2 超声上清过柱:超声破碎并离心后所得的上清,用过柱缓冲液稀释(1∶5),以1 mL/min的速度使液体通过亲和层析柱。
1.5.3 杂蛋白的去除:用12倍柱体积的过柱缓冲液冲洗亲和层析柱。
1.5.4 洗脱rMBP-NAP:用含有浓度为10 mmol/L麦芽糖的过柱缓冲液洗涤柱子,用5 mL灭菌离心管收集洗脱液,每管3 mL,共收集20管。SDS-PAGE检测每管洗脱液中的蛋白成分。
1.6 rMBP-NAP浓度测定 蛋白质定量试剂盒(普利莱基因技术有限公司)检测蛋白浓度。
1.7 rMBP-NAP纯度检测 使用 ImageJ(version 1.44p)检测融合蛋白纯度。
2 结果
2.1 SDS-PAGE检测IPTG诱导表达效果 rMBPNAP相对分子质量约57 kD与预期结果一致。IPTG成功诱导工程菌E.coli TB1(pMAL-c2X-nap)表达融合蛋白rMBP-NAP,见图1。
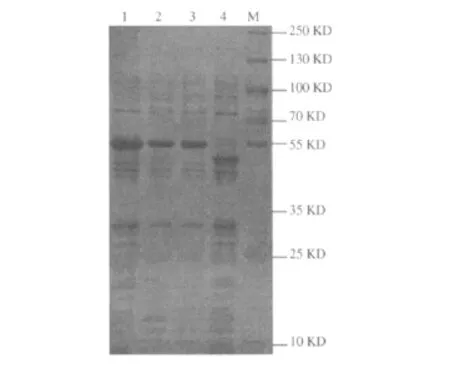
图1 IPTG诱导基因工程菌E.coli TB1(pMAL-c2X-napA)表达rMBP-NAP
2.2 SDS-PAGE检测 rMBP-NAP融合蛋白可溶性 E.coli TB1(pMAL-c2X-napA)诱导表达的rMBPNAP主要以可溶性形式存在于超声上清中,相对分子质量约为57 000,与预期结果一致,见图2。
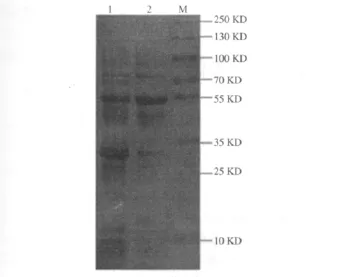
图2 IPTG诱导基因工程菌E.coli TB1(pMAL-c2X-napA)表达融合蛋白rMBP-NAP的可溶性检测
2.3 SDS-PAGE检测rMBP-NAP亲和层析效果IPTG诱导的基因工程菌 E.coli TB1(pMAL-c2X-napA)超声上清,用直链淀粉树脂亲和层析柱纯化,洗脱液进行SDS-PAGE检测,见图3。
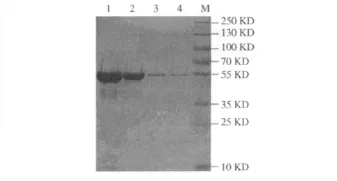
图3 SDS-PAGE检测重组蛋白rMBP-NAP直链淀粉树脂亲和层析效果
2.4 rMBP-NAP蛋白浓度测定 参照蛋白定量试剂盒说明书,酶标仪于570 nm波长测量吸光度值并绘制标准曲线。融合蛋白rMBP-NAP吸光度OD570=0.64,根据标准曲线得出蛋白浓度为625 μg/mL,见图4。
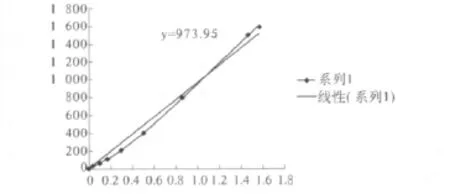
图4 蛋白质定量试剂盒检测rMBP-NAP蛋白浓度
2.5 融合蛋白rMBP-NAP纯度检测 亲和层析纯化后的rMBP-NAP融合蛋白经SDS-PAGE检测后,利用软件ImageJ(version1.44p)根据SDS-PAGE照片绘图计算蛋白纯度。软件计算得出rMBP-NAP纯度为96.78% 。
3 讨论
以往的实验研究中,获取rMBP-NAP采用的是快速蛋白液相层析色谱法(FPLC),是运用快速蛋白纯化全自动色谱系统来进行分离纯化。该方法效率较为优越,灵敏度高(可达到10-9g/ml数量级),洗脱过程梯度变化,洗脱效果好。但是,FPLC方法在实行的过程中,需要有专业的人士来操纵快速蛋白液相分析系统进行实验,对实验条件和实验人员要求较高。本实验应用直链淀粉树脂,对IPTG诱导工程菌表达的重组蛋白rMBP-NAP直接进行亲和层析,实现了一步纯化。该方法操作简便,实验周期短,纯化得到的rMBP-NAP具有较高浓度和纯度,可满足科研的需要。同时,与HP-NAP融合表达的麦芽糖结合蛋白(MBP)不仅可用于亲合层析,还有商品化的MBP抗血清,可用于免疫反应跟踪鉴定实验结果。这对一种新的重组蛋白的鉴定尤为重要。
有报道,应用FPLC分子排阻层析法分离的rMBPNAP 的纯度为 91% ,含量为 0.121 g/ml[8]。本实验结果表明,直链淀粉树脂亲和层析法分离纯化rMBPNAP无论是从效率上还是纯度上都优于FPLC分子排阻层析法。因此,应用直链淀粉树脂亲和层析法可更快更好地分离纯化融合蛋白rMBP-NAP,为HP-NAP的疫苗研究等后续实验提供材料。
[1]周永宁,徐采朴.幽门螺杆菌中性白细胞激活蛋白的研究进展[J].免疫学杂志,2001,17(3):53-55.
[2]康巧珍,段广才,范清堂,等.幽门螺杆菌中性白细胞激活蛋白与麦芽糖结合蛋白融合表达产物rMBP-NAP的分离纯化[J].郑州大学学报(医学版),2004,39(5):746-749.
[3]Qiao-Zhen Kang,Guang-Cai Duan,Qing-Tang Fan,et al.Fusion expression of Helicobacter pylori neutrophil-activating protein in E.coli[J].World J Gastroenterol,2005,11(3):454-456.
[4]Gaia Codolo,Paola Mazzi,Amedeo Amedei,et al.The neutrophil-activating protein of Helicobacter pylori down-modulates Th2 inflammation in ovalbumin-induced allergic asthma[J].Cellular Microbiology,2008,10(11),2355-2363.
[5]Satin B,Del Giudice DG Della,Bianca DV,et al.The neutrophilactivating protein(HP-NAP)of Helicobacter pylori is a protective antigen and a major virulence factor[J].J Exp Med,2000,191(9):1467-1476.
