旋毛虫西藏地理株生物学特性的研究
2012-07-20李灵招王中全
李灵招,崔 晶,王中全
(1.郑州市中心医院检验科 河南郑州 450007;2.郑州大学基础医学院寄生虫学教研室 河南郑州450052)
旋毛虫病(trichinellosis)是一种严重的人兽共患寄生虫病,人体感染旋毛虫主要因生食或半生食含有幼虫囊包的猪肉及其肉制品所致。我国西藏地区自1964年报道首例旋毛虫病人以来[1],至2009年在该地区已发生15次人体旋毛虫病暴发,发病187例,死亡12人[2,3]。目前,国际上已将旋毛虫属分为8个种:即旋毛虫(T.spiralis,T1)、乡土旋毛虫(T.nativa,T2)、布氏旋毛虫(T.britovi,T3)、伪旋毛虫(T.pseudospiralis,T4)、米氏旋毛虫(T.murrelli,T5)、纳氏旋毛虫(T.nelsoni,T7)、巴布亚旋毛虫(T.papuae,T10)及津巴布韦旋毛虫(T.zimbabwensis,T11),以及4个分类地位尚未确定的基因型,即Trichinella T6、T8、T9及T12[4]。我国现已发现存在有2个种,即旋毛虫和乡土旋毛虫[5]。2009年在台湾省还发生了因食海龟引起的旋毛虫病暴发,其病因可能为T10或T11。我国地域辽阔,动物种类和数量众多,是否还存在有其他种旋毛虫,目前尚不清楚。本文对我国西藏地区猪源旋毛虫地理株的形态、生殖力指数(Reproductive capacity index,RCI)及冷冻耐力(freezing tolerance)等生物学特性进行了研究,并与河南地理株进行了比较。
1 材料与方法
1.1 旋毛虫与实验动物 旋毛虫西藏株与河南株分别来自林芝与南阳猪源旋毛虫,由本教研室昆明小鼠传代保种。4周龄健康雄性昆明小鼠,18~20 g,购自郑州大学实验动物中心。
1.2 肌幼虫收集 将旋毛虫不同地理株感染小鼠后42 d拉颈处死,剥皮后剔除内脏和脂肪,先取一小块膈肌压片镜检,观察有无旋毛虫感染。然后将小鼠胴体称重,用人工消化液[0.1%胃蛋白酶(活性为1∶30 000)-0.7% 盐酸 -0.85%氯化钠]消化,肌肉与消化液之比为1 g∶10 ml。消化后按贝氏法收集纯净的旋毛虫肌幼虫,生理盐水反复洗涤后镜下计数[6]。
1.3 形态学观察
1.3.1 囊包大小:剖杀感染旋毛虫42 d的小鼠,将含有幼虫囊包的肉样压片后在光镜下(×100)观察,应用Image-Pro Express C软件测定90个囊包的长度与宽度,分别计算囊包长度和宽度的平均值及标准差。
1.3.2 肌幼虫长度:将分离的肌幼虫悬液滴于试管中,将其底部放入烧杯中水浴,边加热边轻微振荡试管,当烧杯内水温达到90℃时停止加热。取加热后的肌幼虫悬液滴于洁净的载玻片上,加盖片后在装有显微测微尺的光学显微镜下用低倍镜(×100)观察,用数码相机获取其图像,保存为计算机文件后进行测量和分析[7]。测量60条肌幼虫的长度,计算其均值。对于弯曲的虫体,用目镜测微尺分段测量,各段数值相加后即为肌幼虫长度。
1.3.3 生殖力指数(RCI):将20只昆明小鼠随机分为2组,每组10只,分别感染旋毛虫西藏株与河南株,每只小鼠经口感染300条肌幼虫。42 d后剖杀,消化全身肌肉后收集肌幼虫,计数RCI,RCI=实验动物感染旋毛虫后42 d回收的肌幼虫数/接种的肌幼虫数[8]。
1.3.4 冷冻耐力试验 :将分别感染旋毛虫河南株和西藏的小鼠肌肉(各100 g)剪碎成小米粒大小,分别平均分成5份,每份重20 g,置于塑料袋内-18℃冰箱中分别冻存 12、24、36、48、72 h,将冷冻肉样于室温下自然解冻3 h,然后将肌肉人工消化后计数活幼虫数。幼虫卷曲或在温水中活动为活幼虫,幼虫呈逗号和C字型并且在温水中不活动的为死幼虫。将50只小鼠随机分为10组(每组5只),每只分别经口感染-18℃保存12、24、36、48和72 h的旋毛虫河南株或西藏株300条幼虫,感染后42 d后剖杀,分别将小鼠肌肉人工消化后计数回收的幼虫数及RCI。另各取5份感染旋毛虫河南株和西藏的小鼠肌肉(每份重20 g),置于塑料袋内 -26 ℃分别冻存 12、24、36、48 h,如上所述方法观察活幼虫比例,分别接种4组小鼠(每组5只)后观察其感染性。
1.4 统计方法 采用SPSS 11.5统计分析软件进行数据处理和统计分析,采用本非参数检验和t检验。检验水准为α=0.05。
2 结果
2.1 旋毛虫西藏株囊包形态与大小 旋毛虫西藏株囊包呈长椭圆形,每个囊包内含1条幼虫(图1)。囊包长度与宽度见表1。经统计学分析,西藏株囊包长度和宽度与河南株囊包的差异均无统计学意义(t=1.312,t= -0.046,P 均> 0.05)。

图1 旋毛虫西藏株幼虫囊包形态(×100)

表1 旋毛虫河南株与西藏株幼虫囊包大小(n=90)
2.2 肌幼虫长度 旋毛虫西藏株和河南株的肌幼虫长度分别为(1 122.02 ±99.86)μm 和(1 105.66 ±46.96)μm,2个旋毛虫地理株肌幼虫长度的差异无统计学意义(t= -1.148,P >0.05)。
2.3 生殖力指数 旋毛虫西藏株与河南株在小鼠体内的生殖力指数分别为213.83±76.16和268.87±33.58,差异无统计学意义(Z= -1.681,P=0.093 >0.05)。
2.4 冷冻耐力试验 旋毛虫西藏株-18℃冷冻48 h之后仍然有卷曲的活幼虫,幼虫存活率为16.7%,冷冻72 h幼虫全部死亡。而旋毛虫河南株于-18℃冷冻48 h幼虫已全部死亡(表2)。从冷冻肉样中收集的幼虫接种小鼠后42 d回收的幼虫数与RCI见表3。旋毛虫西藏株经-18℃冻存12、24及36 h后的RCI均明显高于河南株(Z12= - 2.611,Z24= - 2.627,Z36= -2.795,P 均 <0.01)。西藏株 -18 ℃冻存48 h才完全失去感染性,而河南株-18℃冻存36 h即已失去感染性。
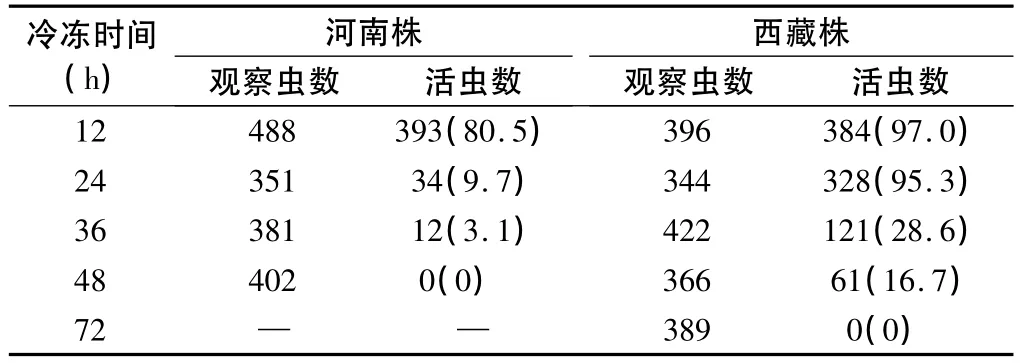
表2 旋毛虫西藏株与河南株-18℃冷冻不同时间后肌幼虫存活情况〔n(%)〕
当含有旋毛虫西藏株肌幼虫的肌肉经-26℃冻存12、24、36及48 h后的活幼虫比例分别为72.8%(650/893)、8.3%(53/635)、0.9%(11/1204)及 0%(0/1307),接种小鼠后的 RCI分别为 0.50 ±0.015、0.20±0.008、0及0;而含有河南株肌幼虫的肌肉经-26℃冻存12、24 h后的活幼虫比例仅分别为5.4%(29/536)及0%(0/718),接种小鼠后的RCI分别为0.3±0.015及0。旋毛虫西藏株经-26℃冻存12、24 h后的RCI均明显高于河南株(Z12=-2.652,Z24=-2.805,P 均 <0.01)。
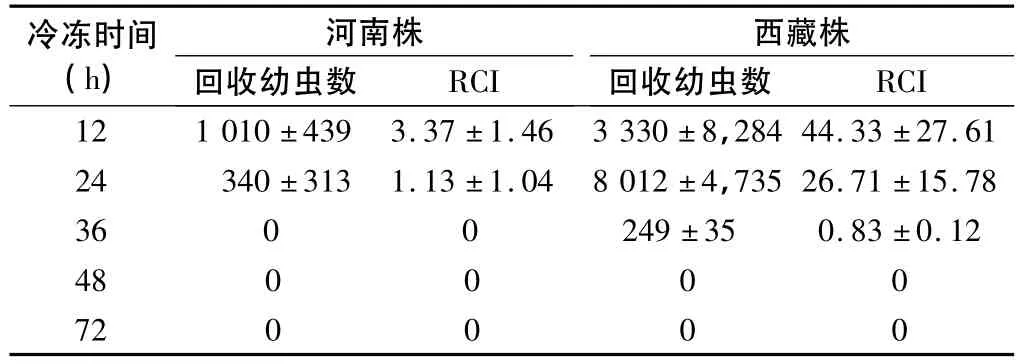
表3 旋毛虫西藏株与河南株-18℃冷冻不同时间接种小鼠后的RCI
3 讨论
本研究中所用的旋毛虫西藏株与河南株经PCR等方法鉴定均属于 T.spiralis(T1)[9],这2个旋毛虫地理株的囊包与肌幼虫大小与生殖力指数均无明显差异,表明肌幼虫形态与生殖力指数仅能作为旋毛虫属分类的参考,而不能作为区分旋毛虫种和地理株的生物学特征[10]。
冷冻耐力是旋毛虫的生物学特性之一,是旋毛虫对寒冷环境长期适应和耐受的一个自身调整的过程,也是宿主和旋毛虫之间相互作用的结果,已成为旋毛虫属分类与鉴定中的一个常用指标[11]。旋毛虫肌幼虫对低温的耐受力直接受宿主类型、地理环境与温度、虫龄等多种因素的影响[12,13]。本研究发现旋毛虫西藏株对低温的耐受力明显高于河南株,可能与西藏株长期处于低温环境、已经形成了对低温的适应性有关。西藏林芝地区与河南南阳地区的平均气温分别为8.7℃和14.4~15.7℃,且林芝地区一年内低温的时间段明显多于南阳地区。目前,在一些国家出售猪肉及其肉制品之前经过冷冻处理已经成为一种降低旋毛虫感染风险的安全措施之一,但对新鲜肉类在一定的温度下冷冻足够的时间才能完全杀死旋毛虫[14,15]。如猪肉应切成小于15 cm厚的肉块,在 -15℃冷冻20 d、-23℃冷冻10 d,-29℃ 冷冻6 d,其中的旋毛虫才能完全丧失感染性,且冷冻处理仅对猪肉中的T.spiralis有效,而对抗低温的T.nativa则无效。本文结果表明旋毛虫西藏株经-18℃冻存36 h、-26℃冻存24 h后部分虫体仍有感染性。
冷冻处理肉类虽有可能降低旋毛虫肌幼虫的感染性和生殖力,其效果受旋毛虫虫种、肉块大小、温度、冷冻时间等多种因素的影响,在实际应用中冷冻处理肉类对旋毛虫幼虫的杀伤效果较难进行评价。因此,在流行区进行健康教育仍是预防旋毛虫病的关键措施。改变不良的饮食习惯和烹饪方法,不生食或半生食猪肉及其它动物肉类和肉制品。尤其是在西藏等高原地区,肉类及肉制品应完全做熟,以确保肉类食品安全[16]。试验表明,只有当肉块中心温度达到71℃时囊包内的旋毛虫幼虫才可被杀死。
[1]Wang Z Q,Cui J.Epidemiology of human trichinellosis in China during 1964 - 1999[J].Parasite,2001,8(Sppl):S63-S66.
[2]Wang Z Q,Cui J,Xu B L.The epidemiology of human trichinellosis in China during 2000 -2003[J].Acta Trop,2006,97(3):247-251.
[3]Cui J,Wang Z Q,Xu B L.The epidemiology of human trichinellosis in China during 2004 -2009[J].Acta Trop,2011,118(1):1-5.
[4]王中全,崔晶.旋毛虫属分类的研究进展[J].中国寄生虫学与寄生虫病杂志,2002,20(5):310.
[5]Wang Z Q,Cui J,Shen L J.The epidemiology of animal trichinellosis in China[J].Vet J,2007,173(2):391-398.
[6]Li F,Cui J,Wang Z Q,et al.Factors affecting the sensitivity of artificial digestion and its optimization for inspection of Trichinella spiralis in meat[J].Foodborne Pathog Dis,2010,7(8):879-885.
[7]郭鄂平,曾凡龙,王珺.旋毛虫幼虫形态显微测量方法分析[J].畜牧与兽医,2005,37(4):32-34.
[8]Belosevic M,Dick T A.Trichinella spiralis:comparison of stages in host intestine with those of an Arctic Trichinella sp[J].Exp Parasitol,1979,48(3):432-446.
[9]Wang Z Q,Li L Z,Jiang P,et al.Molecular identification and phylogenetic analysis of Trichinella isolates from different provinces in mainland China[J].Parasitol Res,2011,110(2):753-757.
[10]Pozio E,Darwin Murrell K.Systematics and epidemiology of Trichinella[J].Adv Parasitol,2006,63:367-439.
[11]Smith H J.Differentiation of Trichinella spiralis and Trichinella nativa based on resistance to low temperature refrigeration[J].Can J Comp Med,1983,17(4):501-502.
[12]Malakauskas A,Kapel C M.Tolerance to low temperatures of domestic and sylvatic Trichinella spp.in rat muscle tissue[J].J Parasitol,2003,89(4):744-748.
[13]Hill D E,Forbes L,Gajadhar A A,et al.Viability and infectivity of Trichinella spiralis muscle larvae in frozen horse tissue[J].Vet Parasitol,2007,146(1 -2):102-106.
[14]Medina-Lerena M S,Ramirez-Alvarez A,Kühne M,et al.Influence of different processing procedures on the reproductive capacity of Trichinella spiralis in pork meat[J].Trop Anim Health Prod,2009,41(4):437-442.
[15]Gamble H R,Bessonov A S,Cuperlovic K,et al.International Commission on Trichinellosis:recommendations on methods for the control of Trichinella in domestic and wild animals intended for human consumption[J].Vet Parasitol,2000,93(3-4):393-408.
[16]Gajadhar A A,Pozio E,Gamble H R,et al.Trichinella diagnostics and control:mandatory and best practices for ensuring food safety[J].Vet Parasitol,2009,159(3-4):197-205.
