食品中沙门氏菌LAMP快速检测方法的建立
2012-07-19黄金海孙跃辉庄世文王静思
黄金海,孙跃辉,陈 瑞,庄世文,刘 莹,王静思
(1. 天津大学化工学院,天津 300072;2. 华南农业大学动物医学院,广州 510642)
沙门氏菌是肠杆菌科中一大类重要的食源性致病菌,沙门氏菌引起的中毒病例位居世界各地食物中毒的首位.WHO食源性疾病监控计划显示,欧洲每年约有160,000人感染沙门氏菌,大约每 100,000人中有 35人感染[1],每年用于沙门氏菌的防控和治疗费用高达28亿欧元[2].在我国,70%~80%细菌性食物中毒事件是由沙门氏菌引起,引起沙门氏菌中毒的食品中,约90%是肉、蛋、奶等畜产品[3].沙门氏菌感染畜禽后可引发一系列疾病,在动物屠宰过程中,肠道中的致病菌会污染屠宰环境或被带到内脏与体表,成为畜禽肉胴体、畜禽产品污染的重要来源[4-5].卫生检测要求中,世界各国普遍规定食品中不得检出沙门氏菌.
沙门氏菌传统的检测方法大多采用细菌分离、生化鉴定表型方法、基于抗体的免疫学方法等,在快速、敏感与特异性等方面有局限性[6].PCR法需要昂贵的循环仪,不适于基层快速检测.环介导等温扩增技术(loop-mediate isothermal amplification,LAMP)是一种新颖的核酸扩增技术,它依赖于识别靶 DNA上6个特定区域的4条引物和具有链置换活性的Bst DNA聚合酶,在恒温条件下高效扩增核酸,反应结果可通过肉眼观察,具有高特异性、快速灵敏、操作简单等特点.自 2000年该技术开发以来,LAMP技术在临床疾病的诊断、流行性细菌以及病毒的检测等方面应用广泛[7-9].笔者针对沙门氏菌侵袭性因子 A基因(invA)设计一套 LAMP引物,对 7种血清型的沙门氏菌进行检测,优化反应条件,验证其特异性和灵敏度,并应用于食品的检测,建立了沙门氏菌检测方法.
1 材料与方法
1.1 菌株
菌株名称及编号见表 1,本实验室分离、鉴定和保存.
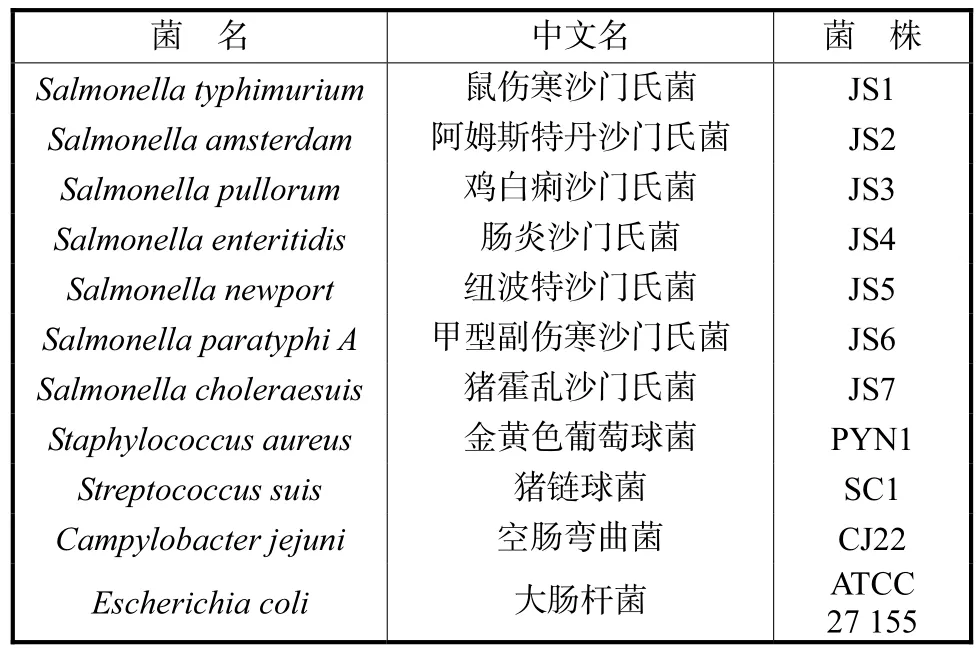
表1 实验用菌株Tab.1 Bacterial strains used in the experiment
1.2 主要试剂和仪器
细菌基因组 DNA抽提试剂盒(天根生化科技有限公司),DNA-LAMP扩增试剂盒(荣岩化学株式会社,日本),LA-320CE实时浊度仪(荣岩化学株式会社,日本).
1.3 方法
1.3.1 DNA模板的制备
(1) 试剂盒法:按照试剂盒说明书提取细菌基因组DNA.
(2) 煮沸法:细菌纯培养物 1,mL于12,000,r/min离心 5,min,加入 100,µL 无菌水,混匀后,煮沸10,min,冰浴 2,min,12,000,r/min离心 5,min,上清液备用.
1.3.2 引物设计与合成
根据GenBank公布的沙门氏菌 invA基因(登录号:EU348365)中保守序列,设计一套特异性的LAMP引物,包括外引物 F3、B3,2条内引物 FIP、BIP和2条环引物LF、BF.引物由Invitrogen公司合成,引物序列见表2.
1.3.3 LAMP反应和结果判定
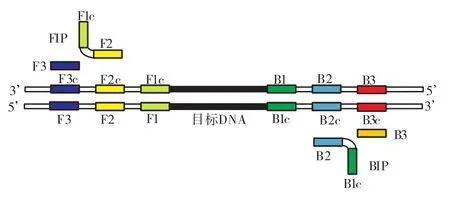
图1 LAMP引物设计示意Fig.1 Schematic representation of LAMP primer design
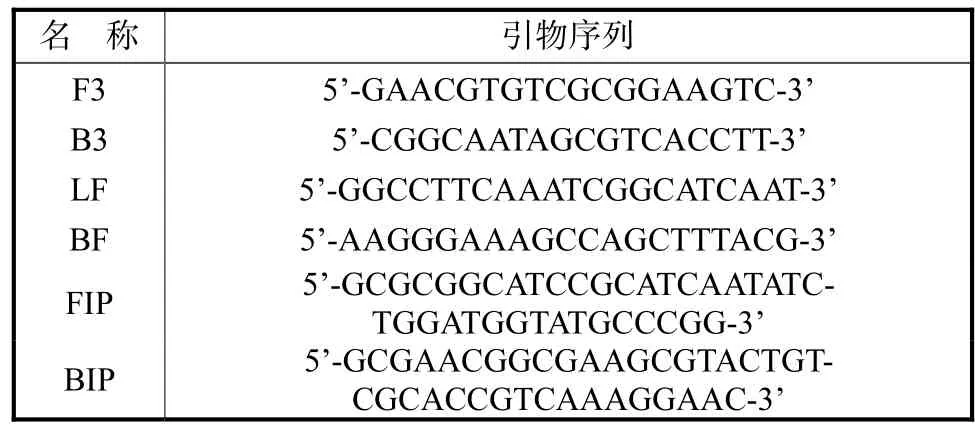
表2 扩增invA基因的LAMP引物序列Tab.2 DNA oligonucleotide primer Sequence of LAMP for the invA gene
反应体系包括反应缓冲液 12.5,µL,Bst DNA 聚合酶 1.0,µL,DNA 模板 2.0,µL,外引物 F3、B3 各5,pmol,内引物 FIP、BIP 各 40,pmol,环引物 LF、BF各20,pmol,最后加入去离子水至总体积为25,µL.混匀后,置于 LA-320CE浊度仪,于 63,℃温浴60,min,80,℃灭活 2,min.
反应过程中,LA-320CE浊度仪对反应体系的浊度进行实时测量,每 6,s检测一次体系在 650,nm处的吸光度,生成浊度变化曲线,当反应体系浊度超过0.25以及浊度的变化速率大于0.1时,结果判定为阳性.也可通过肉眼观察反应体系的浊度变化判定结果.
1.3.4 特异性实验
用建立的 LAMP方法,分别对 7种不同血清型的沙门氏实验菌株进行检测,同时以金黄色葡萄球菌、大肠杆菌、猪链球菌和空肠弯曲菌作对照,验证方法的特异性.
1.3.5 灵敏度试验
基因组 DNA检测灵敏度:用试剂盒提取鼠伤寒沙门氏菌(JS1)基因组 DNA并测定其浓度,10倍倍比稀释,DNA 原液至 10-1~10-7(体积分数,下同),各取2,µL 作为模板进行LAMP反应.
细菌纯培养物检测灵敏度:将培养过夜的鼠伤寒沙门氏菌(JS1)菌液 10倍倍比稀释至 10-1~10-6,取各稀释度菌液 100,µL 进行平板菌落计数,每组设 3个重复.同时,取各稀释菌液 1,mL,用煮沸法提取DNA,取 2,µL上清液作为模板进行 LAMP扩增,利用LA-320CE对扩增结果进行实时检测.
1.3.6 食品样品检测
取细菌培养、常规 PCR沙门氏菌检测阴性的猪肉 10,g,无菌操作置于匀浆机并加入 90,mL 缓冲蛋白胨水(BP),制备 1∶10稀释的均质液备用.取10,mL猪肉匀浆液,接入已知浓度的鼠伤寒沙门氏菌标准菌株(JS1),混匀后作为食品样品原样,之后以匀浆液为稀释液10倍倍比稀释,37,℃培养12,h后,各取1,mL用煮沸法提取DNA,进行LAMP扩增.
2 结 果
2.1 沙门氏菌LAMP检测方法的建立
以设计的一套特异性引物对沙门氏菌标准菌株(JS1)基因组 DNA进行 LAMP扩增,检测结果见图2.由图 2(a)可知,以沙门氏菌标准菌株(JS1)基因组DNA 为模板的扩增通道,吸光度大于 0.5,判断为阳性,而以水为阴性对照的通道未出现扩增;由图2,(b)判定曲线可知,当扩增反应进行到 16,min左右时,通道1浊度的变化速率为0.104,判为阳性.结果表明该引物能够有效地扩增沙门氏菌 invA基因,检测时间约为16,min.

图2 沙门氏菌标准菌株LAMP检测结果Fig.2 LAMP results of Salmonella standard strain
2.2 特异性实验
特异性实验结果如图3所示,仅7株沙门氏菌出现LAMP扩增,检测结果为阳性,其他4种菌均无扩增值,检测结果为阴性,表明该引物特异性强.
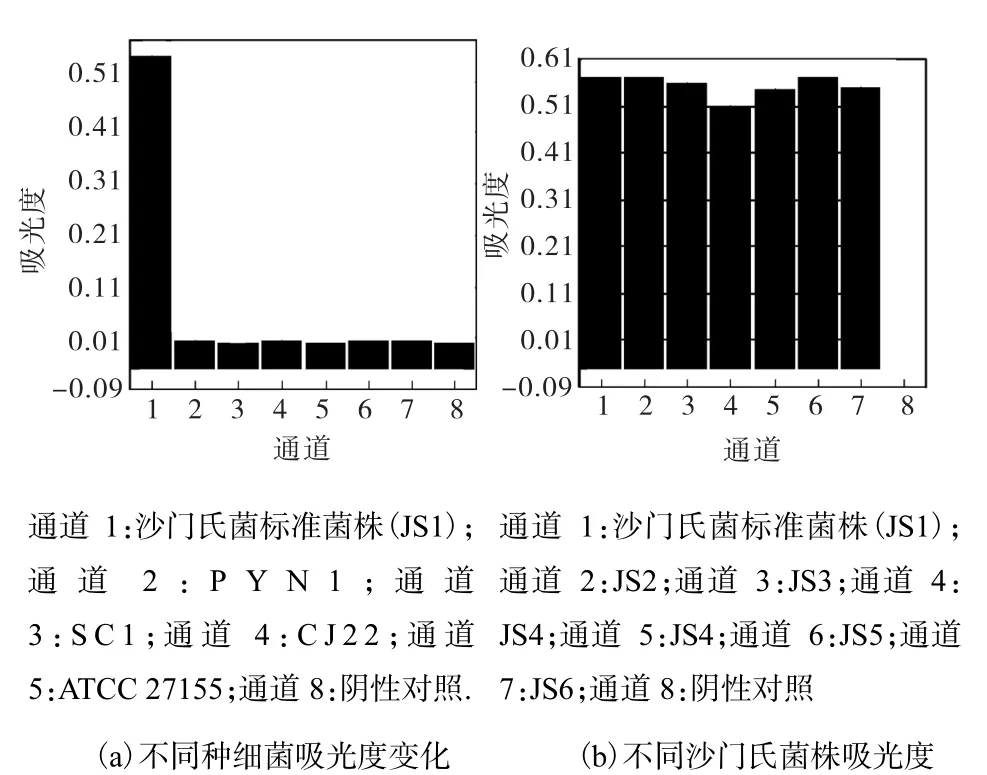
图3 沙门氏菌LAMP特异性实验结果Fig.3 Specificity of Salmonella LAMP assay
2.3 灵敏度实验
2.3.1 基因组DNA检测灵敏度
沙门氏菌标准菌株(JS1)基因组 DNA浓度为45,ng/µL.10倍倍比稀释DNA原液进行LAMP检测,结果显示基因组DNA检测限约为900,fg,见图4.
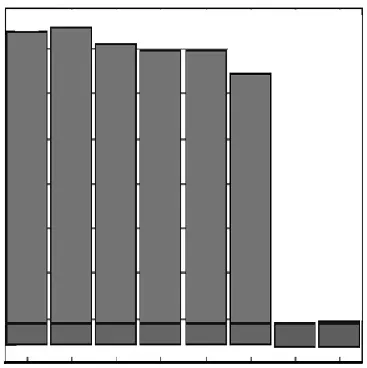
图4 沙门氏菌基因DNA LAMP检测灵敏度Fig.4 Sensitivity of Salmonella genomic DNA LAMP assay
2.3.2 细菌培养物检测灵敏度
经平板计数,原始菌液浓度为 3.36×106,mL-1.10倍倍比稀释菌液进行 LAMP检测,结果该法细菌纯培养物检测限约为3.36×106,mL-1,见图5.
2.3.3 食品样品中沙门氏菌的检测
采用无菌的猪肉匀浆构建食品样品模型,加入已知浓度的沙门氏菌培养液,构建人工感染的食品原样模型,使得食品原样模型中沙门氏菌浓度为 8.25×103,mL-1,亦即模拟食品原样中沙门氏菌的浓度为8.25×104,g-1.通道 1为猪肉匀浆中加入已知浓度沙门氏菌培养液作为食品原样,通道2~通道5分别为食品原样的 10倍梯度稀释,作为食品样品,提取DNA进行 LAMP检测,通道 8为无菌的猪肉匀浆.结果见图 6,通道 1~4均出现明显的扩增,通道5和通道8无扩增,结果表明该法直接检测食品样品的检测限为8.25,g-1.
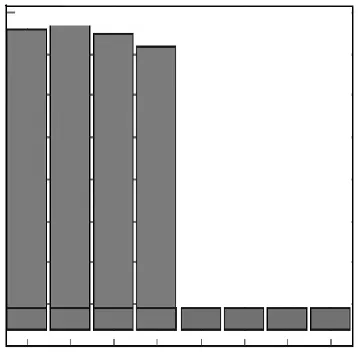
图5 沙门氏菌细菌培养物LAMP检测灵敏度Fig.5 Sensitivity of Salmonella LAMP assay

图6 模拟食品样品中沙门氏菌LAMP检测灵敏度Fig.6 Sensitivity of Salmonella LAMP assay in artificially contaminated food
3 讨 论
沙门氏菌是一种人畜共患的病原菌,能引起人和动物多重共患病,而食源性沙门氏菌污染检测主要还是传统的培养法,费时费力,不利于在沙门氏菌暴发流行时准确、快速地确定传染源和传染途径,控制其流行.PCR方法敏感、准确、快速,目前已广泛用于食品中以及临床样品和环境中的沙门氏菌的检测,但由于需要昂贵的仪器设备、较高检测费用以及对检测人员较高的技术要求而使其不适用于现场快速检测及基层应用.LAMP依赖于能识别靶DNA上6个特定区域的4条引物和具有链置换活性的Bst DNA聚合酶,在恒温条件下高效扩增核酸,保证了扩增的高特异性和高效性,在反应过程中核酸大量合成,从dNTPs析出的焦磷酸根离子与反应体系中的镁离子结合,产生扩增反应副产物-焦磷酸镁白色沉淀,反应体系浊度发生变化,肉眼可见[10],不需要昂贵的仪器,只需要一个恒温的水浴即可实现检测,操作简单,便于现场快速检测和基层应用.也可以通过 LA-320CE实时浊度仪进行实时反应及终产物的一步检测.
引物设计对于建立 LAMP方法非常重要,是检测沙门氏菌成功与否的关键.用来设计引物的基因主要分 3类,即属特异性引物基因、血清群特异性引物基因与血清型特异性引物基因.沙门氏菌的inv基因族具有属特异性,inv基因族包括 invA、invB、invC、invD和invE等一组系列基因,它们在沙门氏菌中广泛分布,而 invA基因编码的蛋白在细菌的致病过程中起着重要的作用[6,11].对沙门氏菌 invA 基因序列分析表明,沙门氏菌属的不同沙门氏菌菌株的invA基因核苷酸序列存在较高的同源性,BLAST检索与其他生物无同源关系,因此,invA基因是沙门氏菌的主要特征区域,常作为基因检测和鉴定的依据[12].本研究选择与食品安全和公共卫生密切相关的肠炎沙门氏菌、鼠伤寒沙门氏菌、猪霍乱沙门氏菌和鸡白痢沙门氏菌等为研究对象,选择 invA基因设计引物,对 7种不同血清型的沙门氏菌都能有效扩增,而非沙门氏菌不扩增,说明设计的引物对具有沙门氏菌属特异性,可用于沙门氏菌的检测.
与沙门氏菌培养物相比,食品中沙门氏菌的检测具有更大的难度.直接用 LAMP检测食品中的沙门氏菌面临的一个问题是不能将活菌和死菌区别开来.由于检测的灵敏性高,即使是样品中存在死亡沙门氏菌的 DNA也会产生阳性结果,但死亡沙门氏菌的存在对食品安全并不构成威胁,所以建立能够区分死菌和活菌的方法对沙门氏菌检测较为重要.为此,在LAMP检测之前,需要选择性增菌,以减少来自样品中死亡沙门氏菌的 DNA的影响,从而增加了检测方法对样品生物安全评估的可信度,同时也提高了食品中沙门氏菌的检出率.应用建立的LAMP方法,液体样品中沙门氏菌检出下限为 336,mL-1,而常规PCR 的检出线一般在 103~105,mL-1活菌水平[13].应用建立的LAMP方法,经增菌培养程序后,可检出含菌量为8.25,g-1的阳性肉品.
应用LAMP方法对沙门氏菌进行检测,从检测结果来看,方法特异、敏感,可有效检测样品中的沙门氏菌;检验周期短,每一批样品从样品准备到检出只需要2,h,如果将增菌时间计算在内,也仅需要15,h;操作简单,检测成本低,不需要昂贵的检测设备,检测结果肉眼可见,可适应国境口岸方便快捷的需要,在基层检测中易于推广,具有较高的实用价值.
4 结 语
应用所建立的 LAMP方法检测沙门氏菌 invA基因,在检出时间、灵敏度方面优于其他血清学及PCR方法,通过富集增殖后进一步提高了灵敏度和检出率,降低了复杂食品原料对检出率的影响,LAMP方法还可通过眼观进行判定,适用于基础应用.沙门氏菌 invA基因检测的 LAMP方法,可作为动物沙门氏菌感染、进出口检疫、食品及其原料中沙门氏菌污染快速检测及其安全性评价的手段.
[1] Anonymous. The community summary report on trends and sources of zoonoses,zoonotic agents,antimicrobial resistance and foodborne outbreaks in the European Union in 2006[J]. The EFSA Journal,2006,130:1-352.
[2] Byrne D. Zoonoses:Commissioner David Byrne welcomes new legislation to combat food-borne diseases such as Salmonella(IP/03/1306)[R]. European Commission,2003.
[3] 曾晓芳. 畜产品中沙门氏菌污染的检测与控制[J]. 四川畜牧兽医,2003,30(4):28-29.Zeng Xiaofang. Inspection and control of Salmonella pollution in domestic animal products[J]. Sichuan Animal and Veterinary Sciences,2003,30(4):28-29(in Chinese).
[4] Nowak B,von Müffling T,Chaunchom S,et al. Salmonella contamination in pigs at slaughter and on the farm:A field study using an antibody ELISA test and a PCR technique [J]. International Journal of Food Microbiology. 2007,115(3):259-267.
[5] McGuinness S,McCabe Evonne,O’Regan Edel,et al.Development and validation of a rapid real-time PCR based method for the specific detection of Salmonella on fresh meat [J]. Meat Science,2009,83(3):555-562.
[6] 钟伟军,赵秋明,张彩虹,等. 食品中沙门氏菌 PCR快速检测方法的建立[J]. 中国人畜共患病学报,2007,23(12):1216-1221.Zhong Weijun,Zhao Qiuming,Zhang Caihong,et al.Development of polymerase chain methods for Salmonella detection in foods[J]. Chinese Journal of Zoonoses,2007,23(12):1216-1221(in Chinese).
[7] Ihira Masaru,Ohta Akane,Sugata Ken,et al. Loopmediated isothermal amplification for discriminating between human herpesvirus 6 A and B [J]. Journal of Virological Methods,2008,154(1/2):223-225.
[8] Curtis K A,Rudolph D L,Owen S M. Rapid detection of HIV-1 by reverse transcription,loop-mediated isothermal amplification(RT-LAMP)[J]. Journal of Virological Methods,2008,151(2):264-270.
[9] Gao Hongwei,Lei Zhiwen,Jia Juntao,et al. Application of loop-mediated isothermal amplification for detection of Yersinia enterocolitica in pork meat [J]. Journal of Microbiological Methods,2008,77(2):198-201.
[10] Mori Y,Nagamine K,Tomita N,et al. Detection of loop-mediate isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochem Biophys Res Commun,2001,289(1):150-154.
[11] Bülte M,Jakob P. The use of a PCR-generated invA probe for the detection of Salmonella spp. in artificially and naturally contaminated foods [J]. International Journal of Food Microbiology,1995,26(3):335-344.
[12] 陈金顶,索青利,廖 明,等. 沙门氏菌的invA基因序列分析和分子检测[J]. 中国人畜共患病杂志,2004,20(10):868-871.Chen Jinding,Suo Qingli,Liao Ming,et al. DNA sequence analysis and molecular detection of invA gene from Salmonella spp.[J]. Chinese Journal of Zoonoses,2004,20(10):868-871(in Chinese).
[13] Masashi Okamura,Yousuke Ohba,Shuichi Kikuchi,et al. Loop-mediated isothermal amplification for the rapid,sensitive,and specific detection of the O9 group of Salmonella in chickens[J]. Veterinary Microbiology,2008,132(1/2):197-204.
