对金属过量时铜铁与浓硫酸反应过程的认识
2012-07-17杨玉梅陈继生
杨玉梅 陈继生
(陕西师范大学化学化工学院 陕西 西安 710062)
浓硫酸与金属单质的反应是高中化学中“硫酸的性质”的教学重点,一般师生都知道Fe和Al常温下在浓硫酸中会发生钝化,Cu和浓硫酸要在加热的条件下才能进行反应,那么当反应容器中的浓硫酸与金属的量涉及过量与不足的问题时又会出现什么情况呢。浓硫酸与金属Cu在加热的条件下反应的化学方程式如下:
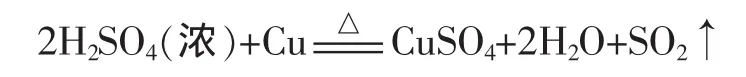
从这个化学方程式可以看出,每2mol H2SO4反应后会生成2mol H2O。毫无疑问,当浓硫酸的量远大于金属,即使将金属与浓硫酸完全反应,反应所生成的H2O也不会使浓硫酸的浓度发生较大的变化时,金属肯定能够反应完全。
反之,当金属过量时,情况又会怎样呢?首先来看下面这道常见的高中化学题:
向50mL18mol·L-1的硫酸溶液中加入足量铜片并加热充分反应后,被还原的硫酸的物质的量为( )
A.小于 0.45mol B.等于 0.45mol
C.在 0.45mol~0.9mol之间 D.大于 0.9mol
对于该题有很多高中学生和老师都会选择A选项,理由是当硫酸反应到一定程度时,由于H2SO4的消耗以及生成的H2O对浓硫酸的稀释作用,使得浓硫酸变成稀硫酸,而Cu不能与稀硫酸反应,因此,硫酸不能反应完全。
以上分析思路有一定的合理性,但事实是这样的吗?本文接下来将根据国内外的相关研究对此加以分析,一探究竟。
用98%的浓硫酸和过量的铜粉在加热条件下进行实验,结果发现硫酸几乎被完全消耗。在2011年10月,徐州市第一中学的宋志贵也发表了相同结果的文章,认为由于反应在加热的条件下进行,水不断被蒸发,所以实际上硫酸一直维持着较高的浓度[1]。我们知道,稀硫酸和Cu不反应。既然过量的Cu能将H2SO4消耗完,那么在整个反应过程中硫酸的浓度肯定要维持在较高的水平上,只是铜粉与浓硫酸反应生成的H2O去向如何,唯一的合理解释便是蒸发了。但在这个反应中,H2O为什么能被蒸发?所需热量又来自于何处?
美国肯特州立大学的R.Thomas Myers曾经研究了硫酸的沸点和汽化热,其中纯硫酸是不稳定的,会自动地发生分解,所以硫酸中除了H2SO4以外还包含有HSO4-、H3SO4+、H3O+、H2S2O7-、H2S2O7+和 H2O。 当质量分数为98.33%时,硫酸是最稳定的,在这个浓度下H2SO4与H2O形成了最高恒沸混合物,存在最高恒沸点338.8℃(标准大气压)[2]。 100%的硫酸的沸点是 290℃(标准大气压),纯净水的沸点为100℃(标准大气压)。根据这些数据可以作硫酸在标准大气压下的非理想二组分液态混合物相图(T—w图)如图1所示。从图中可以明显看出,当硫酸的浓度小于98.33%时,其沸点会随着硫酸浓度的增大而升高。在硫酸汽化的过程中还应存在一个两相平衡区,当体系达到一定温度后,低沸点的H2O会先被蒸发出来,而高沸点的H2SO4则被保留并且浓度不断升高。所以如果浓硫酸与金属反应的过程中有足够的热量放出,硫酸就能够维持着较高的浓度,即使金属过量,H2SO4仍可以被完全消耗。

图1 H2O—H2SO4的T—w图
浓硫酸与Cu、Fe等金属反应一般需要在酒精灯加热的条件下进行,该过程水分蒸发所需热量的来源有两个,其中之一是酒精灯火焰所提供的热量。酒精灯的加热温度为 400~500℃,而硫酸的最高恒沸点仅为338.8℃,因此单靠酒精灯提供的热量就足以使H2O蒸发掉,从而使硫酸始终保持着较高的浓度,直至其被完全消耗。需要注意的是,要使硫酸中的H2O蒸发掉,体系的温度并非只需达到纯水的沸点(100℃)就可以了。在硫酸中H2O和H2SO4形成了共沸物,要使H2O蒸发,所需温度实际上比纯水的沸点高得多,这一点从硫酸的相图中也可以看出,随着硫酸浓度不断升高至接近98.33%,气液两相平衡区的温度也在不断升高。另外一个热量来源,是反应生成的H2O与体系中的H2SO4作用所放出的热量。在稀释浓硫酸的过程中,正确的操作是将浓硫酸沿烧杯壁缓慢倒入盛有水的烧杯中,并且边倒入边搅拌,而不能将水倒入盛有浓硫酸的烧杯中。因为在这个过程中H2O与H2SO4作用会放出大量的热,如果将水倒入浓硫酸中,产生的热量来不及扩散就会导致浓硫酸表层的水暴沸将硫酸溅出,非常危险。当然这也表明H2O与H2SO4作用放出的热量是相当大的。一份H2SO4与一份占其质量33.8%的H2O混合放出的热量最高可以达到使体系的温度升高到159℃,此外1mol H2SO4和1mol H2O混合可以放出6.71cal的热量[3]。从浓硫酸与Cu在加热的条件下反应的化学方程式可以看出每消耗1mol H2SO4便会生成1mol H2O,不过在反应过程中反应生成的H2O会伴随着酒精灯的加热不断消耗,所以反应生成的H2O与体系中H2SO4作用放出的热量并不像等量的H2SO4和H2O混合所放出来的热量表现的那么明显,但这些数据充分可以说明,除了酒精灯提供的热量以外,反应生成的H2O与体系中H2SO4作用放出的热量对硫酸浓度维持在一个较高的水平上也做出了一定的贡献。
综上所述,浓硫酸和金属在酒精灯加热的条件下进行反应,当金属的量大于H2SO4时,H2SO4可以被完全消耗,主要是因为酒精灯提供的足够的热量和反应生成的H2O与体系中H2SO4作用放出的热量使整个过程中H2O不断被蒸发,硫酸维持在了一个较高的浓度水平上。
[1] 宋志贵.对铜和浓硫酸反应的再认识[J].中学化学教学参考,2011,(10):64
[2] R.Thomas Myers.What is the Boiling Point and Heat of Vaporization of Sulfuric Acid [J].Journal of Chemical Education,1983,60(12):1017~1018
[3] I.A.Leenson.Sulfuric Acid and Water: Paradoxes of Dilution[J].Journal of Chemical Education,2004,81(07):991~994
