SF6气体的富集与解吸方法
2012-07-10袁园曾可周国庆甘宗煜
袁园,曾可,周国庆,甘宗煜
(西北核技术研究所,西安 710024)
SF6气体的富集与解吸方法
袁园,曾可,周国庆,甘宗煜
(西北核技术研究所,西安 710024)
介绍SF6的低温富集及高温解吸方法。测定了SF6在Porapak Q和Porapak T两种吸附剂上的动态吸附系数(kd)。结果显示,Porapak Q对SF6的吸附性能明显优于Porapak T,温度是影响kd值的主要因素之一,温度和kd的关系符合Arrhenius方程,实验范围内的样品气流量对kd的影响较小。SF6解吸前需预抽真空至30 kPa,然后放入热水浴中恒温30 min,用N2洗提,逐段收集洗提气体,洗提流量为2 mL/min。当解吸体积为7 mL时,回收率可达到90%以上,富集系数可达到102量级。
SF6;动态吸附;Porapak Q;回收率;富集系数
SF6是一种无色、无嗅、无毒、无腐蚀性、不易燃烧的气体,微溶于水。大气圈和地下水中的SF6一部分来源于自然界,一部分来源于人类工业活动。SF6的工业化生产始于1953年,主要用作工业制冷剂和高压电器绝缘材料。近年来北半球大气中SF6的体积分数每年增长约7%[1],但大气中SF6含量仍然很低。因此分析化学中将SF6广泛应用于气体示踪,密封容器、仪器的检漏及年轻地下水的年龄测定。通过分析地下水中SF6的体积分数,根据亨利定律可以得到地下水补给时大气中SF6的体积分数,将其与SF6在大气中的增长历史相比较,就可以确定地下水的年龄参数。通过研究地下水年龄,可以示踪地下水的循环过程与路径,了解地下水的滞留时间与可更新能力,为地下水中迁移行为的研究提供参考依据[2–4]。
由于地下水中的SF6含量极低,需要通过吹扫富集的方法进行分析。M. Maiss[5]使用Porapak Q填料制作的捕集阱,低温下富集大体积样品,冷浴介质是干冰或异丙醇,电加热控温温度为100℃,使捕集阱能彻底释放SF6,该方法能高精度地分析低混合比例的样品,但操作较为繁琐。张俊刚、蔡鹤生等[6]用Porapak Q填料在–80℃的温度下吸附SF6,以热水浴于95℃下解吸,SF6的回收率为83.5%。Vollmer[5]采用Porasil C和Porapak T制作的双冷阱提取富集方法,使SF6提取效率达到了98%,降低了分析方法的检测限,但双冷阱对实验室条件要求较高,不易普及。笔者使用液氮作为制冷剂,实验了SF6在Porapak Q和Porapak T上的动态吸附性能,并对吸附条件进行了优化。
1 实验部分
1.1 主要仪器与试剂
气相色谱仪:HP6890型,带μ–ECD检测器,美国安捷伦科技公司;
填料:Porapak Q和Porapak T,粒径为165~198 μm(80~100目), 美国奥泰科技有限公司;
高纯N2:纯度大于99.999 5%,北京氦谱北分气体工业有限公司;
SF6标准气:体积分数为5×10–11,不确定度小于2%,北京兆格气体科技有限公司。
1.2 SF6气体的低温富集方法
气体的吸附效果主要受吸附剂和吸附温度的影响。由于SF6的沸点较低(–63.8℃),挥发性很强,因此通常选用低温进行富集。R. Wanninkhof等[8]实验发现SF6能够在–80℃条件下完全被Porapak Q填料所吸附,其它如Porasil C,Porapak T和Carboxen 1000等也被用作吸附材料,但吸附效果都不如Porapak Q填料。
笔者实验了SF6在Porapak Q和Porapak T上的动态吸附性能,并对吸附条件进行了优化。
SF6动态吸附实验装置示意图见图1。
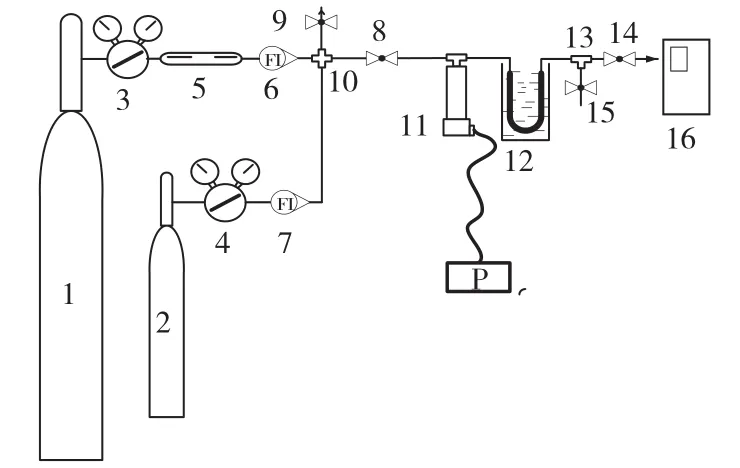
图1 SF6动态吸附实验装置示意图
具体实验方法如下:
(1)样品气配制
高纯氮及体积分数为5.2×10–12的SF6标准气体分别经过转子流量计调节流量后,配制成合适浓度的SF6样品气。
(2)吸附阱
吸附柱内装有一定质量的吸附剂,在马弗炉内通氮气老化12 h,老化温度为200℃,载气流速为20 mL/min。将老化好的吸附柱放置在装有乙醇和液氮混合物的保温杯中,吸附温度由乙醇和液氮的配比确定。
(3)动态吸附实验
SF6样品气流过吸附柱,然后进入色谱定量管,采用HP6890型气相色谱仪的序列运行模式,实时监测流出气体中的SF6浓度,绘制SF6吸附曲线。
用动态吸附系数(kd)来表征吸附剂的吸附能力,其值按式(1)计算[4]:

式中:kd—动态吸附系数,cm3/g;
F—SF6标准气体流量,cm3/min;
tm—SF6流出吸附阱的体积分数为源气体50%
体积分数时的流出时间,min;M—吸附剂的质量,g。
1.3 SF6的解吸方法
根据(5)式可以得出误差修正项系数为-1.127097、-1.992243和-0.252994,均小于零,与反向的误差修正机制相符,这说明中国能源消费、环境污染和经济增长之间存在长期均衡的关系。同样,也说明中国能源消费与环境污染的涨幅变化呈现与上期相反的方向,并且在上期偏离均衡位置上,当期的调整幅度也较大。误差修正模型证明了中国能源消费、环境污染与经济增长之间不仅有长期均衡关系,而且还有短期波动关系,它表明了能源消费和环境污染不仅是经济增长的长期约束,也是经济增长的短期限制。
Wanninkhof等[8]实验发现将被吸附的SF6加热至100℃时可实现完全解吸释放。笔者实验发现,直接用沸水浴加热吸附柱,SF6的解吸速度慢,解吸时间长,解吸气体体积大,回收率较低,SF6很难完全解吸。而选用负压解吸,不仅解吸完全,而且解吸气体体积较小。具体解吸流程如下:吸附完成后,将吸附柱抽真空至30 kPa,然后放入热水浴中恒温30 min,用N2洗提,逐段收集洗提气体,用气相色谱分析洗提气体中SF6的浓度,确定解吸体积并计算回收率。
回收率计算公式如式(2):

式中:η—SF6的回收率;
Vi—解吸体积;
ci—解吸体积分数;
Q—吸附饱和时SF6的吸附量。
2 结果与分析
2.1 SF6在填料上的动态吸附性能
在表1吸附条件[9]下实测了SF6在粒径为165~198 μm的填料Porapak Q和Porapak T上的动态吸附系数kd,结果见图2。由图2可见,Porapak Q对SF6的吸附性能明显优于Porapak T填料,因此选用Porapak Q作为SF6吸附剂。

表1 动态吸附实验参考条件

图2 不同吸附剂对SF6的动态吸附系数
2.2 温度对SF6动态吸附系数的影响
对于特定的吸附剂,温度是影响其吸附性能的主要因素。SF6在吸附剂上的吸附是物理吸附,吸附时放热,因此降低吸附温度有利于增大SF6的动态吸附系数kd。在流量40 mL/min、温度–70~–100℃的条件下,测定SF6在Porapak Q上的kd,取lnkd作为纵坐标,热力学温度的倒数1/T作为横坐标,绘制lnkd~1/T曲线,如图3。由图3可知,随着温度降低,kd呈指数上升,符合Arrhenius方程lnkd= -a/(RT)+b。考虑实验的易操作性,确定吸附温度为–80~–90℃。

图3 不同温度下SF6在Porapak Q上的动态吸附系数
2.3 流量对SF6动态吸附系数的影响
在温度保持不变的条件下,测定不同样品气流量所对应SF6在Porapak Q上的动态吸附系数kd,结果见表2。由表2可知,在实验流量范围内kd值变化较小。

表2 动态吸附系数与流量的关系
2.4 SF6解吸回收率
实验确定洗提流量为2 mL/min,不同吸附温度下SF6的回收率结果见表3。
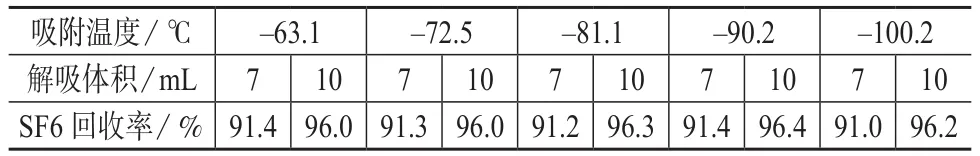
表3 不同吸附温度下SF6的回收率
由表3可知,不同吸附温度下SF6的解吸回收率较稳定,7 mL解吸气的回收率均达到90%以上,适当增加解吸体积可以提高回收率。
2.5 富集系数
通常用富集系数(解吸气体中被富集气体的体积分数与吸附源中被富集气体的体积分数之比)来表征气体的富集效率
根据亨利定律,SF6在水中的体积分数大约比在大气中的体积分数(10–12)低两个数量级,本实验气相色谱仪检测器的检出限是2×10–13,因此富集系数需要达到102以上才可以检测到。在不同吸附温度下,测定解吸体积为7 mL时SF6的富集系数,结果见表4。

表4 不同吸附温度下SF6的富集系数
由表4可知,在实验吸附温度范围内,SF6富集系数均达到102量级,可以满足测量要求,且吸附温度越低,富集效果越好。
3 结语
通过研究单因素条件对SF6吸附性能的影响发现,利用负压热水浴解吸的方式可以加快SF6的解吸速度,提高SF6的回收率。建立了简易的SF6低温富集及高温解吸流程,该方法可用作年轻地下水测年技术(0~30年)及水中SF6的示踪技术。
[1] 李晶晶,周爱国,刘存富,等.年轻地下水测年最新技术[J].水文地质工程地质,2005,1(1): 94–97.
[2] 李惠娣.测年方法在地下水中的应用[J].水资源与水工程学报,2008,19(1): 1–6.
[3] 李小倩,周爱国,张俊刚,等. SF6在地下水应用中的研究现状[J].地球学报,2008,29(5): 665–670.
[4] 杨英桂,保小玲.六氟化硫气体中空气和四氟化碳含量检测方法的改进[J].广东化工,2009,26(9): 1 150–1 155.
[5] Maiss M,Steele L P. Sulfur Hexafluoride-A poweful new atmospheric tracer[J]. Atmos Environ,1996,30(10/11): 1 621–1 629.
[6] 张俊刚.大气中SF6的分析方法及其实际应用研究[D].中国地质大学,2006: 1–51.
[7] Martin K. Simultaneous determination of Sulfur Hexafluoride and three Chlorofluorocarbons in water and air[J]. Marine Chem,2002,78: 137–148.
[8] Wanninkhof R,Ledwell J R. Analysis of Sulfur Hexafluoride in seawater[J]. J Geophys,1991,96(5): 8 733–8 740.
[9] 冯淑娟,周崇阳,周国庆,等.碳分子筛技术在氡、氙分离中的应用初探[J].辐射防护,2010,30(2): 113–116.
Enrichment and Desorption of SF6
Yuan Yuan, Zeng Ke, Zhou Guoqing, Gan Zongyu
(Northwest Institute of Nuclear Technology, Xi’an 710024, China)
The method was developed for SF6being enriched at low temperature from gas sample and desorbed at high temperature. Dynamic adsorption coefficient (kd) of SF6in Porapak Q and Porapak T were determined. The result showed that dynamic adsorption capability of SF6in Porapak Q was apparently better than that in Porapak T. Temperature was a key factor affecting kdin adsorbent. The relationship between temperature and kdaccorded with Arrhenius function,and the effect of sample-gas-flow velocity on kdwas inapparent. Before the desorption of SF6,the adsorption bed need to be vacuumed to 30 kPa and then immerged in hot water (100℃) for 30 min,SF6was purged with 2 mL/min N2from adsorption bed and collected in injector. As the desorption volume was 7 mL,the recovery of SF6was greater than 90% and the enrichment coefficient would be above 102.
SF6; dynamic adsorption; Porapak Q; recovery; enrichment coefficient
O652.6
:A
:1008-6145(2012)05-0089-03
10.3969/j.issn.1008-6145.2012.05.028
联系人:曾可;E-mail: zengke520@163.com
2012–08–03
