EGCG 在SDS胶束体系中的性质
2012-07-06高小刚刘天晴
张 龙,高小刚,刘天晴*
(1.扬州大学 化学化工学院,江苏 扬州225002;2.江苏畜牧兽医职业技术学院,江苏 泰州225300)
茶叶中含有一些应用价值较高的物质,如茶多酚、氨基酸、蛋白质和生物碱等[1-3].表没食子儿茶素没食子酸酯(EGCG)是茶多酚生物活性的主要成分之一,它具有很强的抗氧化性和清除自由基功能[4-7],与金属离子、蛋白质和核酸等有较强的亲和力,故对预防和治疗动脉硬化、恶性肿瘤等均有较好的功效[8-10].文献[11]已通过离子萃取技术从黄山绿茶中提取出高纯度的EGCG,并研究了EGCG在非离子表面活性剂Tween 80胶束体系中的性质.本文拟通过表面张力法和电导率法研究EGCG对十二烷基硫酸钠(SDS)临界胶束浓度的影响,并利用紫外-可见吸收光谱法和荧光光谱法探讨EGCG 在SDS胶束体系中的定位及其光谱性质.
1 实验部分
1.1 试剂
黄山绿茶(安徽石台天然茶叶有限公司);SDS(PT 公司生产,上海试剂厂进口分装,另经无水乙醇重结晶提纯,且纯化物通过铂环法测定其表面张力在cc,m附近无最低点);EGCG 标准样品(>90%,陕西旭煌植物科技发展有限公司);乙酸乙酯、无水乙醇、三氯化铝、氯化锌(AR,国药集团化学试剂有限公司);盐酸(AR,上海振兴化工二厂有限公司);碳酸氢钠(AR,上海虹光化工厂);芘(>99%,Sigma公司);二次蒸馏水.
1.2 EGCG 提取纯化的最佳工艺[11]67
将盛有已粉碎的黄山绿茶的烧瓶置于70 ℃的水浴中,用φ=70%的乙醇分别浸提3 次,每次20min;以NaHCO3溶液调节浸提液pH 值至5.5~6.5后加入AlCl3和ZnCl2的混合沉淀剂,过滤;沉淀经HCl溶液溶解后再用乙酸乙酯萃取6次,萃取液真空干燥后即可制得EGCG.
1.3 红外光谱测定
将EGCG 样品压片,应用Tensor27型傅里叶变换红外光谱仪(Bruker公司,德国)测定其红外光谱.
1.4 电导率测定
配制一系列SDS-EGCG-H2O 溶液,(25.0±0.1)℃下恒温1h后运用DDS-11A 型数字电导率仪(上海伟业仪器厂)测定其电导率.
1.5 表面张力测定
配制一系列SDS-EGCG-H2O 溶液,采用吊环法通过JYW-200A 型自动界面张力仪(承德试验机总厂)测定25 ℃下溶液的表面张力,每一试样重复测定3次,取其平均值作为测量值,测量误差为±0.1mN·m-1.25 ℃时测得纯水的表面张力为72.5mN·m-1.
1.6 微极性测定
以芘为荧光探针,用RF-5301型荧光光度计(Shimadzu公司,日本),于338nm 的激发波长和384nm 的发射波长下测定芘在SDS胶束体系中330~450nm 波长范围的荧光发射光谱,以第1峰(373nm 附近)与第3峰(384nm 附近)的荧光强度之比表示芘探针分子所处微环境的极性,从而确定EGCG 在SDS胶束体系中的定位方式[12].芘的浓度为1.0×10-6mol·L-1.
1.7 紫外-可见吸收光谱测定
配制一系列SDS-EGCG-H2O 溶液,以二次蒸馏水为参比,用UV-2501型紫外-可见分光光度计(Shimadzu公司,日本)在200~500nm 的波长范围测定其吸收光谱.
1.8 荧光光谱测定
配制一系列SDS-EGCG-H2O 溶液,于325nm 的激发波长下测定其在200~700nm 波长范围的荧光发射光谱.
2 结果与讨论
2.1 EGCG 的提取与表征
通过正交试验法(考虑溶剂的选择、乙醇浓度、料液比、浸提时间、浸提温度等因素)获得从黄山绿茶中提取EGCG 产品的最佳浸提工艺,采用离子沉淀法(考虑离子沉淀剂种类、pH 调节剂、沉淀时间、沉淀剂用量等因素[13-14])提取高纯度EGCG 产品.提取所得EGCG 与EGCG 标准样品的红外光谱图基本一致[11]68.
2.2 EGCG 对SDS胶束化性质的影响
图1为EGCG 含量对SDS第1临界胶束浓度(c1c,m)和第2临界胶束浓度(c2c,m)的影响.由图1可知:①当体系中未加入EGCG 时,SDS的c1c,m为8.1mmol·L-1,c2c,m为56.2mmol·L-1,均与文献[15-16]报道基本一致;随着EGCG 浓度的增加,SDS的cc,m均增加,表明EGCG 的存在不利于SDS胶束生成,其原因可能是EGCG 与SDS在水体系中均带负电荷,虽然EGCG 与SDS分子之间的氢键和疏水作用使得其进入胶束的栅栏层,但它们之间的静电排斥作用不利于胶束聚集,同时EGCG 分子特殊的空间结构也降低了胶束的稳定性,不利于胶束的形成.②当体系中c(EGCG)为0.2mmol·L-1时,EGCG 对SDS胶束化性质的影响相对较小,特别是对SDS的c2c,m几乎没有影响,这可能是由于EGCG 分子较大,电性作用和空间位阻两个因素共同作用导致EGCG 不能全部进入SDS胶束的栅栏层;当SDS浓度大于c2c,m时胶束呈棒状,结构较紧密,因此增加了EGCG 的进入难度.
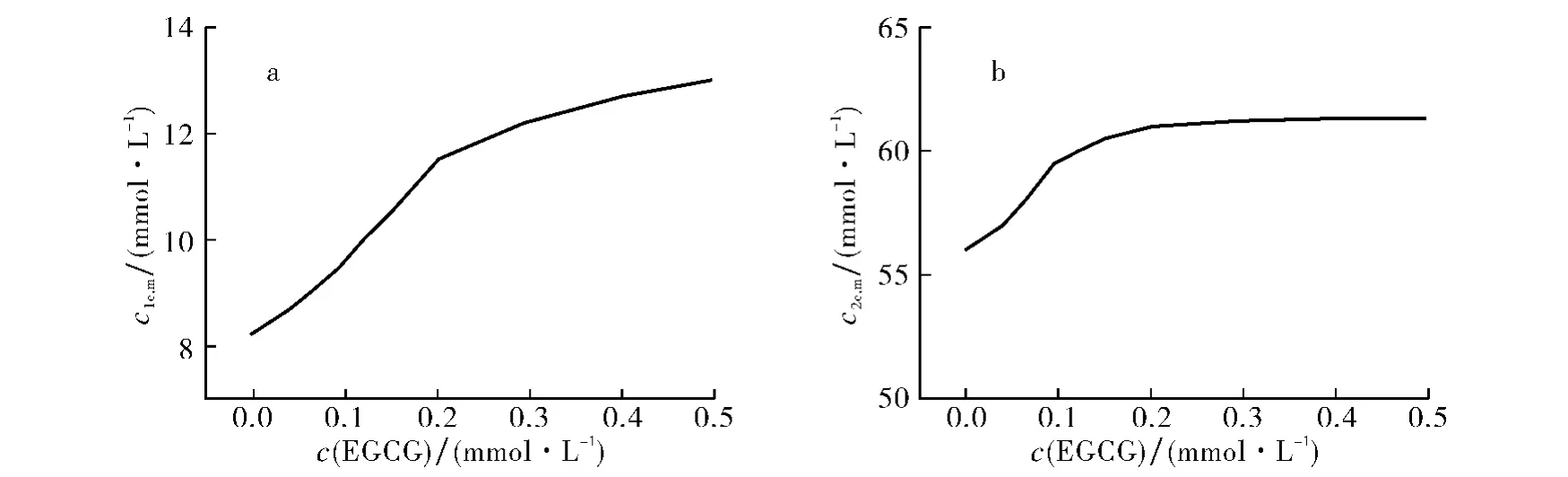
图1 EGCG 含量对SDS的c1c,m(a)和c2c,m(b)的影响Fig.1 Effect of EGCG content on critical micelle concentration of SDS
2.3 EGCG 对SDS胶束体系微极性的影响
EGCG 在SDS胶束中的定位方式可由探针芘在SDS胶束中微环境极性(即I1/I3)的改变确定.当c(SDS)介于c1c,m与c2c,m之间时,胶束呈球状;当c(SDS)>c2c,m时,胶束呈棒状.探针芘中具有大π键,在SDS球状胶束体系中,主要定位于胶束栅栏层中分子极性基团与碳氢链的连接处[17-20].图2给出3种不同SDS浓度下体系微极性的变化关系.由图2可见,SDS胶束体系中加入EGCG 后体系的微环境极性I1/I3值减小,表明探针芘分子向SDS胶束栅栏层内侧移动,EGCG 取代芘而定位于胶束栅栏层外侧,但是由于EGCG 和SDS均为负电性且EGCG 分子结构较大,EGCG 较难进入胶束栅栏层深处.在SDS棒状胶束体系中,EGCG 的加入对I1/I3值的影响相对较小,表明EGCG 较难存在于棒状胶束的栅栏层,且一旦定位后将较难移动.
2.4 EGCG 在SDS胶束体系中的光谱性质
在SDS胶束体系中,随着EGCG 浓度的增加,EGCG 在紫外-可见吸收光谱中的特征吸收峰强度也增加,几乎与其在水溶液中一致(图3).其原因是:①EGCG 定位于胶束栅栏层中,胶束对EGCG起富集作用,使其紫外光谱特征吸收峰增强;②定位于胶束栅栏层中的EGCG 受到胶束膜相的屏蔽作用,导致紫外光谱特征吸收峰减弱;因此,SDS胶束的存在对EGCG 在紫外-可见光谱中的特征吸收峰及其强度几乎没有影响,同时表明EGCG 在SDS胶束的细胞模拟体系中性质比较稳定.
图4显示c(EGCG)为0.05mmol·L-1时SDS浓度变化对EGCG 荧光强度的影响.由图4可见,随着SDS浓度的增加,EGCG 的荧光强度逐渐降低,即SDS对EGCG 的荧光产生猝灭作用,说明SDS和EGCG 分子间存在相互作用,可能产生非辐射能量转移过程.当c(SDS)<c1c,m时,随着SDS浓度的增大,EGCG 荧光强度迅速降低;当c(SDS)>9.0mmol·L-1时(球状胶束),EGCG 荧光强度的下降趋势变缓,原因是SDS胶束对EGCG 的富集效应导致其局部浓度增加,EGCG 所处微环境的刚性增强,一定程度上削弱了SDS对EGCG 的猝灭作用.
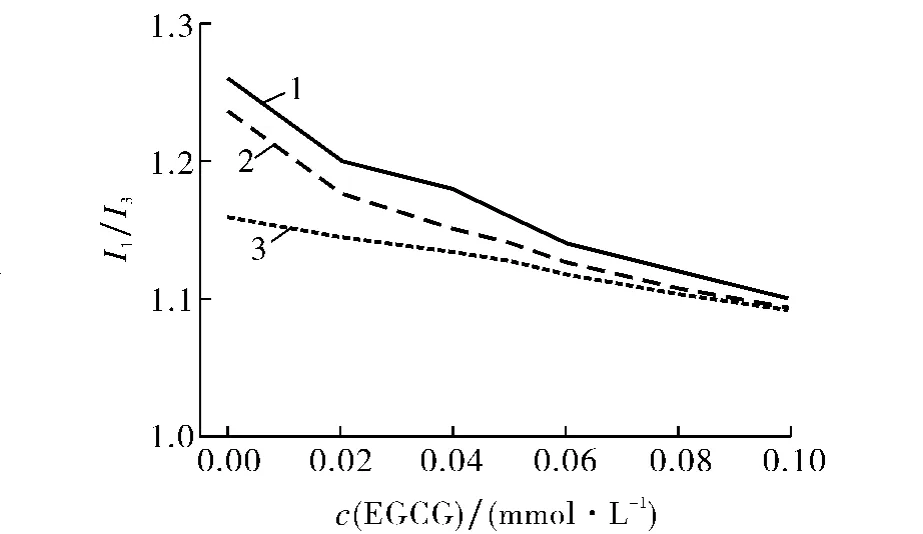
图2 EGCG 对SDS胶束体系微极性(I1/I3)的影响Fig.2 Effect of EGCG content on microenvironmental polarity(I1/I3)of pyrene in SDS micelle system
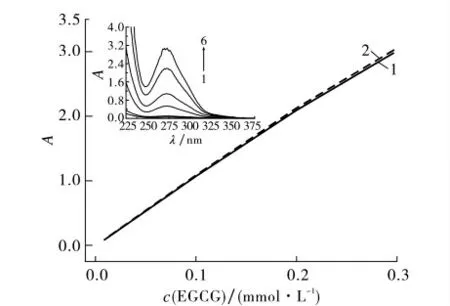
图3 EGCG 对其紫外-可见吸收光谱和吸光度的影响Fig.3 Effect of EGCG content on UV-vis absorption spectrum and intensity of EGCG
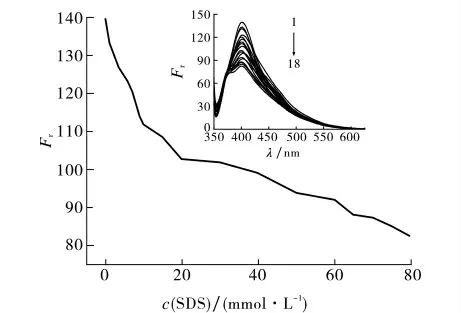
图4 SDS对EGCG 荧光光谱和荧光强度的影响Fig.4 Effect of SDS concentration on the fluorescence spectrum and fluorescence intensity of EGCG
图5 为SDS 胶束体系中EGCG 荧光强度随着EGCG 浓度的变化关系曲线.图5表明:①随着EGCG浓度的增大,其荧光强度先增强后减弱,这是因为SDS胶束对EGCG 的富集作用使得其局部浓度增加,由此引发的分子激发态之间的碰撞而导致自猝灭;同时,当EGCG 浓度较大时,大分子之间的缠绕作用导致能量部分损失,所以荧光强度随着EGCG 浓度的增大而降低.②当c(SDS)>c2c,m,c(EGCG)>0.2 mmol·L-1时,EGCG 的荧光强度几乎没有变化,这可能是由于棒状胶束结构较紧密、EGCG 分子较大,电性作用和空间位阻两个因素的共同作用导致EGCG 不能全部进入SDS胶束的栅栏层,这与EGCG 对非离子表面活性剂胶束行为的影响不同[11]71.
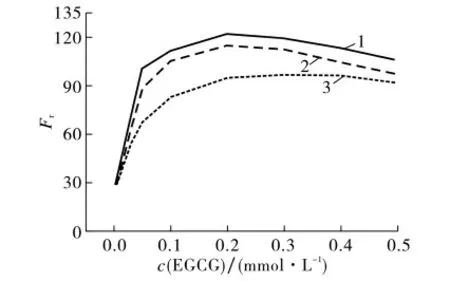
图5 SDS胶束体系中EGCG 荧光强度随EGCG 浓度的变化Fig.5 Variation of fluorescence intensity of EGCG with EGCG concentration in SDS micelle
[1] LIU Xiaoliang,ZHANG D Y,ZHANG W,et al.The effect of green tea extract and EGCG on the signaling network in squamous cell carcinoma[J].Nutr Cancer,2011,63(3):466-475.
[2] BUTT M S,SULTAN M T.Green tea:nature’s defense against malignancies[J].Crit Rev Food Sci Nutr,2009,49(5):463-473.
[3] YANG C S,WANG X.Green tea and cancer prevention[J].Nutr Cancer,2010,62(7):931-937.
[4] NA H K,SURH Y J.Modulation of Nrf2-mediated antioxidant and detoxifying enzyme induction by the green tea polyphenol EGCG[J].Food Chem Toxicol,2008,46(4):1271-1278.
[5] SRIVIDHYA R,JYOTHILAKSHMI V,ARULMATHI K,et al.Attenuation of senescence-induced oxidative exacerbations in aged rat brain by(-)-epigallocatechin-3-gallate[J].Int J Dev Neurosci,2008,26(2):217-223.
[6] DOU Q P.Molecular mechanisms of green tea polyphenols[J].Nutr Cancer,2009,61(6):827-835.
[7] SURESH C,JOHNSON J,MODESTE T M,et al.Protective role of epigallocatechin 3-gallate against lead-induced toxicity in human neuroblastoma cells[J].Toxicol Environ Chem,2011,93(5):1018-1027.
[8] TIPOE G L,LEUNG T M,LIONG E C,et al.Epigallacatechin-3-gallate(EGCG)reduces liver inflammation,oxidative stress and fibrosis in carbon tetrachloride(CCl4)-induced liver injury in mice[J].Toxicology,2010,273(1/3):45-52.
[9] NORWOOD A A,TAN M,MAY M,et al.Comparison of potential chemotherapeutic agents,5-fluoruracil,green tea,and thymoquinone on colon cancer cells[J].Biomed Sci Instrum,2006,42:350-356.
[10] KHAN N,AFAQ F,SALEEM M,et al.Targeting multiple signaling pathways by green tea polyphenol(-)-epigallocatechin-3-gallate[J].Cancer Res,2006,66(5):2500-2505.
[11] 刘天睛,高小刚.EGCG 在Tween80胶束体系中的性质[J].物理化学学报,2010,26(1):66-72.
[12] KALYANASUNDARAM K,THOMAS J K.Environmental effects on vibronic band intensities in pyrene monomer fluorescence and their application in studies of micellar systems[J].J Am Chem Soc,1977,99(7):2039-2044.
[13] 余兆祥,王筱平.复合型沉淀剂提取茶多酚的研究[J].食品工业科技,2001,22(3):32-34.
[14] 蒋建平,陈洪,汪秋安,等.茶多酚的离子沉淀法提取及其成分分析[J].株洲工学院学报,2004,18(5):53-56.
[15] 宋根萍,郭荣.乙醇对SDS胶束的临界胶束浓度和胶束聚集数的影响[J].扬州师院学报:自然科学版,1995,15(4):31-36.
[16] 郭荣,刘薇娅,范国康.孔雀绿与CTAB胶束的相互作用[J].物理化学学报,2001,17(12):1062-1066.
[17] GANESH K N,MITRA P,BALASUBRAMANIAN D.Solubilization sites of aromatic optical probes in micelles[J].J Phys Chem,1982,86(22):4291-4293.
[18] NEUMANN M G,SENA G L.Photophysical characterization of mixed micelles of n-butanol/SDS and n-hexanol/SDS.A study at low alcohol concentrations[J].Colloid Polym Sci,1997,275(7):648-654.
[19] 郭荣,束影,刘天晴.L-天冬氨酸与阴离子表面活性剂SDS的相互作用[J].化学学报,2005,63(6):445-449.
[20] 郭荣,丁元华,刘天晴.Triton X-100/n-C4H9OH/H2O 体系的扩散系数与结构特性[J].化学学报,1999,57(9):943-952.
