Annexin V法检测盐胁迫下烟草原生质体的早期凋亡1)
2012-07-02张衷华祖元刚
张衷华 王 化 刘 英 祖元刚
(森林植物生态学教育部重点实验室(东北林业大学),哈尔滨,150040)
细胞凋亡(apoptosis)又称为程序性细胞死亡(programmed cell death,PCD)是指细胞在一定的生理或病理条件下所发生的主动连续的程序化死亡过程[1]。鉴定植物细胞程序化死亡较可靠的方法为透射电子显微镜技术,但透射电子显微镜制样复杂,尤其在原生质体程序化死亡检测中受到限制,所以一般常用的方法包括DNA梯状条带法、末端脱氧核苷酸转移酶生物素dUTP缺口末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling reaction,TUNNEL)、膜联蛋白 V(Annexin V)法等。并且需要2种以上的方法结合使用。Annexin V由于能够与程序化死亡早期细胞的细胞膜结合,被广泛应用于动物细胞的早期凋亡检测,O’Brien[2-3]较早将其应用于植物细胞的凋亡检测,我国学者徐昌杰[4]也应用此法成功检测了低氧胁迫下悬浮培养的苹果细胞的程序化死亡。但到目前为止,并没有将Annexin V应用于盐胁迫下原生质体早期凋亡检测的报道。本文应用膜联蛋白V-异硫氰酸荧光素(Annexin V-Fluorescein isothiocyanate,Annexin V-FITC)检测在不同盐胁迫下烟草原生质体的PCD,探索Annexin V-FITC检测法在盐胁迫下对原生质体PCD检测的应用。
1 试验材料
烟草(Nicotiana tabacum L.)种子播种于灭菌的培养皿中,并在人工气候箱中培养。气候箱设置为光照4级,相对湿度50% ~80%,温度22℃,每天光照12 h。种子发芽后移入石英砂中,定期浇灌Hoagland 培养液(配方:KH2PO41 mmol·L-1,KNO35 mmol·L-1,Ca(NO3)25 mmol·L-1,MgSO42 mmol·L-1,H3BO32.86 g·L-1,MnCl2·4H2O 1.81 g·L-1,ZnSO4·7H2O 0.22 g·L-1,CuSO4·5H2O 0.08 g·L-1,H2MoO4·H2O 0.02 g·L-1,乙二胺四乙酸铁盐溶液)。烟草幼苗长至4对完整叶片时,取最新发育的完整叶片提取原生质体。原生质体缓冲提取液为CPW盐,甘露醇调节渗透压,每10 mL缓冲液加入纤维素酶(cellulose from truchoderma Virde,Japan)0.08 g,离析酶(Macerozyme R-10,Japan)0.02 g。27℃黑暗酶解4 h,蔗糖梯度离心纯化后,调节原生质体密度为4×105个·mL-1后,保存在含10.8%甘露醇的CPW溶液中。
2 试验方法
配制10.8%甘露醇的CPW溶液作为溶剂,以此溶剂准确配制不同浓度的盐处理液。根据不同浓度 NaCl(50、100、150、200、300、400、500、600 mmol·L-1)处理原生质体所表现出的渗透压稳定性和凋亡特征,确定200 mmol·L-1NaCl浓度最稳定。为了对比同浓度不同种类盐对原生质体作用的差异,将CaCl2、NaHCO3和Na2CO3处理盐浓度也设置为200 mmol·L-1,同时再根据多次盐胁迫的作用效果,将600 mmol·L-1NaCl和 100 mmol·L-1Na2CO3作为试验浓度,使盐作用效果更具有一定的梯度。最终盐浓度设置为:0、200 mmol·L-1CaCl2,200、600 mmol·L-1NaCl,200、100 mmol·L-1NaHCO3,100、200 mmol·L-1Na2CO3。将在保存液中保存的原生质体平均分配到10个离心管中,低速离心去上清,加入不同盐处理液进行处理,根据原生质体的数量调整加入处理液的体积,确保原生质体的浓度为(0.8 ~1.0)×105个·mL-1。
烟草原生质体凋亡采用FITC-Annexin V(碧云天)染色法和PI双重染色法鉴定。吸取100 μL的原生质体盐处理液加入Annexin V-FITC 10 μL染色5 min 后,加入 PI 5 μL,继续染色 5 min。吸取 20 μL染色后的原生质体溶液滴到载玻片上,直接在倒置荧光显微镜(Nikon TE2000)下观察,背景荧光通过调节曝光时间去除。此处不用10.8%甘露醇的CPW溶液清洗是为了避免再次清洗造成凋亡原生质体的破碎。
计算不同胁迫下原生质体密度比(以正常CPW甘露醇溶液原生质体密度为基准),以获得破碎细胞率。
破碎率=(对照溶液完整原生质体数量-处理液完整原生质体数量)/对照溶液完整原生质体数量×100%;
凋亡率=处理液中凋亡原生质体数量/处理液完整原生质体数量;
死亡率=处理液中死亡原生质体数量/处理液完整原生质体数量。
3 结果与分析
3.1 凋亡原生质体的形态
Annexin V是一种磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,它通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的细胞膜结合。在正常细胞中,磷脂酰丝氨酸只分布在细胞膜脂质双层的内侧,Annexin V不能进入正常细胞的细胞膜,所以,正常的细胞不能被着色。细胞发生凋亡早期,膜磷脂酰丝氨酸由脂膜内侧翻向外侧,因此Annexin V是检测细胞早期凋亡的灵敏指标。当Annexin V被荧光FITC标记时,细胞膜外侧的磷脂酰丝氨酸与Annexin V-FITC结合,在蓝色光激发下,可发出绿色的荧光。图1为200 mmol·L-1NaCl胁迫下烟草原生质体的特征。由图1可见,Annexin V着色的细胞(绿色荧光)形态大致分为3个连续的过程:箭头1所示的细胞内叶绿体比较均匀地分布于原生质体内,细胞膜绿色荧光明显,同时细胞核不能被PI着色;箭头2所示的细胞中,叶绿体不是均匀地分布于细胞内,而是聚集到细胞内的一侧,细胞膜绿色荧光明显,此时细胞核没有被PI着色;在箭头3所示的细胞中,细胞圆形形态被破坏,叶绿体部分翻向细胞膜外侧,此时,细胞核被PI轻微着色。在观察中发现,Annexin V染色显示的细胞凋亡过程为连续的过程,尤其是叶绿体向细胞内一侧运动时,也存在一定比例的不能被Annexin V-FITC着色的细胞和着色较浅的细胞。虽然凋亡的原生质体与正常活力的原生质体存在一定的形态学上的差异,但仅从形态学上很难将其准确区分。
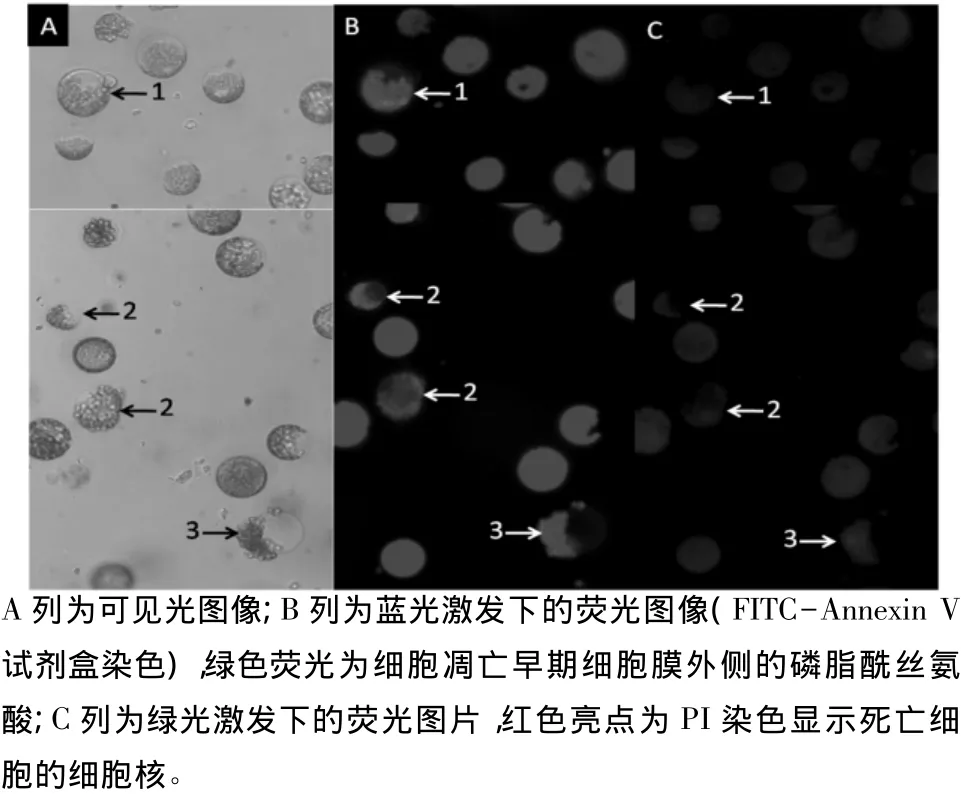
图1 200 mmol·L-1NaCl胁迫下烟草原生质体 FITC-Annexin V染色结果
3.2 不同盐处理下原生质体的凋亡、死亡与破碎
不同盐处理的原生质体在5 h时表现出最大的FITC-Annexin V着色,结果如图2和表1。用10.8%甘露醇溶液作为对照,烟草原生质体存在一定的膨胀,以及4.54%的凋亡率和16.67%的死亡率。当保存液中加入200 mmol·L-1的 CaCl2、NaCl或NaHCO3时,细胞保持正常的膨压,这样有利于降低膨压对原生质体的影响。当原生质体用200 mmol·L-1的CaCl2溶液处理时,凋亡率为3.03%、死亡率为1.51%,两者都较对照有明显的下降,细胞破碎率低于0.01%。当用200 mmol·L-1的 NaCl处理时,凋亡率为7.57%、死亡率为16.67%,较对照和CaCl2溶液中原生质体的凋亡率和死亡率存在显著的上升,但细胞破碎率没有明显的增加。
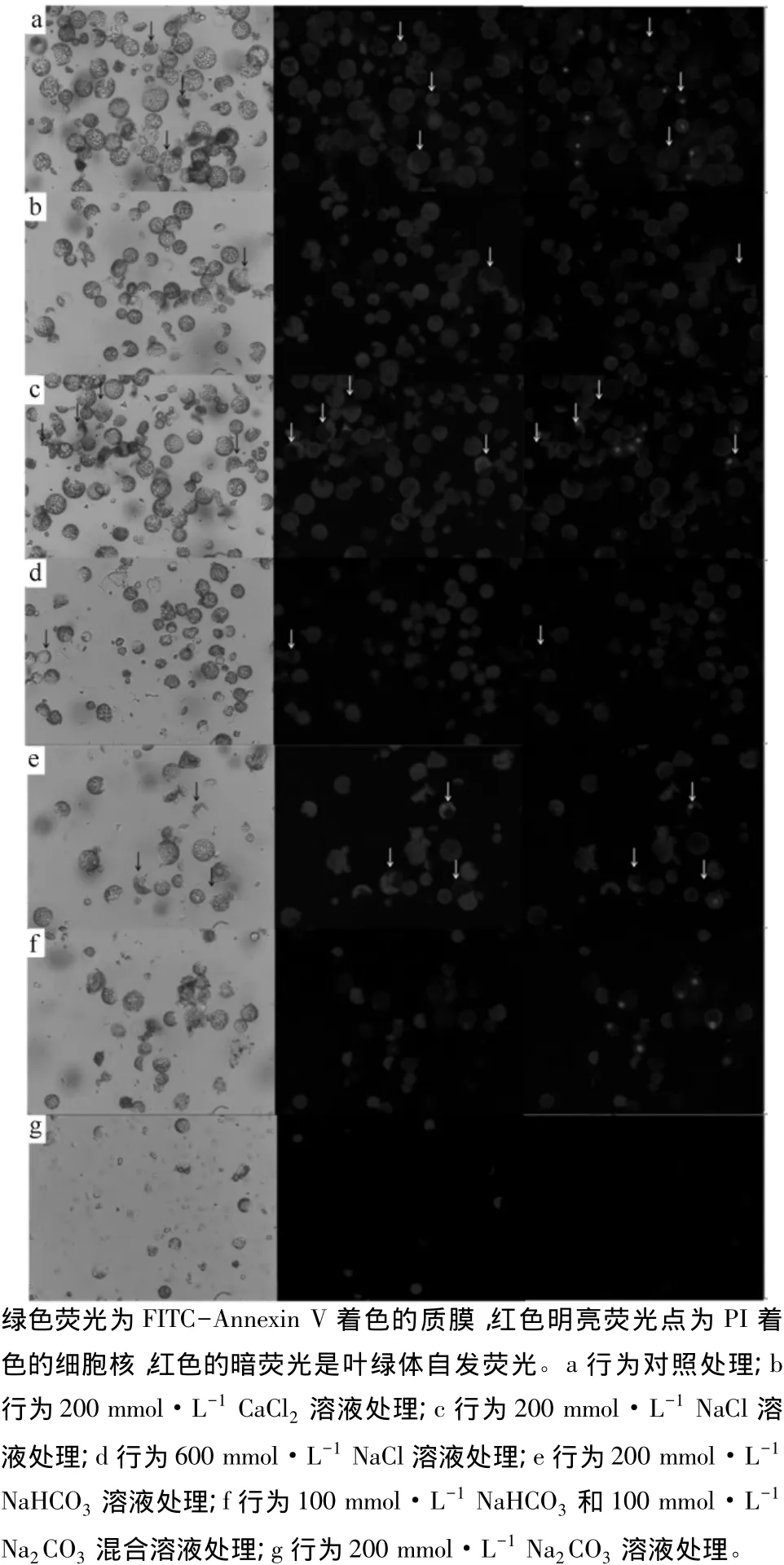
图2 不同盐溶液处理烟草原生质体的凋亡、死亡与破碎状况
在600 mmol·L-1NaCl溶液中,原生质体显著收缩,细胞破碎率显著上升,达到18.18%;凋亡率和死亡率分别为1.85%和7.41%,较200 mmol·L-1NaCl处理下凋亡率和死亡率显著下降,这主要是由于原生质体失水收缩、活力下降和破碎导致凋亡率和死亡率相对减少。当原生质体处于碱性盐(200、100 mmol·L-1NaHCO3和 100、200 mmol·L-1Na2CO3)胁迫时,细胞的破碎率显著上升,表明碱性盐对细胞膜的稳定性存在较大的伤害。200 mmol·L-1NaHCO3溶液中,烟草的原生质体存在较多FITCAnnexin V着色的细胞,大约为10.34%,但同时PI也有不同程度的着色。200 mmol·L-1NaHCO3溶液中,凋亡原生质体以能激发出绿色荧光的原生质体数量计算。分析两种盐胁作用可知,NaHCO3(200 mmol·L-1)和中性盐(200 mmol·L-1NaCl)胁迫对原生质体形态特征的影响存在明显的差异,原生质体内叶绿体并没有运动出完整的细胞膜,但细胞核PI着色却很明显(图2,e),表明NaHCO3使细胞膜的透性发生了改变。叶电解质渗漏率研究也表明,碱性盐较大程度地改变了细胞膜的渗透性[5-8]。

表1 不同盐溶液处理烟草原生质体的凋亡、死亡和破碎结果
4 结论与讨论
细胞凋亡是一种主动的程序化死亡过程,正常生长或正常培养的细胞也存在一定比例的细胞凋亡,所以外来胁迫是否会诱导细胞凋亡需要进行统计分析。在200 mmol·L-1NaCl胁迫下,Lin 等[9]通过检测亚二倍体细胞(Sub-G1 cells)测得烟草原生质体的程序化死亡率约为14%。本试验采用Annexin V和PI染色结合的方法测得200 mmol·L-1NaCl胁迫下烟草原生质体的凋亡率为7.57%,明显低于Lin等[9]的检测结果,一方面是由于处理时间差异,另一方面也表明Annexin V方法在原生质体早期检测中比较灵敏。由于植物细胞膜的稳定性不如细胞核,所以随着处理时间的延长,细胞核凋亡检测方法更适合发生凋亡细胞量的统计。细胞膜的完整性决定着外来胁迫作用的部位,决定着细胞作为植物基本的生命单位所发生的生命活动过程,在凋亡检测中,细胞膜的功能性和完整性必须检测,所以结合细胞膜和细胞核凋亡的检测更能得出客观的结论。本研究发现,碱性盐(NaHCO3和Na2CO3)能够导致细胞膜渗透率的增加,使部分PI染料进入细胞内使细胞核着色,所以,Annexin V和PI染色结合的方法会明显低估原生质体的凋亡率,甚至检测不到原生质体凋亡,在应用此法检测细胞膜透性增大的原生质体凋亡时,一定要结合Annexin V着色原生质体的形态进行区别。
盐胁迫除了能诱导原生质体凋亡外,也能导致原生质体的死亡和破碎。Horváth[10]应用 100 mmol·L-1NaCl处理马铃薯叶片原生质体5 h的结果表明,55% ~60%的原生质体存在活力。Rizkalla[11]应用不同浓度的NaCl胁迫棕榈原生质体的试验表明,随着NaCl浓度的增加,原生质体数量减少,在200 mmol·L-1NaCl胁迫下,原生质体数量为对照的一半。本试验结果发现,在200 mmol·L-1NaCl胁迫5 h下,原生质体的破碎率只有0.14%,这是因为原生质体的渗透压稳定性是在200 mmol·L-1NaCl溶液中确定的,所以处理过程中,降低了由于渗透压变化造成的原生质体破碎。此外,原生质体的凋亡和破碎还与原生质体的浓度和纯度密切相关。
本研究的结果表明:Annexin V与PI染色结合的方法在定量化原生质体凋亡率时,应该与核凋亡的检测方法结合使用,但在检测膜渗透性改变的原生质体凋亡时应该慎重,避免凋亡结果出现低估。
[1]Kerr J F,Wyllie A H,Currie A R.Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].British Journal Cancer,1972,26(4):239-257.
[2]O’Brien I E W,Reutelingsperger C P M,Holdaway K M.Annexin-V and TUNEL use in monitoring the progression of apoptosis in plants[J].Cytometry,1997,29(1):28-33.
[3]O’Brien I E W,Baguley B C,Murray B G,et al.Early stages of the apoptotic pathway in plant cells are reversible[J].The Plant Journal,1998,13(6):803-814.
[4]Xu Changjie,Chen Kunsong,Ferguson I B.Programmed cell death features in apple suspension cells under low oxygen culture[J].Journal of Zhejiang University:Science A,2004,5(2):137-143.
[5]Shi Decheng,Yin Lijuan.Difference between salt(NaCl)and alkaline(Na2CO3)stresses on Puccinellia tenuiflora(Griseb.)Scribn.et Merr.plants[J].Acta Botanica Sinica,1993,35(2):144-149.
[6]Shi Decheng,Wang Deli.Effects of various salt-alkaline mixed stresses on Aneurolepidium chinense(Trin.)Kitag.[J].Plant and Soil,2005,271(1/2):15-26.
[7]Shi Decheng,Sheng Yanmin.Effect of various salt-alkaline mixed stress conditions on sunflower seedlings and analysis of their stress factors[J].Environmental and Experimental Botany,2005,54(1):8-21.
[8]Li R,Shi F,Fukuda K.Interactive effects of various salt and alkali stresses on growth,organic solutes,and cation accumulation in a halophyte Spartina alterniflora(Poaceae)[J].Environmental and Experimental Botany,2010,68(1):66-74.
[9]Lin Jiusheng,Wang Yuan,Wang Genxuan.Salt stress-induced programmed cell death in tobacco protoplasts is mediated by reactive oxygen species and mitochondrial permeability transition pore status[J].Journal of Plant Physiology,2006,163(7):731-739.
[10]Horváth E.Protoplast isolation from Solanum lycopersicum L.leaf tissues and their response to short-term NaCl treatment[J].Act Biologica Szegediensis,2009,53(2):83-86.
[11]Rizkalla A A,Badr-Elden A M,Nower A A.Protoplast isolation,salt stress and callus formation of two date palm genotypes[J].Journal of Applied Sciences Research,2007,3(10):1186-1194.
