复合氧化法降解染料活性艳蓝P-3R的研究
2012-06-21施银桃夏东升曾庆福
周 盼,施银桃,夏东升,曾庆福
(武汉纺织大学 纺织印染清洁生产教育部工程研究中心,湖北 武汉 430073)
1 引言
印染废水具有水量大、有机污染物含量高、色度深、碱性大、水质变化大等特点,属难处理的工业废水。废水中含浆料、染料、助剂、表面活性剂等,可生化性较差。蒽醌染料仅次于偶氮染料,是纺织印染工业中使用量最大的一类活性染料[1]。它由于水溶性较高,不易吸附于活性污泥,并且具有极其稳定的化学结构,因此传统的废水处理工艺很难将其快速有效地分解。活性艳蓝P-3R是一种典型的蒽醌染料,可生化性较差,因此研究此类染料废水的处理方法具有重要的意义。
O3具有很强的氧化性,在水中可产生的活泼的·OH,与废水中有机物反应,使难降解的有机物被氧化成易降解的小分子的酸、醛等,最终氧化成CO2和H2O[2],但单独使用 O3存在利用 率低的 问题。O3/H2O2复合氧化法具有氧化能力强和无选择性等优点,提高了O3的利用率,产生的·OH的氧化还原电位为2.80V,与大多数有机化合物反应时速率常数通常为106~109L/(mol·s),能有效地氧化降解水中的有机污染物[3,4]。
本文将采用复合氧化法O3/H2O2降解活性艳蓝P-3R,并分析反应时间、H2O2投加量、H2O2投加方式、pH值等各种因素对处理效果的影响,为O3/H2O2复合氧化法在实际应用中提供研究基础。
2 试验部分
2.1 试剂与仪器
活性艳蓝P-3R为深蓝色粉末,易溶于水,最大吸收峰为590nm,其结构如图1所示。
试验采用市售活性艳蓝P-3R,配制成质量浓度为200mg/L的活性艳蓝P-3R溶液。质量分数30%的H2O2。
CFY-24臭氧发生器,杭州荣欣电子设备有限公司;UV-1201紫外可见分光光度计,北京瑞利分析仪器公司;Multi N/C 2100总有机碳(TOC)分析仪,德国耶拿分析仪器股份公司;实验室pH计Starter3C,奥豪斯仪器(上海)有限公司;BT323S分析天平,北京赛多利斯仪器系统有限公司。

图1 活性艳蓝P-3R的分子结构式
2.2 装置与方法
试验装置为直径8cm,高40cm的玻璃反应柱,装置如图2。

图2 废水处理的实验装置
试验以纯氧作为臭氧发生器的气源。每次试验开始前,都要让臭氧发生器运行2min,使臭氧浓度稳定。产生的臭氧气体通过反应器底部的盘旋曝气头进行曝气,再将2L染料废水和H2O2加入反应器内,并开始计时。反应中按规定时间取样,取样口在反应器中下部,测定吸光度和TOC的变化。
3 结果与讨论
3.1 O3/H2O2体系的建立及不同方法的对比
试验在初始质量浓度为200mg/L的活性艳蓝P-3R溶液2L,原始pH 值为6.75,O3流量为400mL/min,质量分数30%的H2O2投加量为2mL的条件下进行,反应20min取样,测定活性艳蓝P-3R的吸光度,计算其去除率。同时,考察 H2O2、O3、O3/H2O2体系对活性艳蓝P-3R的降解效果结果,见图3。
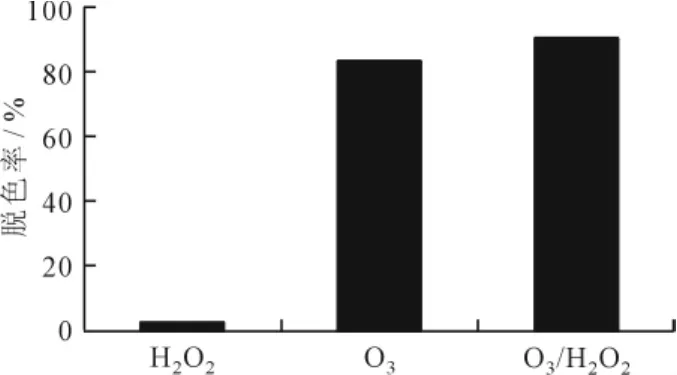
图3 P-3R在不同体系下的降解效果
由图3可知,单独使用H2O2降解活性艳蓝P-3R的效率很低,只有2.12%;而单独使用O3降解活性艳蓝P-3R的效果相对比较明显,有83.16%。但是,O3/H2O2体系对活性艳蓝P-3R的降解效果最好,脱色率达到90.33%,且O3/H2O2体系的降解效果大于单独使用H2O2和O3之和,说明在反应过程中O3与H2O2相互促进催化分解。
·OH是一种极强的化学氧化剂,它的氧化电位比普通氧化剂(如臭氧、氯气、过氧化氢)高,这意味着羟基自由基的氧化能力要大大高于普通化学氧化剂[5]。根据自由基氧化理论,H2O2可提供氧化性极强的羟基自由基·OH,对染料分子进行化学氧化,但是本实验中H2O2处理活性艳蓝P-3R的效率很低,这可能是因为:①H2O2的氧化还原电位与pH值有关,而本实验中活性艳蓝P-3R溶液pH值为6.75,受其酸性的影响,分解速率较低,因此单独使用H2O2时氧化作用不明显,此结果与刘中兴等人的研究结果一致[6]。②活性艳蓝P-3R的蒽醌结构与H2O2之间的相互作用较弱,因此H2O2对它的直接氧化效果较差。基于上述原因,H2O2处理活性艳蓝P-3R的效率低下。比较而言,O3也具有强氧化性,与本有机物的反应速率较快,但臭氧与有机物的反应选择性较强,在低剂量和短时间内臭氧不可能使污染物完全矿化,且分解生成的中间产物会阻止臭氧的进一步氧化[7]。在 O3/H2O2体系中,O3与H2O2协同作用产生更多具有极强氧化作用的·OH来去除水中的有机污染物。其氧化机理如下[8~11]:
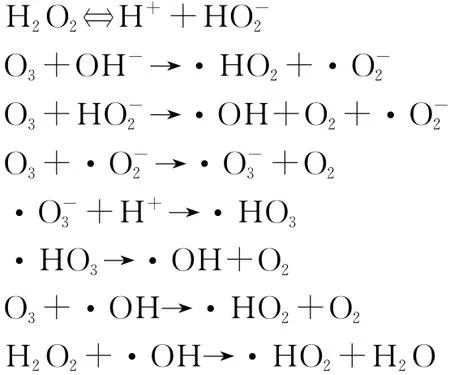
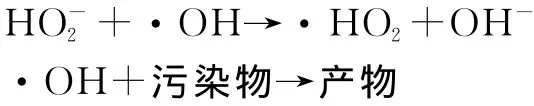
在此过程中,O3直接与有机物反应不是主导作用,而是利用O3分解产生的·OH来氧化有机物。H2O2会部分解离产生的可引发链反应生成更多的·OH自由基,能显著加快O3的自分解生成·OH。
3.2 反应时间的影响
调节O3流量为400mL/min,投加2mL H2O2,在反应时间为0、5、10、15、20、30、40、50、60、90、120min,测定活性艳蓝P-3R的吸光度和TOC值,其去除率如图4、5所示。
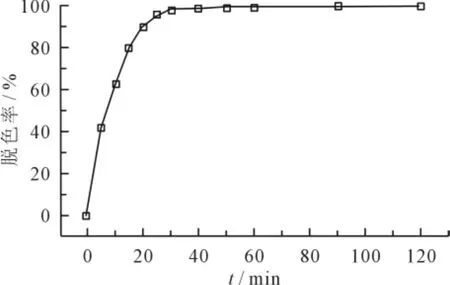
图4 反应时间对脱色率的影响

图5 反应时间对TOC去除率的影响
由图4看出,O3/H2O2对活性艳蓝P-3R染料废水的脱色速度非常快。反应时间至30min时,染料脱色率可达到98%左右,随着反应时间的延长,脱色率的增加并不是很明显,可接近99.9%。这是因为刚开始水中产生大量的·OH,与染料废水接触后就迅速发生反应,氧化生成小分子有机物,随着反应的进行,水中容易氧化的有机物逐渐减少,而随着中间产物的增多,水中的·OH因氧化反应的消耗而减少,反应速度减慢[12]。由图5看出,TOC去除率随着反应时间的延长一直增大。这是因为O3和H2O2反应产生大量低选择性、强氧化性的·OH,迅速氧化降解活性艳蓝P-3R分子,使废水迅速脱色,并在氧化过程中生成降解中间产物,因此TOC去除率也在不断增大。
3.3 H2O2投加量的影响
调节 O3流量为400mL/min,分别投加0、0.5、1、1.5、2mL H2O2,反应时间为60min,测定活性艳蓝P-3R的吸光度和TOC值,其去除率如图6、7所示。
由图6看出,投加一定量H2O2后,活性艳蓝P-3R的脱色率在一定程度上都有提高,且比O3单独处理效果要好。H2O2投加量由0增加到1mL时,脱色率随H2O2投加量的增加而增加,但投加量大于1mL时,脱色率反而逐渐减少,这可能是因为H2O2浓度较低时促进O3分解产生·OH,使活性艳蓝P-3R脱色率迅速提高,而 H2O2过量时,它会部分离解生成共轭碱,H2O2和都能和·OH 结合[13,14],抑制了反应的进行。由图7看出,除了1mL投加量,投加H2O2后的TOC去除率比未投加H2O2的TOC去除率还低,这可能是因为H2O2投加过量,使H2O2转化为氧化还原电位较低的·。因此,在 O3/H2O2氧化反应中,存在最佳H2O2投加量。

图6 H2O2投加量对脱色率的影响

图7 H2O2投加量对TOC去除率的影响
3.4 H2O2投加方式的影响
采用不同方式投加总量相同的H2O2,H2O2投加方式有两种,一是一次投加,即1mL H2O2在反应前全部加入反应前中;二是多次投加,即在反应0、20、40min时分别投加0.5、0.3、0.2和0.4、0.4、0.2mL H2O2。调节O3流量为400mL/min,反应时间为60min,测定活性艳蓝P-3R的吸光度和TOC值,其去除率如图8、9所示。

图8 H2O2投加方式对脱色率的影响
由图8看出,不同方式投加总量相同的H2O2,对活性艳蓝P-3R的脱色率均在99%以上。由图9看出,总量相同的H2O2一次投加可以获得优于多次投加的去除效果,这可能是因为H2O2投加过量抑制了反应的进行,在多次投加的方式中,初始阶段加入一定量的H2O2,生成的·OH一部分与水中的有机物反应,一部分与后续添加的H2O2反应,降低了氧化效能[16]。
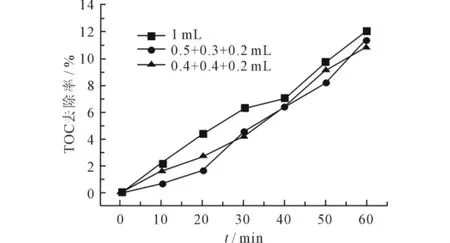
图9 H2O2投加方式对TOC去除率的影响
3.5 初始pH值的影响
分别用H2SO4和NaOH来调节废水的pH值为3、5、9、11,废水原始pH 值为6.75。调节 O3流量为400 mL/min,反应时间为60min,一次投加1mL H2O2,测定活性艳蓝P-3R的吸光度和TOC值,其去除率如图10、11所示。

图10 初始pH值对脱色率的影响

图11 初始pH值对TOC去除率的影响
由图10看出,不同pH值条件下,活性艳蓝P-3R的脱色率均在98%以上。由图11可以看出,pH值越大TOC的去除率越大,说明废水pH值的升高有利于O3/H2O2氧化去除有机物,这可能是因为在O3/H2O2氧化反应中,pH值在很大程度上影响着·OH的生成,增加溶液的pH值能极大的提高·OH的产生量和速率,并能将水溶液中的·OH浓度稳定的维持在较高的水平[17]。
3.6 自由基清除剂的影响
O3/H2O2氧化过程中,·OH的氧化作用十分重要,而自由基清除剂会与·OH发生反应来中断整个自由基链反应,抑制对有机物的降解,因此考察了Na2CO3对活性艳蓝P-3R去除效果的影响,以确定·OH是否在氧化反应中起主要作用。图12为Na2CO3对O3/H2O2氧化的影响,H2O2投加量为1mL,Na2CO3投加量为500mg/L。
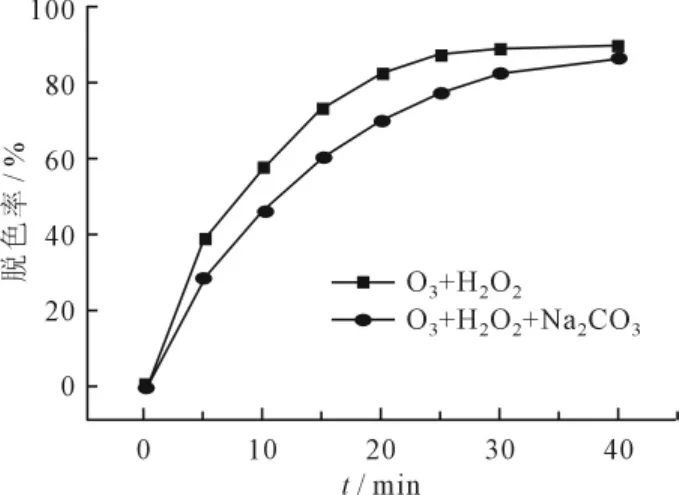
图12 自由基清除剂对脱色率的影响
由图12所示,由不加Na2CO3到投加500mg/L Na2CO3,活性艳蓝P-3R的脱色率大大降低了,且在反应5min后,Na2CO3的抑制作用越来越明显。这说明,Na2CO3对O3/H2O2氧化活性艳蓝P-3R有明显的抑制作用,同时也说明·OH在氧化反应中起主要作用。
4 结语
通过研究复合氧化法O3/H2O2降解活性艳蓝P-3R,探讨了其影响因素。得到如下结论:O3/H2O2比单独O3反应的效果要好;反应时间越长,脱色率和TOC去除率也越大;H2O2投加量对氧化反应的影响很大,存在一个最佳投加量;总量相同的H2O2一次投加优于多次投加;pH值越大,去除率也越大;Na2CO3作为自由基清除剂在一定程度上抑制了O3/H2O2的氧化作用。
[1]张舜梅.城市生活垃圾收费制度设计研究[D].上海:华东师范大学,2006.
[2]储金宇,吴春笃,陈万金.臭氧技术及应用[M].北京:化学工业出版社,2002.
[3]Masten S J,Davies S H R.The use of ozonation to degrade organic contaminants in wastewater [J].Environmental Science and Technology,1994,28(4):181~185.
[4]Erik J R,Karl G L,Silvio C,et al.Comparison of the efficiency of·OH radical formation during ozonation and the advanced oxidation processes O3/H2O2and UV/H2O2[J]. Water Research,2006,40(20):3695~3704.
[5]Mihaela I Stefan,James Bolton.Kinetics and mechanism of the degradation and mineralization of acetone in dilute aqueous solution sensitize by the UV photolysis of hydrogen peroxide[J].Environment Science Technology,1996,30(7):2382~2390.
[6]刘中兴,谢传欣,石 宁,等.过氧化氢溶液分解特性研究[J].齐鲁石油化工,2009,37(2):99~102.
[7]王凯雄.水化学[M].北京:化学工业出版社,2001.
[8]Ali Saaf,Zrdaeh-Amiri.O3/H2O2treatment of methyl-tertbuytl ehetr(MTBE)in conimainated waters[J].Wat Res,2001,35(15):3706~3714.
[9]Hoinge J,Bdaer H.Rate constants of reactions of ozone with organic and inorganic Compounds in water.I.Nondissociatingorg organic compounds[J].Water Res,1983,17(2):173~183.
[10]Glaze W H,Knag J W.Advnaced oxidation proeesses.Description of a kinetic model for the oxidation of hazardous materials in aqueous media with ozone and hydrogen peroxide in a semibatch reactor[J].Ind Eng Chem Res,1989(28):1573~1580.
[11]Stefan M I,Mack J,Bolton J R.Degradation pathways during the treatment of Mehytl-tert-buytlether by the UV/H2O2proeess[J].Environ Sci Technol,2000(34):650~658.
[12]储金宇,蔡笑笑.O3/H2O2处理含油废水的研究[J].工业安全与环保,2009,35(11):8~10.
[13]王代平,胡海修,胡 立.高级氧化技术处理有机废水探讨[J].云南环境科学,2006,25(增刊):151~155.
[14]魏东洋,贾晓珊,陆桂英,等.水中六氯苯的高级氧降解机理及其动力学探讨[J].环境科学,2008,29(5):1277~1283.
[15]王俊芳,师 彬,陈建峰,等.O3/H2O2高级氧化技术在处理难降解有机废水中的应用进展[J].化工进展,2010,29(6):1138~1142.
[16]王 炜.O3/H2O2法处理印染废水二级出水的试验研究[J].应用化工,2010,39(8):1194~1197.
[17]Glaze W H,Kang J W.Advanced oxidation processes test of a kinetic model for the oxidation of organic compoundswith ozone and hydrogen peroxide in a semibatch reactor[J].Industrial Engineering Chemistry Research,1989,28(11):1580~1587.
