山羊痘重组沙门菌S7207/pVAX1-P32疫苗株的安全性及稳定性研究
2012-06-17朱时杰周碧君王开功程振涛殷俊磊
朱时杰,周碧君,2*,文 明,2,王开功,2,程振涛,2,殷俊磊
(1.贵州大学动物科学学院,贵州贵阳550025;2.贵州省动物疫病研究室,贵州贵阳550025)
山羊痘(Goat pox)是由山羊痘病毒(Goat poxvirus,GPV)引起的一种严重危害山羊的高度接触性传染病,该病以发热、呼吸困难、黏液性或脓性鼻液及在皮肤黏膜出现痘疹为特征。该病高病死率给养羊业造成了巨大的经济损失[1-2],我国将其列为一类动物疫病。目前对于山羊痘的预防主要是采用山羊痘弱毒疫苗进行肌肉注射免疫。由于山羊一般进行放养,在进行免疫时比较费时费力,随着基因工程疫苗研究进展,基因工程疫苗已开始逐渐应用到生产中。DNA 疫苗可诱导特异性的体液免疫和细胞免疫反应,因而是近年来发展起来的一个研究热点。但是由于传统DNA 疫苗的免疫方法(主要有肌肉注射、皮下注射、基因枪免疫等)存在DNA 摄取效率低或需要特殊设备等缺点,制约了DNA 疫苗的实际应用[3-5]。减毒沙门菌作为疫苗载体已广泛用于病毒、细菌和寄生虫等口服疫苗的研究,多数重组疫苗株能获得针对相应病原体的免疫应答[6-8]。本研究对所构建的山羊痘重组沙门菌S7207/pVAX1-P32疫苗株的安全性、稳定性及在体内的散布规律进行了研究。
1 材料与方法
1.1 材料
1.1.1 菌株 山羊痘重组沙门菌S7207/pVAX1-P32口服活苗和S7207(不含质粒)减毒沙门菌,均由贵州省动物疫病研究室提供。
1.1.2 实验动物 30日龄Balb/c雌性小鼠60只,购于贵阳医学院。
1.2 方法
1.2.1 试验分组及免疫接种 60只30日龄小鼠随机分为4组,1组为空白对照组,口服生理盐水;2组~4 组为试验组,将重组鼠伤寒减毒沙门菌S7207/p VAX1-P32接种于LB液体培养基,37 ℃、150r/min振荡培养至OD 600nm≈0.3~0.4,分别以108、109、1010cfu/只口服,2周后以相同剂量加强免疫。
1.2.2 称重及样品采集处理 每天观察小鼠有无异常反应及健康状况,分别于免疫接种后第1天、14天、28 天及45 天称量每组每只小鼠的体重,观察其增重情况。在免疫接种后第1天、7天、14天、28天及45天采集粪便,每次每组采集3 只小鼠心、肝、脾、肺、肾、十二指肠、胃及脑组织样本进行组织观察并保存。
1.2.3 重组沙门菌中质粒稳定性 将重组沙门菌(含质粒菌株)及减毒沙门菌(不含质粒菌株)分别接种于LB、LB-Kana培养液进行连续培养。具体操作:将冷冻保存的重组沙门菌以1∶1 000的比例分别接种于LB、LB-Kana连续传代120代(37 ℃振荡培养12h为10代),每隔20代分别在含和不含Kana的胆硫乳(DHL)琼脂平板上进行细菌记数,用公式s=(在含Kana的平板上生长的细菌数/在不含Kana的平板上生长的细菌数)×100%分析其在运载菌中存留的稳定性。
1.2.4 重组沙门菌在小鼠体内的散布规律 在每次对小鼠进行取样时提取小鼠心、肝、脾、肺、肾、十二指肠、胃及脑的DNA,用PCR 方法检测P32基因在小鼠体内分布情况。
2 结果
2.1 重组沙门菌安全性试验
在观察期内,所有接种小鼠均无任何不良反应。每次取样后,剖检在肝脏、脾脏等实质器官未见眼观病变。在14d,109cfu/只剂量组与空白组比较差异显著(P<0.05),其余天数空白组与各试验组比较,小鼠体重均无差异显著(P>0.05)。初步表明DNA 疫苗P vax1-P32具有一定的安全性(表1)。
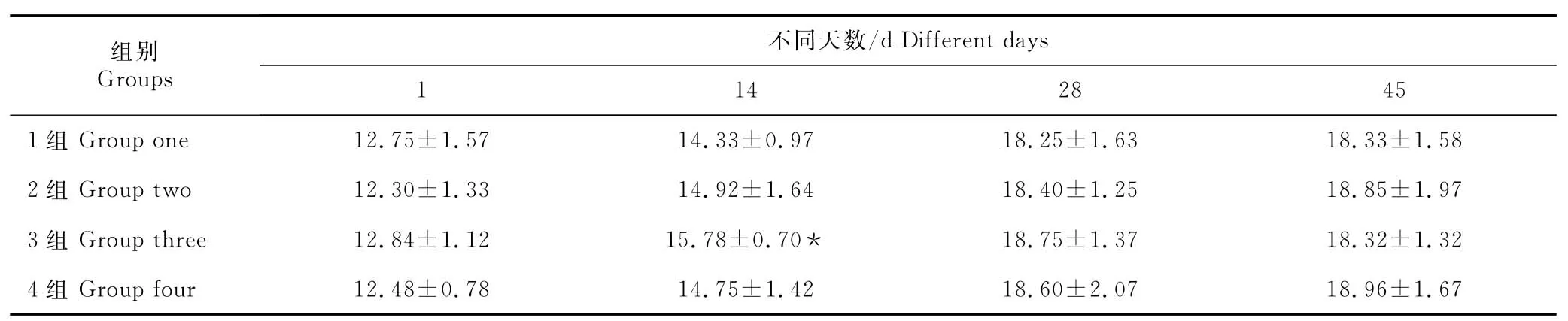
表1 小鼠接种免疫后不同天数体重Table 1 Weights of immune mice in different days g
2.2 重组沙门菌稳定性试验
经过120代传代培养,菌落形态无裸眼可见变化。在不含Amp的培养基中,“含质粒菌株”经60代后含重组质粒菌的比例在50%以上,传代至120代时仍在10%以上,而“不含质粒菌株”明显低于“含质粒菌株”,结果可见“含质粒菌株”稳定性较好,结果见图1。
2.3 重组沙门菌在小鼠体内的散布规律
对各试验组小鼠的心、肝、脾、肺、肾、十二指肠、胃及脑进行PCR 扩增,结果均能扩增出目的片段条带(969bp),结果见图2和表2。
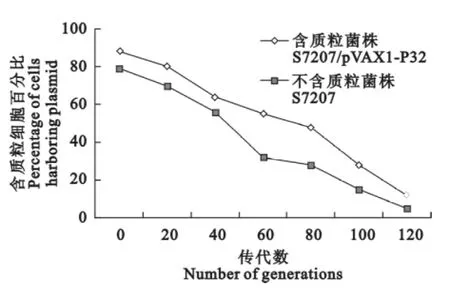
图1 质粒在重组沙门菌中的稳定性Fig.1 Plasmid stability in recombinant Salmonella
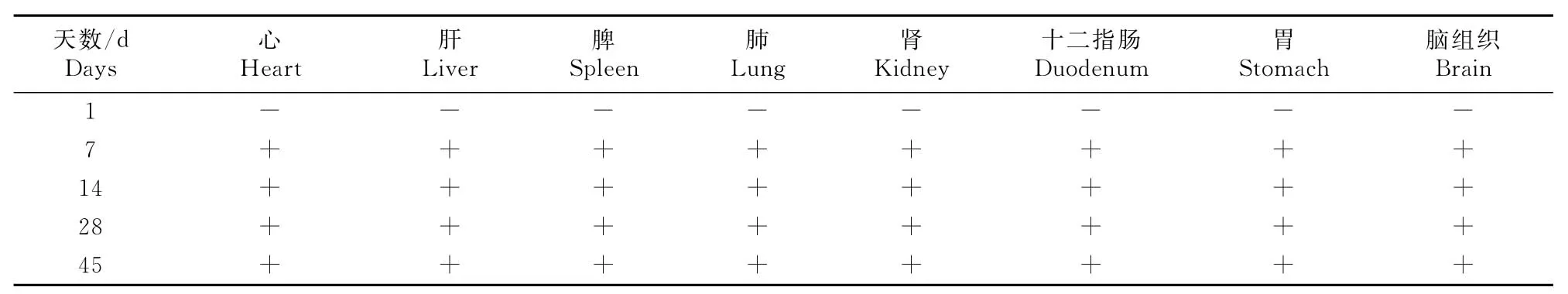
表2 小鼠免疫接种后不同天数目的DNA 片段检出结果Table 2 DNA detection of immune mice in different days
由表2 可知,各试验组小鼠被检组织中7d~45d都能检测到与预期片段大小一致的目的片段,说明质粒DNA 在机体分布具有广泛性。
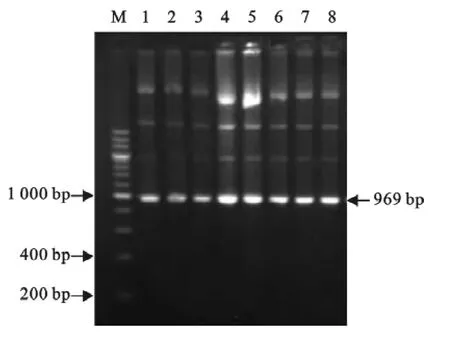
图2 小鼠接种后45d的PCR 结果Fig.2 The PCR results of tissues 45days post inoculation
3 讨论
以减毒病原微生物或益生菌作为活疫苗的载体,对各种疾病进行防控的研究方面,在医学和兽医学都取得了较大的成果[9]。质粒在动物体内的分布和存留时间是评价DNA 疫苗的重要指标。一个理想的核酸疫苗应较长时间存在细胞内,能持续产生适量的蛋白抗原刺激免疫系统。口服活苗的安全性是一个值得注意的问题[10]。本试验探讨了pVAX1-P32在小鼠体内的安全性及其S7207分布情况,同时也分析了重组质粒在减毒沙门菌中的稳定性,最后在免疫接种后对重组细菌在小鼠体内的分布进行了研究。通过重组细菌口服接种小鼠,没有引起任何不良反应,各组小鼠体重增长情况无差异显著(P>0.05),在14d,109cfu/只剂量组与空白组比较差异显著(P<0.05),是由于小鼠个体生长差异造成。通过剖检观察小鼠内脏器官,也未发现病变,说明了S7207/pVAX1-P32在小鼠体内具有良好的安全性。
减毒沙门菌在传递DNA 过程中存在着载体中表达质粒的不稳定、质粒丢失及抗原的不稳定表达,这些都会降低这种重组疫苗的效果[11]。利用减毒沙门菌为载体传递DNA 疫苗研究时,要考虑质粒类型与其在宿主菌内稳定性的关系。对于口服DNA 疫苗,外源抗原基因表达的稳定性对于持续有效地激发机体的免疫应答十分重要。载体-宿主平衡致死系统构建的减毒沙门菌可以使外源抗原在没有抗生素的条件下稳定表达,有效保证质粒的稳定性[12-13]从而使该系统作为活疫苗载体成为可能[14]。本试验对S7207/pVAX1-P32及S7207进行体外传代,通过绘制其生长稳定性曲线,可见“含质粒菌株”生长稳定性高于“不含质粒菌株”。同时,从试验结果可见,“含质粒菌株”和“不含质粒菌株”细菌符合一般细菌的生长规律。
通过在口服该疫苗后不同时间剖检小鼠,并通过PCR 方法测定质粒在小鼠体内的散布规律,结果表明了免疫接种组小鼠在首免后7d~45d都能检测到与预期片段大小一致的目的片段,说明该质粒在动物体内具有分布广泛性,其能够较好的进入动物机体各组织器官,达到免疫效果。
研究表明,重组沙门菌S7207/pVAX1-P32具有良好的安全性和稳定性。
[1]Tulman E R,Afonso C L,Lu Z,et al.The genomes of sheeppox and goatpox viruses[J].J Virol,2002,76(12):6054-6061.
[2]朱学亮,张 强,杨 帆,等.羊痘病毒载体研究进展[J].中国畜牧兽医,2009,36(5):98-101.
[3]胡 慧,陶 玲,崔保安,等.以减毒沙门氏菌为SARS2CoV N DNA 口服疫苗载体的初步研究[J].中国生物工程杂志,2010,30(1):41-46.
[4]Otten G R,Schaefer M,Doe B,et al.Potent immunogenicity of an H IV21gag2pol fusion DNA vaccine delivered by in vivo electroporation[J].Vaccine,2006,24(21):4503-4509.
[5]Krishnan B R.Current status of DNA vaccines in veterinary medicine[J].Adv Drug Delivery Rev,2000,43:3-11.
[6]Urashima M,Suzuki H,Yuza Y,et al.An oral CD40ligand gene therapy again stlymphoma using attenuatedSalmonella typhi-murium[J].Blood,2000,95(4):1258-1263.
[7]焦凤超,李迎晓,刘纪成,等.减毒沙门氏菌运送的口服DNA疫苗研究进展[J].中国兽医杂志,2008,44(4):50-51.
[8]Dietrich G,Spreng S,Gentschev I,et al.Bacterial systems for the delivery of eukaryotic antigen expression vectors[J].Antisense Nucleic Acid Drug Dev,2000,10(5):391-399.
[9]张 瀚,王 亮,陈 强,等.活菌载体疫苗的研究概述[J].广东畜牧兽医科技,2006,31(5):3-5.
[10]潘志明,焦新安,黄金林,等.携带新城疫病毒DNA 疫苗的鼠伤寒沙门氏菌及其安全性与免疫效力[J].微生物学报,2005,45(5):937-940.
[11]Bauer H,Darji A,Chakraborty T,et alSalmonellamediated o-ral DNA vaccinatiom using satbilized eukarytic expression plasmids[J].Gene Ther,2005,12(4):364-372.
[12]腾家波.载体-宿主平衡致死系统在减毒伤寒沙门氏活菌中的应用[J].国外医学:免疫学分册,1999,23(3):143-146.
[13]王恒梁,冯尔玲,林 云,等.弗氏弗氏志贺菌2aT32株asd基因缺失突变体的构建[J].军事医学科学院院刊,2000,24(2):1-5.
[14]Curtiss R,Nakayam A K,Kelly S M.Recombinant avirulentSalmonellavaccine strains with stable maintenance and high level expression of cloned genesin vivo[J].Immunol Invest,1989,18(1-4):583-596.
