基于Box-Behnken法筛选与优化虎杖疏松愈伤组织培养条件
2012-06-14徐瑞超马云桐
徐瑞超,马云桐
虎杖主含蒽醌类、黄酮类、芪类化合物等成分,现代药理研究证明具有抗氧化、抗病毒、抗肿瘤、降血脂、抗菌和治疗心血管疾病的作用[1~4],其中多酚类化合物白藜芦醇对人体具有降血脂、抗血栓、预防动脉硬化以及增强免疫功能等重要调节作用,并成为具有研究前景的抗癌药物之一[5~7],因而对白藜芦醇的需求量逐日增大。为了保护虎杖野生资源,应用现代生物技术开展虎杖组织和细胞培养大规模生产白藜芦醇具有重要的现实意义。本试验采用Box-Behnken法优化虎杖愈伤组织的培养条件,以诱导出生长旺盛、质地疏松的愈伤组织,筛选出虎杖愈伤组织诱导、继代的最佳培养条件,为虎杖细胞悬浮培养提供科学依据。
1 材料及方法
1.1 材料
虎杖原植物采自于四川省峨眉山,经马云桐教授鉴定为虎杖Polygonum cuspidatum Sieb.et Zucc.,取健康、无病虫害的植株为实验材料。
1.2 方法
1.2.1 外植体消毒与培养 选取幼嫩虎杖,用流水冲洗干净,75%乙醇浸泡30 s,无菌水洗涤3次,再用0.1%升汞溶液消毒10 min,无菌水冲洗5~7次,切成0.5 cm大小,接种于培养基上培养。培养条件:温度(24±2)℃,空气湿度为60%左右,光照强度1200 lx,光照12 h/d。
1.2.2 不同外植体诱导试验 分别选用虎杖叶柄、叶片和茎作为外植体,接入下列培养基中培养25 d后,计算其诱导率。其中蔗糖用量为30 g.L-1,琼脂粉为7 g.L-1。
Ⅰ MS+6-BA 2.0 mg.L-1+KT 0.3 mg.L-1+2,4-D 0.5 mg.L-1+NAA 0.3 mg.L-1
Ⅱ MS+6-BA 3.0 mg.L-1+KT 0.2 mg.L-1+2,4-D 0.5 mg.L-1
Ⅲ MS+NAA 2.0 mg.L-1+KT 0.1 mg.L-1
Ⅳ MS+6-BA 0.4 mg.L-1+NAA 1.2 mg.L-1
Ⅴ MS+CPPU 0.5 mg.L-1+NAA 0.2 mg.L-1
1.2.3 光培养和暗培养的对比试验 以上试验完成后,选择最佳外植体(叶柄),于相应最佳诱导培养基中接种40瓶,接种后取20瓶进行暗培养,剩余20瓶进行正常光培养。试验重复3次,30 d后统计愈伤组织增殖率。
愈伤组织的生长量的测定:接种前先称取带培养基的空瓶重,记录数据,接种后再称取重量,两次重量之差便是初始接种物的初重量。经过一段时间的培养,取出培养物转接到已称量好瓶重的新鲜培养基上,再称量,记录数据,前后重量之差即为培养物的生长量。
1.2.4 不同的激素水平对虎杖愈伤组织增殖的影响 在前期预实验基础上,采用响应面方法中的Box-Behnken设计,选择6-BA浓度、KT浓度、2,4-D浓度3个因素,做3因素3水平共17个试验点(5个中心点)的响应面分析试验,通过Design Expert 7.1.3软件,对虎杖愈伤组织培养工艺进行分析,建立数学模型,得到最佳工艺参数。因素与水平设计见表1。
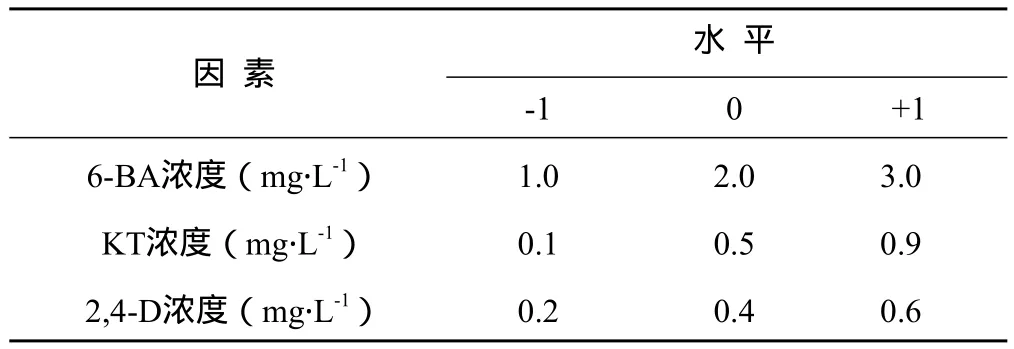
表1 Box-Behnken设计因素与水平表
2 结果与分析
2.1 培养基不同激素及浓度对外植体愈伤组织诱导情况(见表2)
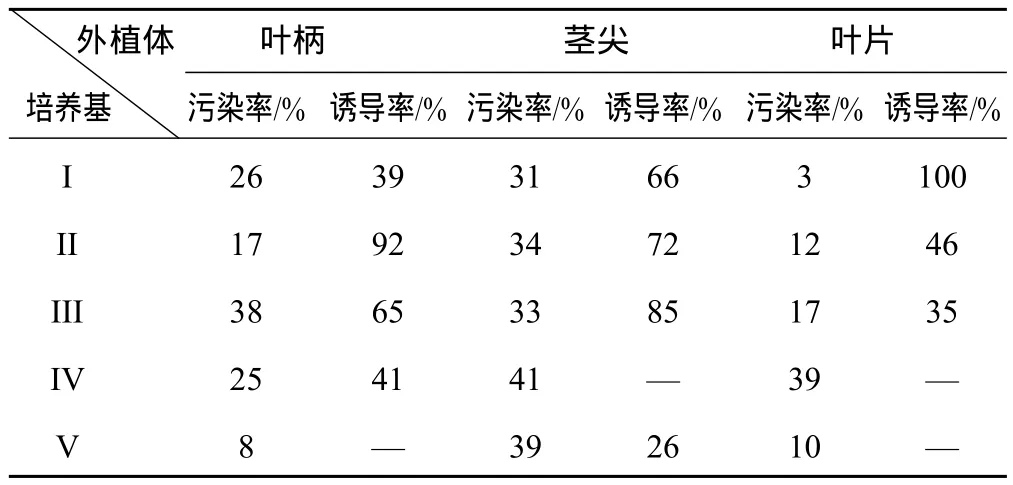
表2 不同的培养基对虎杖愈伤组织的诱导情况
接种7 d后,观察可见:茎尖在Ⅲ号培养基的切口处开始膨大,接种9 d后叶柄在Ⅱ号培养基的两端口开始膨大;Ⅰ号培养基里叶片作为外植体到12 d左右开始膨大、卷曲。10 d左右茎尖周围出现颗粒状愈伤组织,出愈时间茎尖>叶柄>叶片。叶柄在Ⅴ号培养基未能诱导出愈伤,在Ⅱ号培养基中诱导率最高为92%。叶片在Ⅰ号培养基中诱导率达100%,同时污染率最低。茎尖虽然出愈时间最短,可是污染率偏高,其次为叶柄。茎尖诱导的愈伤组织颜色淡黄白色,质稍疏松,其次为叶柄,叶片诱导的愈伤组织淡黄绿色,颗粒大,质地稍坚硬。由于茎尖污染率较高,由此叶柄为虎杖愈伤组织诱导的最佳外植体,相应的最佳诱导培养激素为:Ⅱ MS+6-BA3.0 mg.L-1+KT0.2 mg.L-1+2,4-D0.5 mg.L-1。
2.2 光培养和暗培养对虎杖愈伤组织生长的影响
观察可见,接种9 d后,暗培养的部分接种的叶柄两端切口处有不同程度的膨大现象,13 d时切口膨大处裂开,并长出白色颗粒状的愈伤组织。光培养的情况为:接种12 d后部分顶芽切口处出现膨大,15~16 d顶芽膨大处陆续长出绿色颗粒状的愈伤组织,以后愈伤组织数量逐渐增多并变大。由此可见,在暗培养条件下比光培养条件下先形成愈伤组织。30 d后计算愈伤组织鲜重增长量,统计结果见表3。从表3中可见,光培养的愈伤组织增长量最小值和最大值分别为0.106 g和1.054 g,平均值为0.407 g;而暗培养分别为0.229 g和1.169 g,平均值为0.698 g。结果表明,暗培养对愈伤组织的生长更加有利。因此,在对虎杖的外植体进行愈伤组织诱导时,暗培养加快愈伤组织形成的速度,同时也更有利于其愈伤组织的生长。
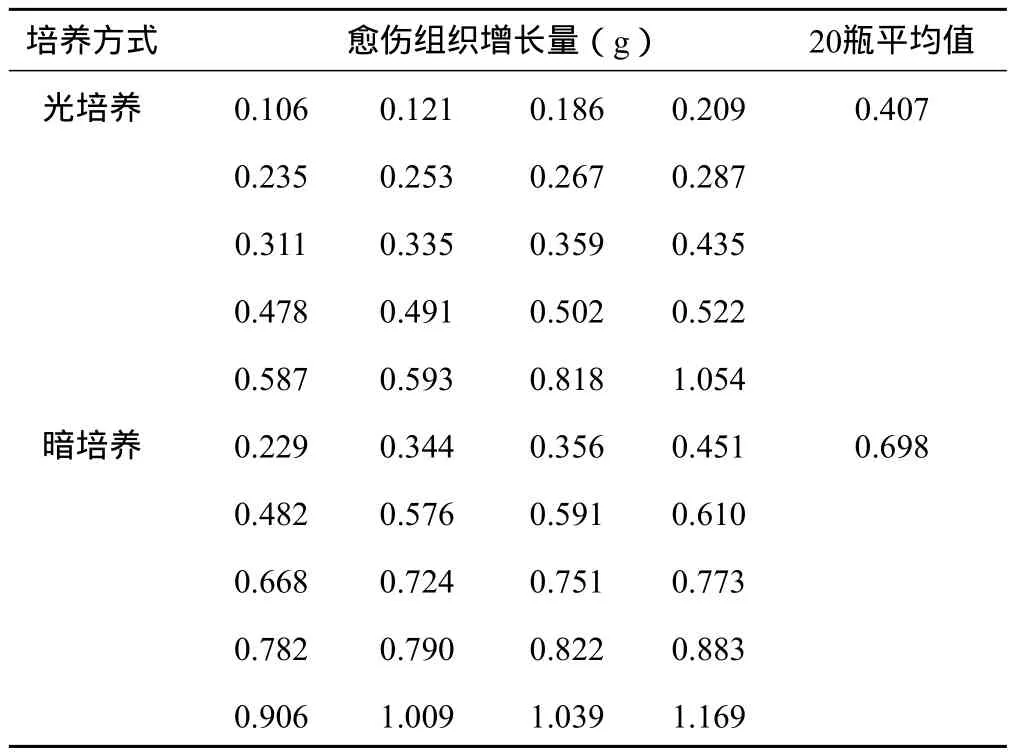
表3 光培养和暗培养的愈伤组织鲜重增长量对比
2.3 不同的激素水平对虎杖愈伤组织增殖的影响
2.3.1 Box-Benhnken实验结果 根据Box-Benhnken设
计进行试验,采用响应面法对主要影响参数进行优化,采用Design Expert7.1.3 统计软件进行试验设计与回归分析。试验结果见表4,回归分析结果见表5。
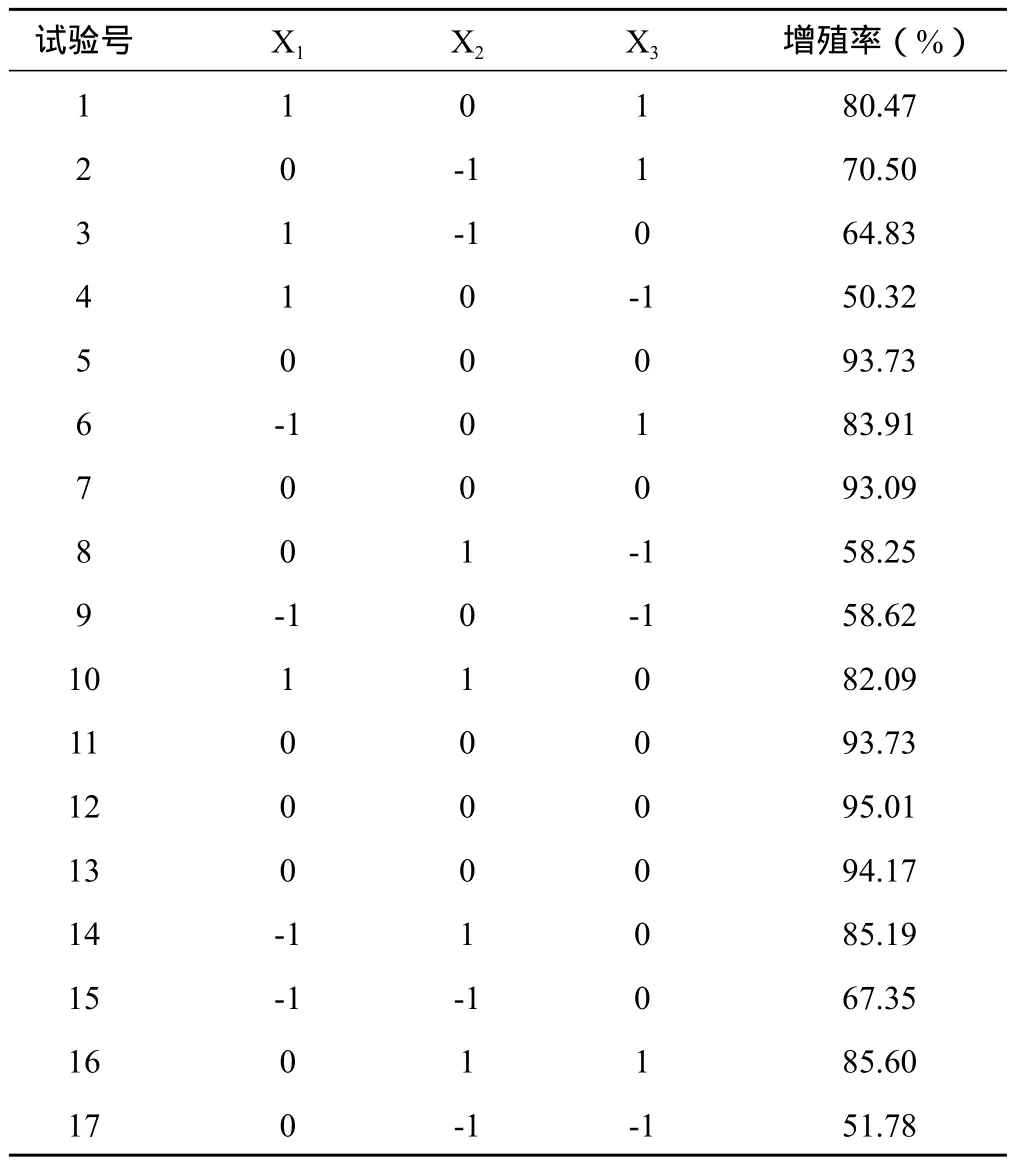
表4 Box-Benhnken实验结果
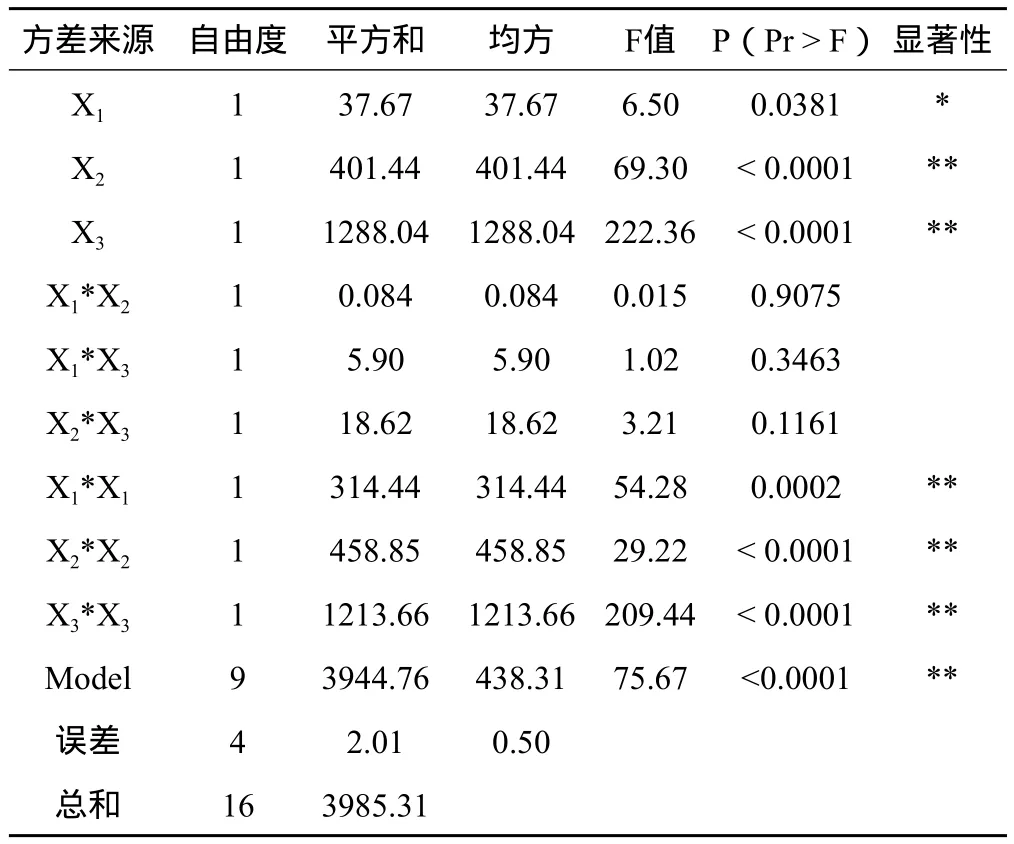
表5 回归分析结果
2.3.2 模型拟合 采用Design Expert7.1.3软件,对表4中的数据进行多元回归拟合,选择对响应值显著的各项,可得6-B A浓度、KT浓度、及2,4-D浓度与虎杖愈伤组织增殖率的二次多项回归方程,回归方程为:Y=-52.77194+30.1845X1+171.8825X2+374.5975X3-0.725X1X2+6.075X1X3+53.9375X2X3-8.64175X12-260.98125X22-424.35625X32。回归方程高度显著(P<0.0001),相关系数R=99.98%,说明响应值的变化有99.98%来源于所选变量。因此回归方程可以较好地描述各因素与响应值之间的真实关系,可以利用该回归方程确定三个参数的最佳水平。模型预测最大响应值为97.91%。由分析结果可算出各因素的最佳取值:6-BA浓度为1.9 mg.L-1,KT浓度为0.4 mg.L-1,2,4-D浓度0.5 mg.L-1。
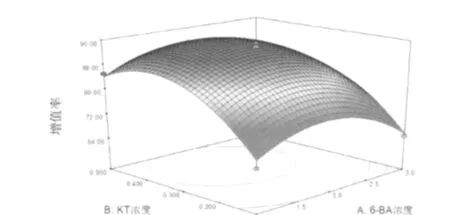
图1 6-BA浓度与KT浓度对虎杖愈伤组织增殖率影响的响应面及等高线图
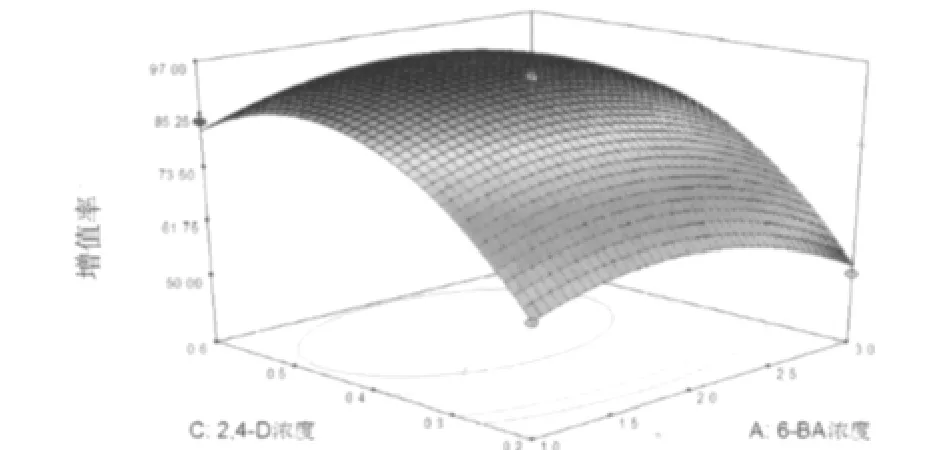
图2 2,4-D浓度与6-BA浓度对虎杖愈伤组织增殖率影响的响应面及等高线图
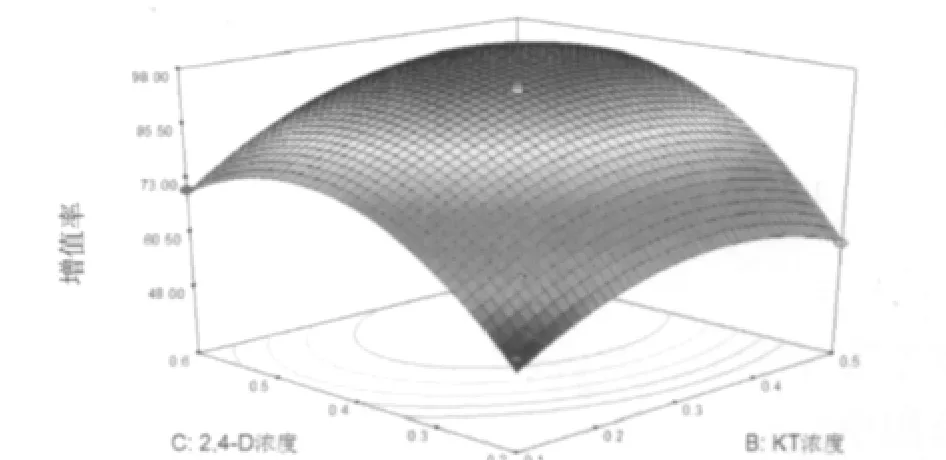
图3 2,4-D浓度与KT浓度对虎杖愈伤组织增殖率影响的响应面及等高线图
2.3.3 响应面分析法优化 响应值对影响因素的响应曲面图及其等高线图,可以直观反映各因素交互作用对响应值的影响,见图1~图3。通过该组图即可对任何两因素交互影响虎杖愈伤组织增殖的效应进行分析与评价,并从中确定最佳因素水平范围。2.3.4 模型的验证 为了验证虎杖愈伤组织增殖率模型方程的适用性,在选取6-BA浓度为1.9 mg.L-1,KT浓度为0.4 mg.L-1,2,4-D浓度0.5 mg.L-1的水平上,重复试验3次,得到虎杖愈伤组织增殖率达97.78%。与实测值吻合较好,说明利用响应面分析法得到的虎杖愈伤组织增殖工艺参数是真实可靠、具有实用价值的。
3 讨论
采用现代生物技术开展虎杖组织及细胞培养大规模生产白藜芦醇具有繁殖速度快、繁殖系数高的优势,且不受地理环境及气候等条件的影响,是解决原料资源不足的最佳途径,而虎杖愈伤组织生长过于致密难以实现细胞悬浮培养,因此获得疏松、增殖快的愈伤组织是实现虎杖细胞悬浮培养的前提。本文采用Box-Behnken设计方法,仅用较少的试验组合,通过统计学分析,明确了虎杖愈伤组织诱导的主要因素,同时优化筛选了虎杖愈伤组织诱导和生长的最佳培养基和外植体,大大提高了试验效率。虎杖愈伤组织的形成和生长是受多种因素影响的,而激素是影响愈伤组织诱导和生长的主要因素。目前,关于虎杖组织培养的研究的报道较少,曹庸等[8]通过比较虎杖不同外植体愈伤组织诱导率发现根茎芽的诱导率最高,为73%,而曾超珍等[9~10]研究发现虎杖叶柄的诱导率更高。本试验中发现叶片的诱导率最高,但其过于致密;其次为叶柄,诱导率可达92%,结合疏松诱导率、疏松程度及污染率等指标综合考虑,最终选择叶柄作为虎杖愈伤组织诱导的最佳外植体。从试验中还发现不同的光照条件对虎杖愈伤组织的诱导率有一定的影响,并得知暗培养对愈伤组织的生产更加有利,可加快愈伤组织形成的速度,因此研究愈伤组织诱导率的影响因素要兼顾光照条件。有关蔗糖、pH、有机物、氮源等非激素因子对虎杖愈伤组织的影响及虎杖细胞悬浮培养是后期研究的重点,该部分内容将另文讨论。
[1] 薛岚.中药虎杖的药理研究进展[J].中国中药杂志,2000,25(11):651.
[2] 杨建文,杨彬彬,张艾.中药虎杖的研究与应用开发[J].西北农业学报,2004,13(4):156.
[3] Meishiang J, Lining C, U deani G O, et a1.Cancer chem.opreventive activity of resveratrol, a natural product derive from grapes [J].Science, 1997,275(1):218.
[4] Burknhard S, Reiter R J, Tan D X, et a1.DNA oxidatively damaged by chromium(III) and H2O2is protected by theantioxidants melatonin, N(1)-acetyl-N(2)-fomyl-5methoxykynu rain ine, resveratrol and uric acid[J].Int.J.Biochem.Cell Biol, 2001,33(8):775.
[5] 李银春,赵振成.虎杖[J].特种经济动植物,2004,7(7):25.
[6] 向敏,匡晓东,杨勇.白藜芦醇及其药理保健功能的研究[J].中国食品添加剂,2002,(5):16.
[7] 刘娅,王光慈.白藜芦醇生理活性作用研究进展[J].中国食品添加剂,2002,(6):19.
[8] 曹庸,陈雪,唐永红,等.虎杖愈伤组织的诱导及高产白藜芦醇材料的筛选[J].生命科学研究,2006,10(3):270.
[9] 曾超珍,刘志祥,黎继烈,等.虎杖疏松愈伤组织诱导条件的研究[J].时珍国医国药,2008,19(1):80.
[10] 曾超珍,张映辉,刘志祥.虎杖疏愈伤组织培养条件的优化[J].北方园艺,2008(12):167.
