白僵菌RAPD-PCR反应体系优化1)
2012-06-13魏晓鹏李会平黄大庄唐秀光
魏晓鹏 李会平 黄大庄 唐秀光
(河北农业大学,保定,071000)
近年来,随着国家大力倡导林业生产的可持续发展,在林业病虫害防治中,生物防治越来越受到重视。白僵菌(Beauveria bassiana)作为当前世界上研究和应用最多的一种广谱虫生真菌,其致病力强,杀虫谱广,对温血动物和植物无害且容易培养。我国南至海南、北抵黑龙江都有白僵菌的分布,应用白僵菌防治农、林害虫的种类和面积均居世界首位,防治害虫种类达40种以上,年防治面积达67万hm2,在控制森林害虫的严重发生和减少环境污染方面,发挥着不可替代的作用[1]。然而在研究和应用过程中,菌株继代培养一定代数后经常出现生产性状的退化,如产孢量减少、杀虫毒力降低等。目前对菌株退化的研究主要集中在菌落局变、产孢量、杀虫毒力变化等宏观方面的研究,关于菌株退化的原因,自1974年Yurchenko首次报道球孢白僵菌具有异核现象,张志光进一步证实其在自然界以异核体形式存在后,许多学者据此推测,由于异核体不稳定,在人工培养基上的培养过程中,异核体内核比例不断变化,比较适用培养基腐生条件类型的核被选择出来占优势,但这种类型对昆虫致病力不一定强,由此导致菌种毒力发生改变[2-3]。王成树等[4]采用分子标记方法验证了球孢白僵菌的异核现象。唐晓庆等[5]认为白僵菌在继代培养中发生的菌落局变现象与白僵菌在生产和应用过程中常见的退化现象基本一致。其他关于白僵菌退化的遗传学研究还鲜见报道,这就大大限制了利用生物工程技术控制菌种退化工作的进行。基因组DNA的提取和PCR反应是遗传学研究的前提,因此笔者在基因组DNA提取的基础上,对白僵菌RAPD反应体系及反应条件进行探索,旨在找到适宜于白僵菌退化遗传学研究的一套完整的RAPD-PCR反应体系及反应程序。
1 材料与方法
1.1 试验材料
供试菌株:球孢白僵菌Bb00菌株,由河北农业大学林学院林木病理实验室提供。
菌体制备:将1×108/mL的白僵菌孢子悬浮液,涂布于铺有玻璃纸的PDA平板培养基上,恒温培养箱中25℃无光照培养5 d后刮取干菌丝,放入冰箱中-20℃保存备用。
主要试剂:随机引物由上海生工生物工程技术服务有限公司合成,4种dNTP、5 UTaqDNA聚合酶、DL2000 ladder marker均购于 Promega公司,Gold-View和琼脂糖购于北京索莱宝科技有限公司,DNA提取试剂盒(Universal Genomic DNA Extraction Kit Ver.3.0(DV811))购于宝生物工程(大连)有限公司。
1.2 试验方法
基因组DNA提取:白僵菌基因组DNA提取按照试剂盒提供的说明书操作步骤进行。
RAPD-PCR正交组合优化设计:参照李增智等[6],引物选用 P25(5'-AACGGTGACC-3'),由上海生工生物工程有限公司合成。采用L16(45)正交试验设计,在20 μL反应体系中,选择 Mg2+、dNTP、TaqDNA聚合酶、引物、模板DNA 5种因素,每个因素设4个水平(表1)。RAPD-PCR反应程序为94℃ 预变性2 min,94 ℃ 变性30 s,38 ℃退火40 s,72 ℃延伸1 min,循环共40次,72℃延伸5 min。PCR扩增产物在1.5%琼脂糖凝胶上(含GoldViewTM核酸染料)电泳分离,紫外凝胶成像系统下观察并照相。DNA marker采用DL2000 DNA ladder分子质量标准。RAPD反应程序主要参照韩小勇等[7]的方法。
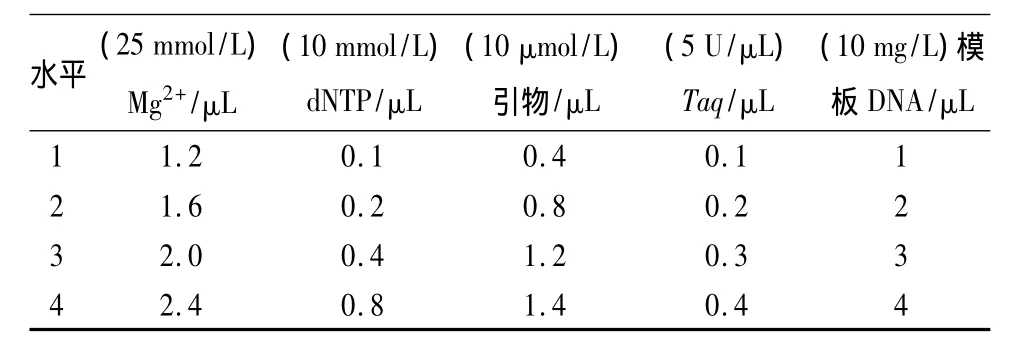
表1 RAPD-PCR反应体系各组分加样量
RAPD-PCR反应的退火温度和循环次数优化设计:确定RAPD-PCR反应体系最优组合之后,对RAPD-PCR反应程序中的退火温度和循环次数分别进行单因素梯度优化,并分析比较2个因素对扩增反应的影响。退火温度设计 30、32、34、36、38、40、42℃ 7个梯度;循环次数设计35、40、45次3个梯度。
2 结果与分析
2.1 DNA 提取效果
用DNA提取试剂盒(DV811)提取白僵菌基因组DNA的凝胶电泳图谱完整性较好,条带整齐明亮(图1),无降解,说明提取的DNA质量较好,适合用于RAPD-PCR扩增。

图1 白僵菌基因组DNA的凝胶电泳图谱
2.2 白僵菌RAPD-PCR反应体系的正交设计组合
从图2可以看出,在正交设计的16个组合中各组合之间扩增的结果表现出一定的差异性。在16个组合中6、11和13号组合未扩增出条带,1、2、5、12、15、16号组合扩增的条带较模糊且不稳定,3、4、7、8、9、10、14 号组合扩增的条带均较清晰,但以 4号组合扩增的结果最清晰、条带数最多且稳定性很好。因此,确定白僵菌RAPD-PCR最优反应体系(20 μL)为:10×Buffer 2 μL,MgCl2(25 mmol/L)2.4 μL,4 种 dNTP(各 2.5 mmol/L)0.8 μL,随机引物(10 μmol/L)1.4 μL,TaqDNA 聚合酶(5 U/μL)0.4 μL,模板 DNA(10 mg/L)1 μL。

图2 正交组合设计的RAPD-PCR反应体系扩增图谱
2.3 RAPD-PCR反应的最优退火温度和循环次数
从图3中可以看出,在RAPD-PCR反应中所设计的7个温度梯度中30、34、40、42℃几乎未扩增出条带,32、36℃时扩增出的条带较模糊,在38℃时扩增出的条带最亮且主带也最为清晰。

图3 不同退火温度下白僵菌RAPD-PCR扩增图谱
从图4显示的循环次数优化结果中可以看到,45次循环时的条带模糊,产物量较少并且不稳定,35次循环时几乎未出现条带,在40次循环时的条带最为清晰可见并且产物量最多。综合上述试验结果确定白僵菌RAPD-PCR反应的最优条件为:94℃预变性2 min;94℃变性30 s;38℃退火40 s,72℃延伸1 min,40个循环;72℃延伸5 min。

图4 不同循环次数下白僵菌RAPD-PCR扩增图谱
3 结论与讨论
利用正交组合试验和单因素梯度试验对白僵菌基因组DNA、RAPD-PCR反应体系中各组分进行了优化,得出20 μL PCR反应体系中各因素优化组合为,10×Buffer 2 μL,MgCl2(25 mmol/L)2.4 μL,4 种dNTP(各 2.5 mmol/L)0.8 μL,随机引物(10 μmol/L)1.4 μL,TaqDNA 聚合酶(5 U/μL)0.4 μL,模板DNA(10 mg/L)1 μL;反应程序的优化条件为,94℃预变性 2 min,94 ℃变性30 s,38 ℃退火40 s,72 ℃延伸1 min,循环次数40次,72℃延伸5 min。该试验结果可为研究白僵菌的退化机理和多样性及种内变异提供一个方便直观的技术参考。
试验过程中模板DNA纯度和浓度的改变会影响PCR反应中每个产物片段的丰度,因此DNA的提取至关重要,在利用试剂盒抽提DNA的时候以下几点可以确保提出高质量的模板DNA。①要提前对研钵进行预冷,防止菌丝放入未预冷的研钵中研磨时DNA因高温而降解,并且在研磨时要迅速不断地加入液氮冷冻菌丝防止其融化;②在65℃水浴保温时,时间在15~20 min为最宜,时间太长DNA会因高温而降解,时间太短蛋白质等杂质消化不完全会污染DNA;③在加入Solution C溶液之后应将离心管上下反复颠倒使其完全混匀在停止颠倒时管内未出现分层即可离心。对于高质量的DNA模板RAPD所需要的DNA标准量在10~100 ng,本试验所用的DNA模板量均在10 ng左右。
在RAPD技术中不同的引物对Mg2+的浓度要求也不同,其次Mg2+浓度会直接影响TaqDNA聚合酶活性,其浓度过高反应特异性就会降低,浓度过低会大大降低TaqDNA聚合酶活性,从而影响反应的产物量[8-11]。本试验中所用的缓冲液(10×)不含Mg2+。dNTP作为PCR反应的原料,其浓度过高会导致TaqDNA聚合酶的错误掺入,浓度过低又会影响合成效率[12],笔者采用的dNTP浓度为10 mmol/L,研究中发现随着dNTP用量的减少,扩增的产物量在逐渐下降,条带表现为暗淡甚至无条带。因此,在试验过程中各个因素之间需要相互的优化组合之后才会取得较好的结果。
对PCR反应的退火温度和循环次数进行了单因素优化。退火温度一般参考引物的Tm值,温度太高或太低都会影响PCR扩增的结果。因此在扩增时,设计了 30、32、34、36、38、40、42 ℃,在这 7 个温度梯度中30、34、40、42℃几乎未扩增出条带,32、36、38℃ 3个退火温度都有扩增产物,其中38℃时的扩增结果最理想,条带最清晰。循环次数主要取决于模板DNA和dNTP浓度,在PCR反应过程随着模板DNA和dNTP浓度的减少,如果循环次数过多或过少产物的量都会减少,因此,在确定模板DNA和dNTP浓度后,最合适的循环次数是PCR反应的关键。结果表明,在40个循环时PCR产物量达到最大值,条带数和清晰度为最优结果,可满足后续试验研究。
[1]赫英伟.白僵菌的研究概况[J].黑龙江农业科学,2010(4):145-147.
[2]Yurchenko L,Zakharov I A,Levttin M M.Genetique et selection du champignon entomopathogeneBeauveria bassiana(Bals.)Vuill etude de iheterocaryose[J].Genetika,1974,10:95-101.
[3]Quesada-Moraga E,Vey A.Intra-specific variation in virulence and in vitro production of macromolecular toxins active against locust amongBeauveria bassianastrains and effects of in vivo and in vitro passage on these factors[J].Biocontrol Science and Technology,2003,5(3):323-340.
[4]王成树,王四宝,李增智,等.球孢白僵菌种群野生菌株异核现象的分子验证[J].菌物系统,2001,20(4):475-481.
[5]唐晓庆,樊美珍,李增智.球孢白僵菌继代培养中菌落局变现象及环境影响因素的研究[J].真菌学报,1996,15(3):188-196.
[6]李增智,黄勃,樊美珍,等.利用RAPD-PCR检测三种白僵菌及球孢白僵菌种内变异[J].菌物系统,1998,17(2):185-189.
[7]韩小勇,李会平,苏筱雨,等.土壤中金龟子绿僵菌菌落宏观特征与DNA多态性的RAPD分析[J].东北林业大学学报,2010,38(5):105-109.
[8]李钧敏,边才苗.RAPD技术在生物遗传多样性研究中的应用[J].生物学通报,2001,36(12):30-31.
[9]张晗,沙伟.RAPD技术在遗传多样性研究中的应用[J].贵州科学,2003,21(3):81-84.
[10]袁秀洁,李会平,黄大庄,等.桑天牛成虫肠道细菌基因组DNA的提取及 PCR反应体系优化[J].蚕业科学,2009,35(2):379-383.
[11]周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005:79-84.
[12]郭大龙,吴正景,郑玉萍,等.苦瓜SRAP反应体系的建立与优化[J].安徽农业科学,2008,36(18):7583-7585.
