林可霉素A分子印迹聚合物微球的制备及性能
2012-06-11蒋兴娜李卫朋张佑红朱雄伟苏腾甲
蒋兴娜,李卫朋,张佑红,朱雄伟,谌 颉,苏腾甲
(武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北 武汉 430074)
0 引 言
林可霉素[1]是由Mason等在1962年从链霉菌林可变种培养液中获得的一类高效广谱的抗生素.国内林可霉素厂家发酵产物以林可霉素A为主,同时也含有林可霉素B、C、D等类似物.研究表明,林可霉素 A、B组分的分子结构中仅相差一个CH2,物理化学性质相似,但林可霉素B抗菌活力小,毒性大.因此,为提高林可霉素的药效,减少药物的毒副作用,需要对其进行分离提纯以获得高纯度的林可霉素.
我国各厂家所采用的林可霉素提炼工艺主要是溶剂萃取法,但此法存在工艺复杂、工序繁多、收率低、物耗及能耗高等缺点,故寻找出一种高效提高林可霉素A的纯度的方法是至今亟待解决的问题.分子印迹聚合物[2-7]是一种新型的分离材料,对目标分子具有高亲和性和选择性,适用于结构类似的化合物分离,特别是与色谱分析和分离[4-8],固相萃取[9]等技术的结合已成为研究的热点.
本研究运用分子印迹技术,首次以林可霉素A为模板分子,采用单步溶胀法[10-12]制备球形的分子印迹聚合物,并对其吸附性能进行研究,为进一步研制出有效分离林可霉素各组分的方法提供实验基础.
1 实验部分
1.1 试剂与仪器
1.1.1 试剂 苯乙烯;甲醇;冰醋酸;氯仿;偶氮二异丁腈;过二硫酸钾;邻苯二甲酸二丁酯;α-甲基丙烯酸;氯化钠;十二烷基硫酸钠;聚乙烯醇;乙二醇二甲基丙烯酸酯;盐酸林可霉素.
1.1.2 仪器 JY92-2D超声波细胞粉碎仪;JSM-5510LV扫描电子显微镜;马尔文激光粒度分析仪;Nicolet 6700傅立叶红外光谱仪;UV-1600紫外分光光度计;氮气吹干仪;SXT-06索氏提取器;1260安捷伦高效液相色谱;DZF-6050真空干燥箱;旋转蒸发仪;TG18M高速离心机;恒温振荡器.
1.2 方法
1.2.1 紫外光谱分析 称取适量的林可霉素加入容量瓶中,用氯仿稀释定容,配制浓度为4 mmol/L的溶液,固定该浓度,按1∶0、1∶2、1∶4、1∶6的比例加入功能单体MAA,25 ℃下振荡24 h后,以相应浓度的MAA氯仿溶液作为参比,测定林可霉素紫外吸收光谱的变化.
1.2.2 分子印迹聚合物烯微球的制备a.聚苯乙烯微球制备.将70 mL超纯水、0.087 g氯化钠、10 g苯乙烯单体加入锥形瓶中,室温下水浴超声分散40 min,然后将溶液转入到四口瓶,通入氮气20 min后加入30 mL 2.5 mmol/L脱氧过硫酸钾水溶液,在氮气保护下,70 ℃恒温反应20 h.反应结束后,冷却至室温,将获得的乳液用超纯水反复离心洗涤干燥后重新分散到水中,配成0.2 g/mL的分散液.
b.林可霉素A分子印迹聚合物烯微球的制备.称取0.406 g林可霉素溶解于5 mL氯仿中,加入0.34 g的甲基丙烯酸(MAA)、3.96 g乙二醇二甲基丙烯酸酯(EDMA)、1.96 g邻苯二甲酸二丁酯和0.2 g偶氮二异丁腈,溶解混合均匀后加入50 mL 0.1%(质量比)十二烷基硫酸钠和1.0%聚乙烯醇混合液,超声分散均匀,加入2.0 mL聚苯乙烯微球分散液,25 ℃下以150 r/min速度搅拌溶胀20 h.通入氮气保护,70 ℃反应20 h.非印迹聚合物微球的制备方法与上述相同,只是在制备过程中没有加入模板分子林可霉素A.
c.洗脱处理.将获得的颗粒置于索氏提取器中,以甲醇∶冰醋酸(9∶1)为溶剂萃取24 h除去模板分子,再用甲醇继续萃取5 h除去冰醋酸,最后用水洗去残留的甲醇,20 ℃真空干燥至恒重.
1.2.3 红外光谱分析 采用傅立叶红外光谱仪对MIPMs、MAA、EDMA进行光谱分析.
1.2.4 分子印迹聚合物微球的形貌及粒径分析 采用扫描电镜观测MIPMs的形貌,并用粒度分析仪对微球的粒径进行分析.
1.2.5 林可霉素的含量检测 吸附液中林可霉素的含量分析,采用高效液相色谱法.色谱条件:流动相为0.05 mmol/L的四硼酸钠水溶液(用浓盐酸将pH值调至6):甲醇(体积比6∶4);色谱柱为Phenomenex C18柱(4.6 mm×100 mm,5 μm);柱温25 ℃;流速1 mL/min;进样量5 μL;检测波长UV为214 nm.
1.2.6 分子印迹聚合物微球的结合性能研究 为研究MIPMs对模板分子的结合特性,取50 mg MIPMs和NIPMs分别置于25 mL锥形瓶中,加入不同浓度的林可霉素氯仿溶液, 25 ℃下恒温振荡24 h,然后将其混合物用0.45 μm微孔滤膜过滤,精密移取2 mL滤液用氮气吹干,甲醇稀释定容,通过高效液相色谱法测定吸附前和吸附平衡后溶液中的林可霉素A的浓度.
利用式(1.1)计算单位质量MIPMs和NIPMs对底物的吸附量Q:
(1.1)
式中,Q为分子印迹聚合物微球对底物的吸附量(μmol/g);C0为吸附前底物的初始浓度(mmol/L);C为吸附后溶液中底物的浓度(mmol/L);V为吸附液的体积(mL);m为吸附剂的质量(g).
为分析MIPMs对模板分子的识别特异性,称取50 mg MIPMs和NIPMs分别置于25 mL锥形瓶中,加入10 mL 1 mol/L的林可霉素粗品氯仿溶液,按相同的方法测定其含量.
利用式(1.2)计算结合分配系数KD:
(1.2)
式中,Cp为分子印迹聚合物微球结合底物的浓度(μmol/g);Cs为溶液中底物的平衡浓度(mmol/L).
利用式(1.3)计算分离因子α:
(1.3)
式中,α表示A,B两种物质的分离因子;KA表示A物质在分子印迹聚合物微球吸附后的分配系数(mL/g);KB表B物质在分子印迹聚合物微球吸附后的分配系数(mL/g).
2 结果与讨论
2.1 紫外光谱研究模板分子与功能单体的作用力
紫外光谱分析模板分子林可霉素和功能单体MAA在氯仿中结合的情况.
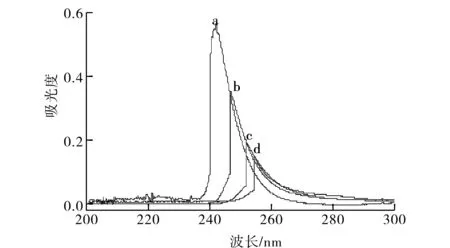
图1 林可霉素在不同浓度的MAA中的紫外吸收光谱Fig.1 UV adsorption of licomycin in the presence of different concentration of MAA m (lincomycin)/m 注:a) 1∶0; b) 1∶2; c) 1∶4; d):1∶6.
图1中的a、b、c及d曲线分别为4 mmol/L的林可霉素在氯仿中按1∶0、1∶2、1∶4及1∶6的比例加入MAA后的紫外光谱的变化.由图可知,随着MAA浓度的增加,林可霉素的最大紫外吸收波长出现红移,且波峰强度不断降低,这可能是由于林可霉素羰基中的氧原子与MAA中羟基的氧原子产生了较强的相互作用,推测为O…H―O的氢键作用.
2.2 红外光谱分析分子印迹聚合物微球的结构
红外光谱分析功能单体和交联剂的共聚情况、以及模板分子与功能单体之间发生作用的功能基团.
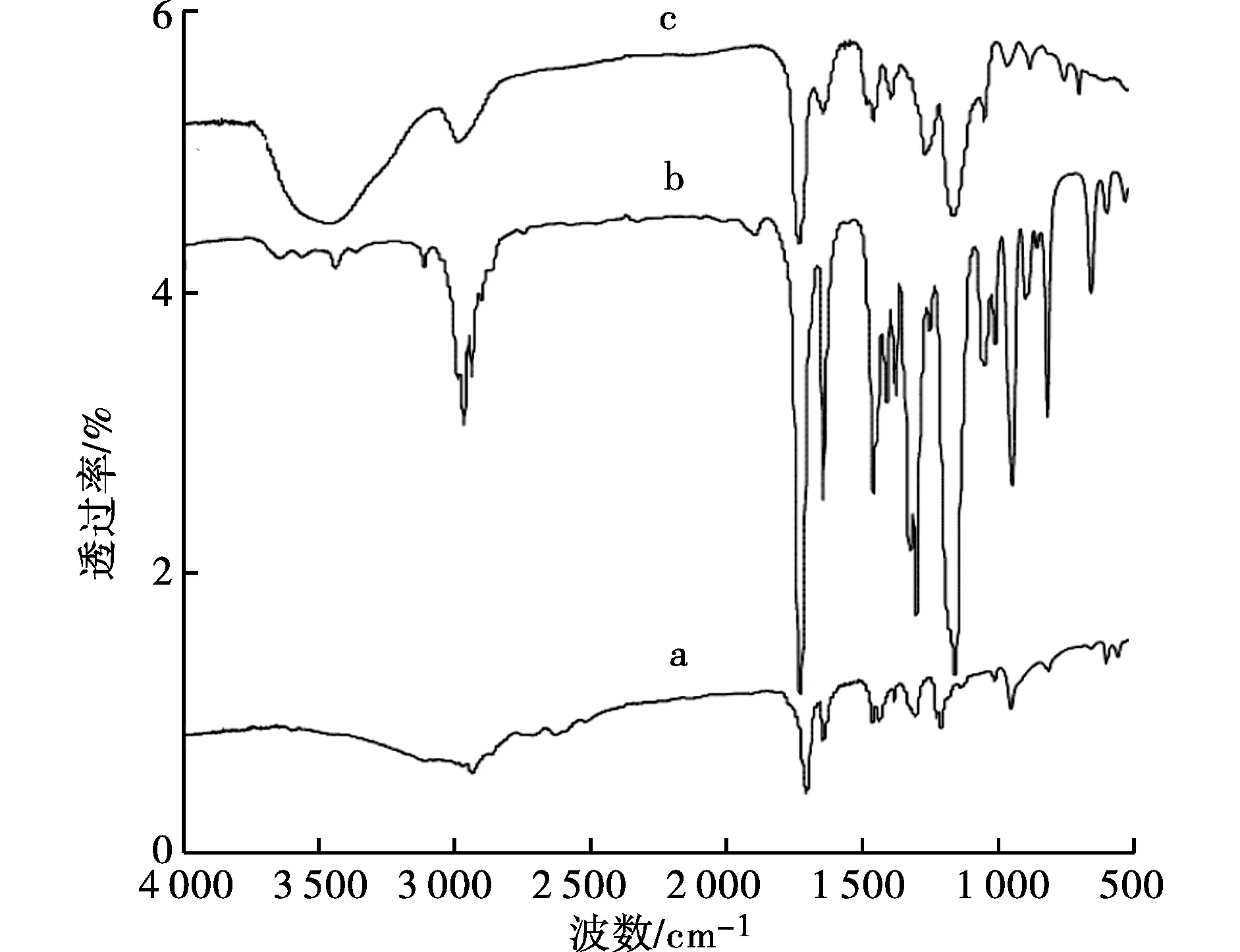
图2 MAA (a)、EDMA (b)及MIPMs (c)的红外光谱图Fig.2 IR of spectrum of MAA (a), EDMA (b) and MIPMs (c)

2.3 分子印迹聚合物微球的表观形貌及粒径
扫描电镜观察林可霉素A分子印迹聚合物微球的表观形态.

图3 MIPMs的扫描电镜照片Fig.3 SEM of MIPMs
由图3可知,MIPMs虽然表面有些粗糙,但是粒度均匀,单分散性良好.同时经激光粒度分析仪检测,其平均粒径为2.58 μm,基本符合色谱柱对微球粒径的要求.
2.4 分子印迹聚合物微球的结合性能研究
2.4.1 MIPMs的结合特性 研究MIPMs的结合特性,在林可霉素A浓度0~3.5 mmol/L的范围内,测定MIPMs和NIPMs的结合等温线.

图4 MIPMS和NIPMs的结合等温线Fig.4 Binding isotherm of MIPMs and NIPMs
图4中的a和b分别为MIPMs和NIPMs对林可霉素A的结合等温线.比较图4中的a、b曲线可知,MIPMs对林可霉素A的结合量高于NIPMs的,说明林可霉素A在MIPMs中留下的印迹孔穴及孔穴上的活性结合位点决定了MIPMs 对林可霉素A的亲合力.
2.4.2 MIPMs的特异识别性能 选用林可霉素A的结构类似物林可霉素B作为竞争底物考察MIPMs的识别性能(表1).
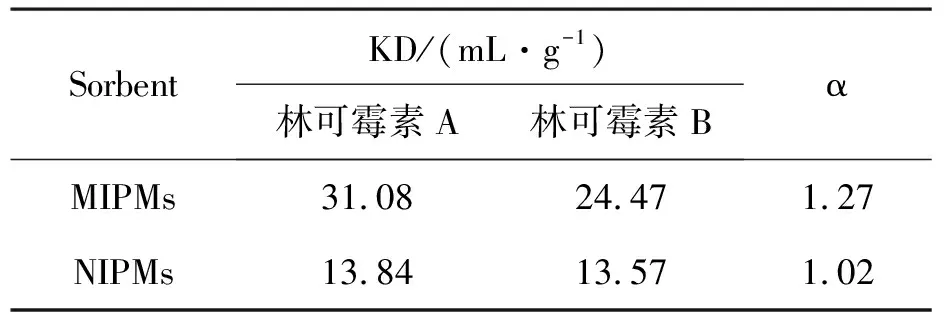
表1 MIPMs与NIPMs对林可霉素A和林可霉素B的吸附性能Table 1 capabilities of MIPMs and NIPMs to lincomycin A and lAdsorptionincomycin B
由表1可知,MIPMs和NIPMs分别对林可霉素A和林可霉素B两底物的吸附性能存在一定的差异.MIPMs对林可霉素A有一定的选择吸附能力,其分离因子α为1.27.NIPMs对两底物的吸附能力基本相当,其分离因子α仅为1.02.这种差异表明,通过单步溶胀聚合法制得的MIPMs对模板分子具有识别性能.
4 结 论
以大粒径的单分散聚苯乙烯微球为种球、林可霉素A为模板分子,采用单步溶胀聚合法制备林可霉素A的分子印迹聚合物微球.通过对其结构的表征和识别性能的测定,表明该材料对林可霉素A具有一定的亲和性和选择性,对林可霉素A和林可霉素B的分离因子α为1.27,而非印迹聚合物微球的分离因子α仅为1.02.该分子印迹聚合物微球有望用于林可霉素粗品的分离、纯化.
参考文献:
[1] 顾觉奋. 微生物化学药品与分析[M]. 北京:军事医学科学出版社, 1996:1-2.
[2] 小宫山真, 竹内俊文, 务川高志. 分子印迹学——从基础到应用[M]. 北京: 科学出版社, 2006:6-11.
[3] 姜忠义, 吴洪. 分子印迹技术[M]. 北京: 化学工业出版社, 2003:1-6.
[4] Chapuis F, Mullot J U, Pichon V G, et al. Molecularly imprinted polymers for the clean-up of a basic drug from environmental and biological samples [J]. Chromatography A, 2006, 1135(2):127-134.
[5] Ariffin M, Miller E I, Cormack P, et al. Molecularly imprinted solid-phase extraction of diazepam and its metabolites from samples [J]. Analytical Chemistry, 2007, 79(1):256-262.
[6] Maya Z, Manu K, Marc O, et al. Molecular imprinting of maltose binding protein: Tuning protein recognition at the molecular level [J]. Macromolecules, 2011, 44 (10):3966-3972.
[7] Wulff G. Design of biomimetic catalysts by molecular imprinting in synthetic polymers: The role of transition state stabilization [J]. Accounts of Chemical Research, 2012, 45 (2):239-247.
[8] 颜流水, 王宗花, 罗国安, 等. 分子印迹毛细管整体柱液相色谱法测定咖啡因[J]. 分析化学学报, 2004(2):148-152.
[9] Zhai Y, Yang D, Chang X, et al. Molecularly imprinted polymer(II) from biological and natural water samples by SPE using ion-imprinted polymer[J]. Separation Science, 2008, 31(6/7): 1195-1200.
[10] 赖家平, 曹现峰, 何锡文, 等. 水溶液中制备分子印迹聚合物微球及其分子识别特性研究[J].化学学报, 2002, 60(2):322-327.
[11] Zhang Li yong, Cheng Guo xiang, Fu Cong. Molecular selectivity of tyrosine imprinted polymers prepared by seed swelling and suspension polymerization [J]. Polymer International, 2002, 51(8):687.
[12] Hien N T, Richard J. N-isopropylacrylamide as a functional monomer for noncovalent molecular imprinting [J]. Journal of Molecular Recognition, 2012, 25(1):1-10.
