米粒和微球状二氧化铈的水热法合成及表征
2012-06-11张远孝马锦爱江吉周
邹 菁,张远孝,马锦爱,江吉周,李 露,舒 好
(武汉工程大学化工与制药学院,绿色化工过程教育部重点实验室,湖北 武汉 430074)
0 引 言
二氧化铈(n型半导体)是稀土氧化物中活性较高、用途极广且廉价的一种材料,因为具有较为独特的萤石晶体结构,使得其具有特殊的性能:氧空位缺陷能够在CeO2表面快速地形成和消失,使得CeO2表面具有Ce4+/Ce3+的氧化还原循环,从而具有很高的氧存储能力(OSC)[1],释放氧功能,以及氧化还原反应能力,在很多领域都有广泛的应用:汽车尾气处理的三效催化剂[2]、固体氧化物燃料电池[3]、光催化降解有机污染物[4]、紫外吸收材料[5]、氧传感器[6]、离子型掺杂改性模拟优化[7]等.有关纳米CeO2的制备方法主要有:水热法、沉淀法、溶胶-凝胶法、微乳液法、固相法等.如:Zhang等[8]采用非水溶胶-凝胶法将Ce(NO3)3的苯甲醇溶液在120 ℃下回流48 h得到纳米CeO2微球;Cui[9]等以Ce(NO3)3·6H2O和C6H5Na3O7·2H2O为原料,去离子水为溶剂,于200 ℃水热反应24 h后并在500 ℃下煅烧3 h制备了由四方片组成的CeO2纳米球;Yang等[10]以CeCl3·7H2O为铈源,H2O2为氧化剂,在溶解过程中加入聚乙烯吡咯烷酮,180 ℃反应24 h,采用水热法合成了单分散的CeO2中空球.尽管制备CeO2的方法很多,但存在合成反应时间过长、形貌不易控制等问题.水热法因其合成的晶体纯度高,分散性好,形貌可控,制备过程污染小等特点,受到广泛的关注.本研究以硝酸铈和尿素为原料,双氧水为氧化剂,通过对制备过程中影响因素的研究,探索出单分散米粒和微球状的CeO2的制备方法,该水热法合成时间短,仅只需要6 h,且条件温和,绿色环保,没有添加任何有机试剂.
1 实验部分
1.1 仪器与试剂
主要仪器:X射线衍射仪(XRD AXS D8 Advance, Bruker);扫描电子显微镜(SEM,JSM-5510LV型,JEOL);激光拉曼光谱仪(Raman,DXR, Thermo ),固体紫外分光光度计(UV-DRS, Cary-5000 ,Varian)电化学工作站(CHI660C,上海辰华).
主要试剂:六水合硝酸铈,国药集团化学试剂有限公司生产,分析纯;氢氧化钾,国药集团化学试剂有限公司生产,分析纯;氨水,国药集团化学试剂有限公司生产,分析纯;质量分数为30%的双氧水,国药集团化学试剂有限公司生产,分析纯;尿素,广东西陇化工厂生产,化学纯;所用水全部为超纯水.
1.2 纳米CeO2的制备
准确称取一定量的硝酸铈Ce(NO3)3·6H2O,在不断超声搅拌的条件下将其加入到一定浓度的沉淀剂溶液中,持续超声若干分钟后,加入适量H2O2,将混合液移至反应釜中200 ℃加热6 h,然后冷却至室温,洗涤几次,放入马弗炉高温煅烧,煅烧后将样品置于干燥器中保存.
1.3 CeO2的表征

2 结果与讨论
2.1 米粒和微球状CeO2的SEM表征
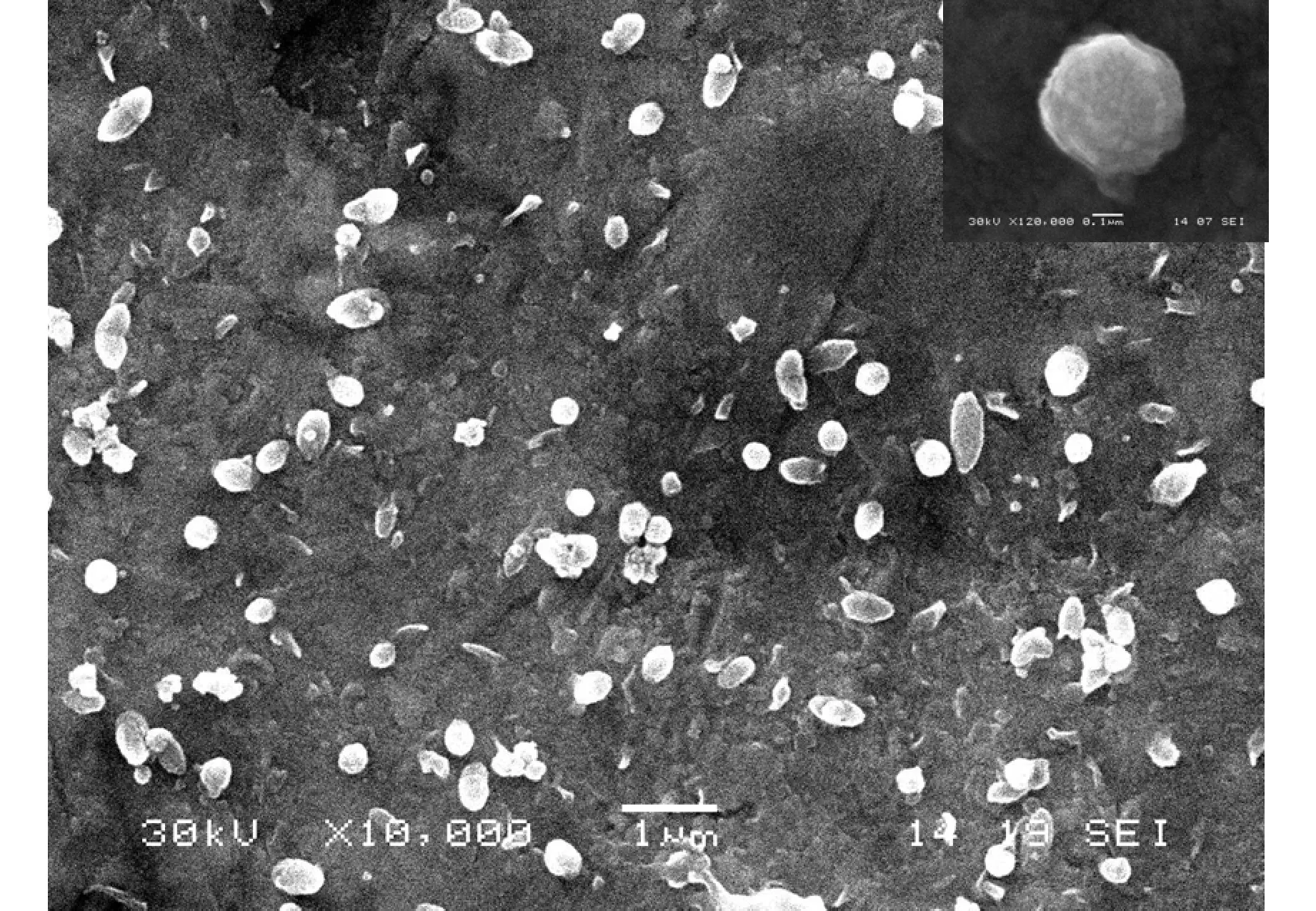
图1 CeO2产物的SEM图Fig.1 SEM image of CeO2 products注:插图为高分辨率的SEM图.
图1为产物CeO2的扫描电镜图.从图中可以清楚观察到,米粒和微球状的CeO2分散性好,无团聚现象.从高倍的SEM(见图1)可观察到所制备的米粒和微球状CeO2是由微小的纳米颗粒组成的.
2.2 米粒和微球状CeO2的XRD表征
从图2b中可观察到,所制得产物的XRD图与标准粉末衍射卡(JCPDS-NO.43-1002)相吻合,衍射指标化表明产物为萤石结构立方相的CeO2晶体,且无其它杂质峰,晶化程度高.根据Scherrer 公式D=Kλ/βcosθ,其中K为Scherrer常数;D为晶粒尺寸(nm);β为积分半高宽度,计算出煅烧3 h后CeO2产物的平均粒径为38 nm.
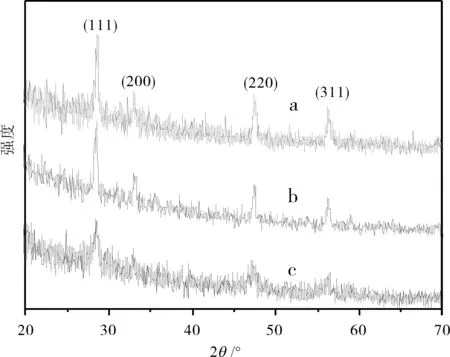
图2 CeO2产物在不同煅烧时间的XRD图Fig.2 XRD patterns of CeO2 products prepared at different calcined time注: (a) 6 h, (b) 3 h ,(c) 0 h.
2.3 米粒和微球状CeO2的激光拉曼光谱图
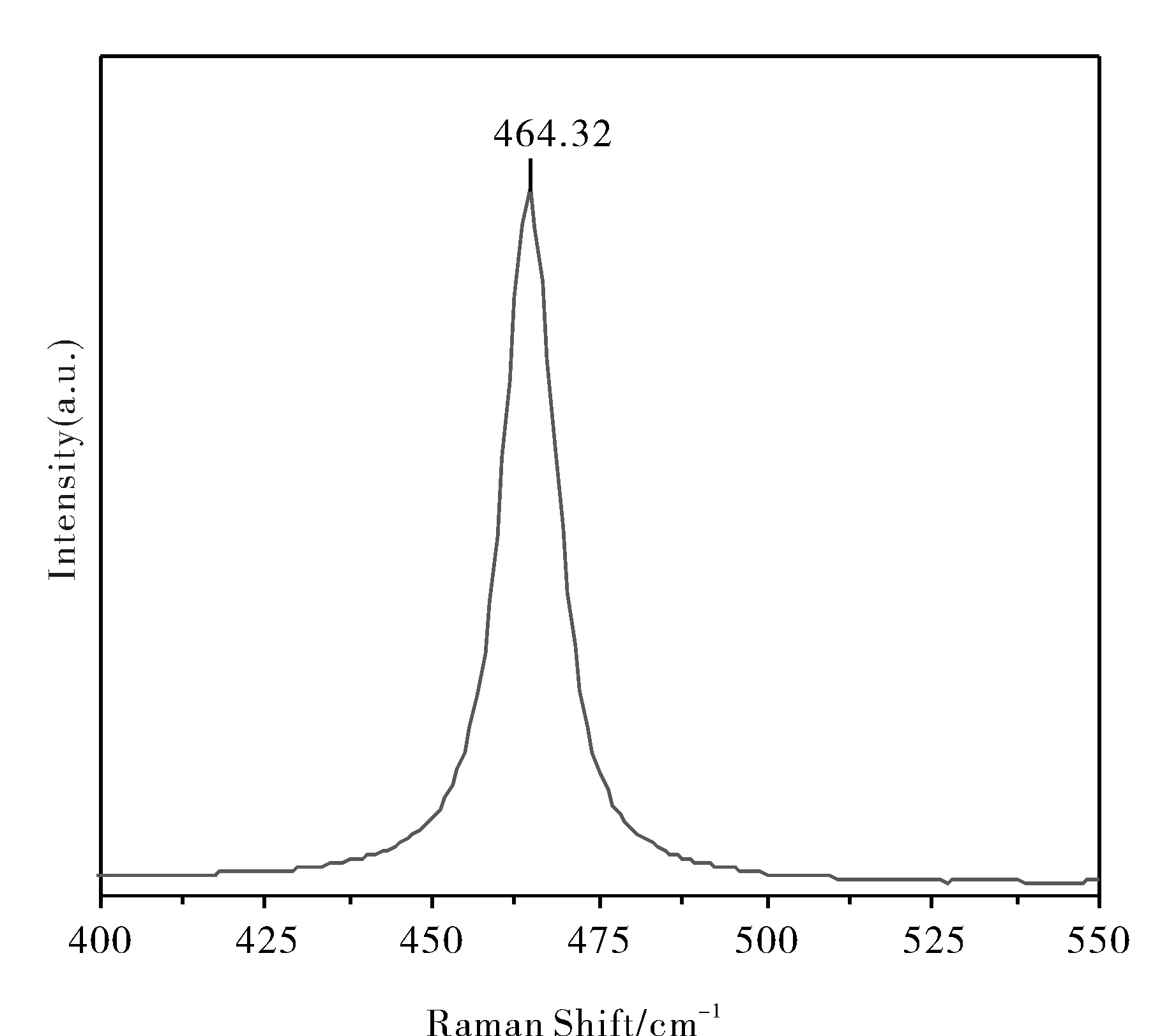
图3 CeO2产物的拉曼光谱图Fig.3 Raman spectrum of CeO2 products
对空间群为Fm3m 的面心立方构型(见图3),唯一的拉曼活性模式是F2g.萤石结构CeO2的该拉曼信号在465 cm-1.本研究CeO2样品在464.32 cm-1有很强的拉曼峰,归属为Ce—O—Ce对称伸缩振动的F2g模式,但该谱峰在不同条件下会因晶体结构的细微变化而偏移,464.32 cm-1值较文献报道[11]的略向低波数移动,可能是粒度较小的缘故.
2.4 米粒和微球状CeO2的UV-DRS分析
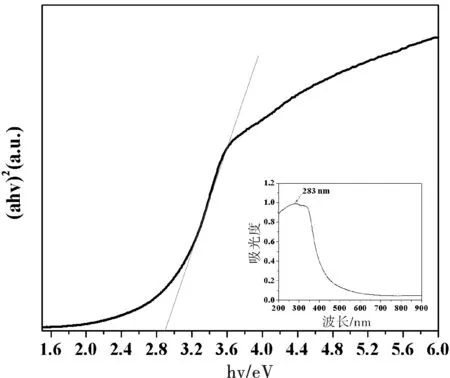
图4 CeO2产物的能量图Fig.4 Energy spectrum of CeO2 products注:插图为CeO2产物的UV-DRS图.
纳米材料的光学吸收性能与纳米结构的形貌、尺寸、材质本身等因素有关.对于纳米CeO2半导体的光吸收谱,其带边区域的光吸收值满足下列公式:αhν=(hν-Eg)n,其中α为吸收系数;hν为入射光子能量;Eg为光学带隙;对于允许的直接带隙n=1/2,对于禁介的直接带隙跃迁n=3/2,对于间接带隙跃迁n=2.由图4可知:CeO2的Eg值为2.88 eV,和文献报道[12]块状CeO2相比,稍有红移,可能是晶体表面存在缺陷的原因.图4里面的插图为CeO2产物的固体紫外-可见吸收光谱图,由图看出CeO2产物在紫外区有强的吸收峰,故该产物可作为紫外吸收材料.
2.5 米粒和微球状CeO2电化学表征
将裸玻碳电极(GCE)、修饰电极(CeO2-CS-GCE)在铁氰化钾溶液中分别进行循环伏安扫描(图5).铁氰化钾在裸GCE上的氧化峰和还原峰电流都较小(a),而在CeO2-CS-GCE(b)修饰电极上,氧化还原峰电流明显增加,由此表明CeO2被成功地修饰到电极表面,且表现出较好的电催化活性.
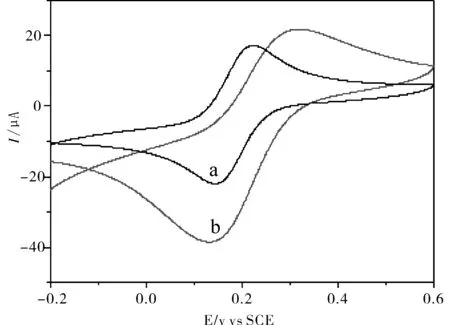
图5 电极在铁氰化钾中的循环伏安图 Fig.5 Cyclic voltammograms of electrodes in 1 mM K3[Fe(CN)6] solution,(a) GCE, (b) CeO2-CS-GCE注:(a) 裸玻碳电极,(b) CeO2/CS修饰电极.
2.6 米粒和微球状CeO2制备工艺的优化
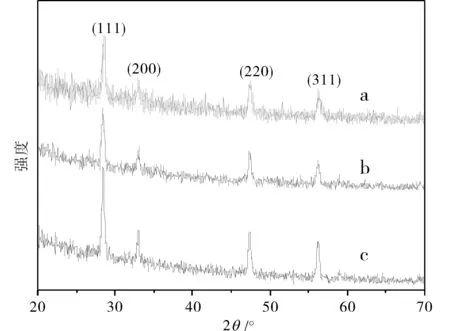
图6 不同沉淀剂合成CeO2产物的XRD图 Fig.6 XRD patterns of CeO2 products prepared by different precipitation注:(a) 氢氧化钾溶液 (b) 氨水 (c) 尿素.
2.6.1 沉淀剂的选择 采用水热法制备纳米CeO2时,分别研究了氢氧化钾、氨水和尿素等沉淀剂的影响.当沉淀剂碱性过高时,导致体系内大量羟基的存在,在形成氢氧化铈沉淀过程中氢氧化铈沉淀极易发生“胶联”而形成凝胶,其次凝胶中含有大量分散介质,它们被机械地包藏于具有多孔结构的凝胶的孔洞中,因而通过这种“胶联”形成的团聚在随后的热处理中会进一步加剧,导致最终的氧化物团聚体难以进行解聚.图6为采用尿素、氢氧化钾和氨水为沉淀剂所制备的纳米CeO2的XRD图,通过Scherrer 公式D=Kλ/βcosθ计算其粒径,分别为38 nm,50 nm,57 nm,由此可见,采用弱碱性的尿素作为沉淀剂制备的样品粒径最小,所以本文选择尿素作为沉淀剂.
2.6.2 氧化剂及其用量的选择 铈元素在溶液中可出现4种形态:Ce3+、Ce4+、Ce(OH)3和Ce(OH)4,其中Ce(OH)4不溶于HNO3,若将离子状态的Ce3+氧化成Ce(OH)4时,必须选择合适的氧化剂,才能得到稳定的CeO2颗粒.H2O2符合无论在碱性还是在酸性溶液中都是强氧化剂,且不会带来任何杂质离子,故氧化剂选择H2O2.
当Ce(N03)3溶液的浓度为0.037 5 mol·L-1,尿素浓度为2 mol·L-1时,分别加入不同量的H2O2,按照试验方法制备纳米CeO2.结果表明,当H2O2用量0.3 mL时,合成的CeO2颗粒团聚程度最低,粒径最小,故H2O2的用量为0.3 mL.
2.6.3 煅烧时间的选择 在900 ℃下分别煅烧0,3和6 h所获得的CeO2产物,通过XRD(图2 b,c)表征,产物均为萤石结构立方相的晶体,但没有煅烧的产物结晶度低.随着煅烧时间的增加,CeO2的衍射峰的强度也逐渐变强,说明煅烧有利于提高CeO2的结晶度,但煅烧3 h后产物的结晶度变化不大.因此,本文选择煅烧时间为3 h.
3 结 语
采用硝酸铈为原料,双氧水为氧化剂、尿素为沉淀剂的水热法制备了米粒和微球状CeO2.较一般CeO2的合成方法,此方法条件温和,快速,环保,所得的样品单分散性好,具有较好的光电活性,有关电化学分析及紫外光吸收方面的应用正在研究中.
参考文献:
[1] Cai W D, Chen F, Shen X X, et a1. Enhanced catal-ytic degradation of AO7 in the CeO2-H2O2system with Fe3+doping[J]. Appl Catal B Environ, 2010, 101: 160-168.
[2] 赵明,王海蓉,陈山虎,等. CeO2-ZrO2-Al2O3的制备及其负载钯三效催化剂的催化性能[J].催化学报,2010,31: 429-434.
[3] Imagawa H, Akihiko S D, Yamamura K, et a1. Mon-odisperse CeO2Nanoparticles and Their Oxygen Storage and Release Properties[J]. J Phys Chem C, 2011, 115: 1740-1745.
[4] Li C R, Chen R, Zhang X Q, et al. Electrospinning of CeO2-ZnO composite nanofibers and their photocatalytic property[J]. Mater Lett, 2011, 65: 1327-1330.
[5] Juliana F L, Renata F M, Cláudio R N, et al. ZnO:CeO2-based nanopowders with low catalytic activity as UV absorbers[J]. Applied Surf Sci, 2009, 22: 9006-9009.
[6] Durrani S M A, Al-Kuhaili M F, Bakhtiari I A, et a1. Investigation of the Carbon Monoxide Gas Sensing Characteristics of Tin Oxide Mixed Cerium Oxide Thin Films[J]. Sensors, 2012,2:2598-2609.
[7] 闫志国,周小渊, 徐艳萍,等. CeO2掺杂Mn的密度泛函理论[J]. 武汉工程大学学报,2011(4):1674-2869.
[8] Xiao H Y, Ai Z H, Zhang L Z. Nonaqueous Sol-Gel Synthesized Hierarchical CeO2Nanocrystal Microspheres as Novel Adsorbents for Wastewater Treatment[J]. J Phys Chem C, 2009, 113:16625-16630.
[9] Cui R R, Lu W C, Zhang L M, et a1. Template-Free Synthesis and Self-Assembly of CeO2Nanospheres Fabricated with Foursquare Nanoflakes[J]. J Phys Chem C, 2009, 113, 21520-21525.
[10] Yang Z J, Han D Q, Ma D L, et a1.Fabrication of Monodisperse CeO2Hollow Spheres Assembled by Nano-octahedra[J]. Cryst Growth Des, 2010, 10:291-295.
[11] Kostic R, Askrabic S, Dohcevic-Mitrovic Z, et al. Low-frequency Raman scattering from CeO2nanoparticles[J]. Appl Phys, 2008,90:679-683.
[12] Liao X H, Zhu J M, Zhu J J, et al. Preparation of monodispersed nanocrystalline CeO2powders bymicrowave irradiation[J]. Chem Commun, 2001, 10:937-938.
