皱边石杉内生真菌ISSR-PCR反应条件的优化
2012-06-08史云峰禹利君刘仲华黄璜胥锦桦朱楠楠
史云峰,禹利君,刘仲华,黄璜,胥锦桦,朱楠楠
(1.湖南农业大学 a.东方科技学院;b.农学院,湖南 长沙 410128;2.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 茶学教育部重点实验室,湖南 长沙 410128)
石杉科植物含有治疗早老性痴呆症的特效药物成分石杉碱甲。若能从其内生真菌中获得可产石杉碱甲的菌株,有望解决早老性痴呆病人的用药需求。对石杉科植物内生真菌的研究起步较晚,主要集中在对其菌种的分离、纯化和形态学初步鉴定[1–3],对其内生真菌进行相关分子标记的研究尚少。内部简单重复序列(inter simple sequence repeat, ISSR)结合了随机引物扩增多态 DNA(random amplified polymorphic DNA, RAPD)和简单重复序列(simple sequence repeat, SSR)标记技术的优点,无需知道基因组序列信息,DNA用量少,稳定性好,多态性高,已广泛应用于分子标记辅助育种[4–5]、植物病原菌进化与亲缘关系分析[6]、遗传多样性分析、遗传作图、基因定位等[7–9]。ISSR反应易受Taq DNA聚合酶、Mg2+、模板DNA、dNTPs、引物及退火温度的影响,不同物种的试验参数均有差异。以皱边石杉(Huperzia crispata)内生真菌的 DNA 为材料,对其ISSR–PCR反应体系进行单因素试验及正交试验优化,旨在建立稳定、可靠的 ISSR–PCR反应体系,为后期从分子水平对皱边石杉内生真菌进行分类鉴定、种群遗传结构分析及种质资源的优选提供参考。
1 材料与方法
1.1 材 料
新鲜皱边石杉样品采自湖南湘西自治州永顺县小溪原始次生林国家自然保护区,从中分离纯化的 99株内生真菌保存于湖南农业大学国家植物功能成分利用工程技术研究中心。
Mg2+、dNTPs、Taq DNA聚合酶、Marker购自上海生工生物工程技术服务有限公司。根据加拿大哥伦比亚大学(University of British Columbia,UBC)公布的植物病源基因真菌DNA的ISSR引物信息,由南京金斯特科技有限公司合成引物。
1.2 方 法
1.2.1 DNA提取
发酵培养内生真菌获菌丝体。将菌丝体用无菌超纯水洗净作为DNA提取材料。采用氯化苄改良法,结合超声破壁处理提取DNA[10–11]。用0.8%琼脂糖凝胶电泳检测DNA质量与纯度。将所提取的DNA与标准DNA进行浓度比较,稀释至30 ng/μL备用。
1.2.2 ISSR引物筛选
将99株内生真菌DNA随机混合后分成10份,根据各ISSR引物Tm值将100条引物分成10组,探索各引物退火温度。采用 Biometra T–Gradient Thermoblock PCR仪对混合DNA样本进行PCR扩增,从100条ISSR引物中筛出谱带清晰、多态性高的引物。
1.2.3 ISSR–PCR反应体系的参数优化
对 25 μL ISSR–PCR 反应体系分别设定 5个DNA 模板浓度(10、20、30、40、50 ng/(25 μL)),5个 Taq DNA 聚合酶浓度(1.0、1.5、2.0、2.5、3 U/μL),6个Mg2+浓度(0.5、1.0、1.5、2.0、2.5、3.0 mmol/L),5 个dNTPs浓度(0.2、0.4、0.6、0.8、1.0 mmol/L)。基础ISSR–PCR扩增体系为25 μL。基础反应体系中含 10×PCR Buffer(Mg2+浓度为 2.5 mmol/L)2.5 μL,dNTPs(10 mmol/L)0.5 μL,引物(10 pmol/μL)1.25 μL,Taq E(1U/μL)1.25 μL,DNA 模板(10 ng/μL)2.5 μL,无菌ddH2O 17 μL。对照以ddH2O代替模板DNA。PCR程序为:94 ℃预变性5 min;94 ℃变性45 s,适宜温度(最适退火温度因引物而异)下退火 45 s,72 ℃延伸60 s,共30次循环;72 ℃延伸5 min。扩增产物经2%琼脂糖凝胶电泳2 h,于自动凝胶成像系统进行观察,照相。
1.2.4 ISSR–PCR正交试验设计
在单因素优化条件的基础上,采用正交设计L9(34)对影响ISSR–PCR反应的DNA模板浓度、Taq DNA聚合酶浓度、Mg2+浓度、dNTPs浓度4个因素,各设置3个水平试验,共9个处理,每个处理设置平行反应(表1),以建立最优PCR反应体系。
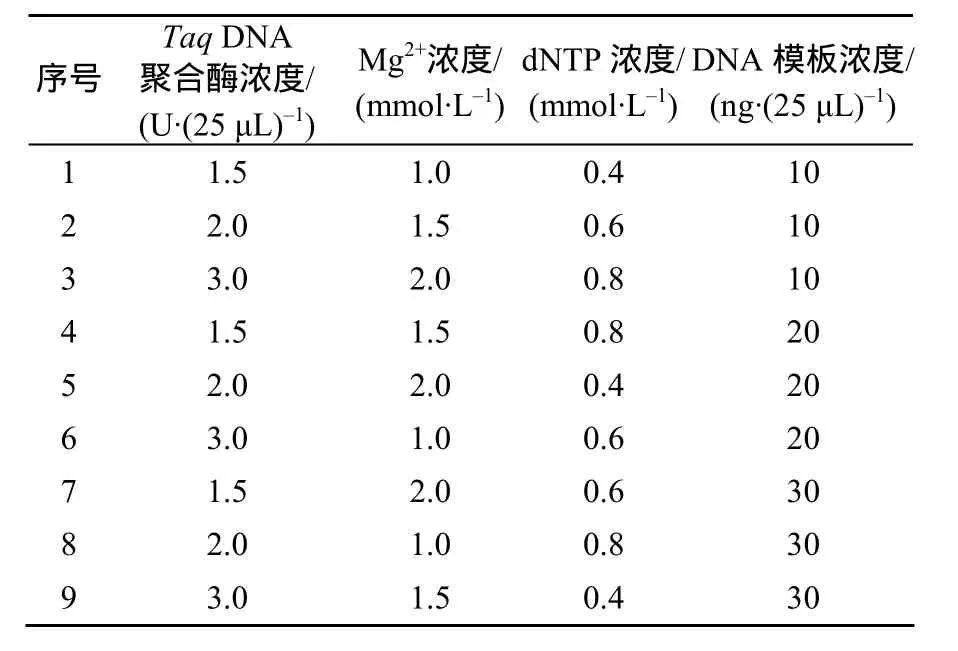
表1 ISSR–PCR反应因素的L9(34)正交试验设计Table1 L9(34)orthogonal design for the factors and levels of ISSR–PCR reaction
2 结果与分析
2.1 不同参数对ISSR–PCR反应结果的影响
2.1.1 引物最适退火温度的确定
对初步筛选出的41条ISSR引物进行适宜退火温度探索。退火温度取决于引物的长度、浓度和引物的碱基组成,在各引物Tm值低5 ℃的温度上、下各浮动 7.5 ℃。设定 12个退火温度梯度,进行PCR扩增,确定10条稳定好、多态性高ISSR引物的适宜退火温度。这 10条引物分别为 UBC842、UBC848、UBC850、UBC856、UBC861、UBC864、UBC868、UBC873、UBC880、UBC887(表 2)。

表2 10条用于ISSR–PCR扩增引物的退火温度Table 2 Ten ISSR primers for ISSR–PCR amplification and their annealing temperatures
2.1.2 适宜DNA模板浓度的确定

图1 引物UBC856和UBC848在不同DNA模板浓度下的电泳结果Fig.1 Electrophoresis of PCR products amplified using primers UBC856 and UBC848 with different concentrations of DNA template
由图1可知,25 μL反应体系中,模板DNA为20~60 ng,UBC856、UBC848均可扩增出清晰的DNA条带。模板量增加对扩增结果的影响不明显。因DNA在使用过程中经历冻融后会发生部分降解,为节约模板用量,并获得清晰的扩增条带,本扩增体系中选取DNA模板30 ng。
2.1.3 适宜Mg2+浓度的确定
从图2可知,选用UBC848、UBC856引物进行 Mg2+浓度探索,当 Mg2+浓度分别为 0.5~3.0 mmol/L时,反应结果差异显著;当Mg2+浓度低于1.5 mmol/L时均无明显扩增条带,可见,Mg2+浓度过低,Taq酶的作用效率低,不能有效扩增;Mg2+浓度过高,可能会产生非特异性扩增,导致条带弥散。图2中11、12泳道泛白拖尾主要是在电泳载样时枪头对点样孔有轻微的戳破,样品没有全部沉入点样孔底部,部分样品留在琼脂糖凝胶表层,导致带型不是非常集中。以Mg2+浓度相对较低,且能扩增出丰富的特异性条带为选择标准,UBC848、UBC856引物的适宜Mg2+浓度为2.0 mmol/L。

图2 引物UBC856和UBC848在不同Mg2+浓度下的电泳结果Fig.2 Electrophoresis of PCR products amplified using primers UBC856 and UBC848 with different Mg2+ concentrations
2.1.4 适宜Taq酶浓度的确定
由图 3可知,在 Taq酶浓度为 1.0~3.0 U/μL和 UBC856、UBC848在Taq酶浓度分别为1.5、2.0 U/μL时,可扩增出清晰的DNA多态性条带;当Taq酶浓度为1.0 U/μL时,2条引物扩增出的条带均较弱,不太清晰;当 Taq酶浓度为 2.5 U/μL时,其扩增条带呈减弱趋势。可见,在该反应体系中,Taq酶浓度为1.5~2.0 U/μL是适宜的。从节约试剂成本角度考虑,选取1.5 U/μL为Taq酶适宜浓度。

图3 引物UBC856和UBC848在不同Taq酶浓度下的电泳结果Fig. 3 Electrophoresis of PCR products amplified using primers UBC856 and UBC848 with different concentrations of Taq polymerase
2.1.5 适宜dNTPs浓度的确定
dNTPs作为PCR反应的原料,浓度太低会使扩增反应不完全,从而降低PCR产物的产量;浓度过高会对Mg2+产生抑制作用,影响Taq酶活力,造成浪费。从图4可知:当dNTPs浓度为0.2~1.0 mmol/L时,反应结果差异显著;dNTPs浓度为 0.4~0.6 mmol/L时可得到较清晰的扩增条带。若dNTPs浓度继续加大,UBC856号引物的条带消失。UBC856引物在dNTPs浓度0.4、0.6 mmol/L扩出的条带带型一致,但条带亮度有差异,主要是UBC856–2泳道在电泳载样时枪头对点样孔有轻微的戳破,部分样品留在琼脂糖凝胶表层,带型有些弥散。
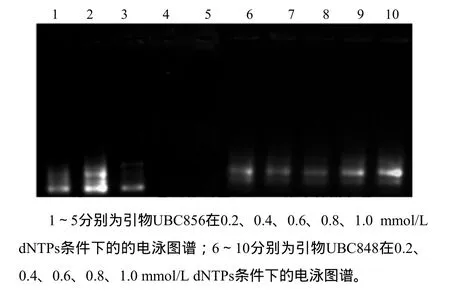
图4 引物UBC856和UBC848在不同dNTPs浓度下的电泳结果Fig.4 Electrophoresis of PCR products amplified using primers UBC856 and UBC848 with different concentrations of dNTPs
2.2 ISSR–PCR最优反应体系的建立
根据 L9(34)正交试验设计,对皱边石杉内生真菌菌丝体DNA混合模板进行ISSR–PCR扩增、琼脂糖凝胶电泳检测。由图5可知,以7号处理进行扩增,其平行样重复好,多态性条带最丰富。25 μL ISSR–PCR 扩增体系为:10×PCR Buffer(Mg2+浓度为 2.0 mmol/L)2.5 μL,dNTPs(10 mmol/L)0.6 μL,引物(10 pmol/μL)2.0 μL,Taq E(1 U/μL)1.5 μL,DNA模板(10 ng/μL)3 μL,无菌 ddH2O 15.4 μL。
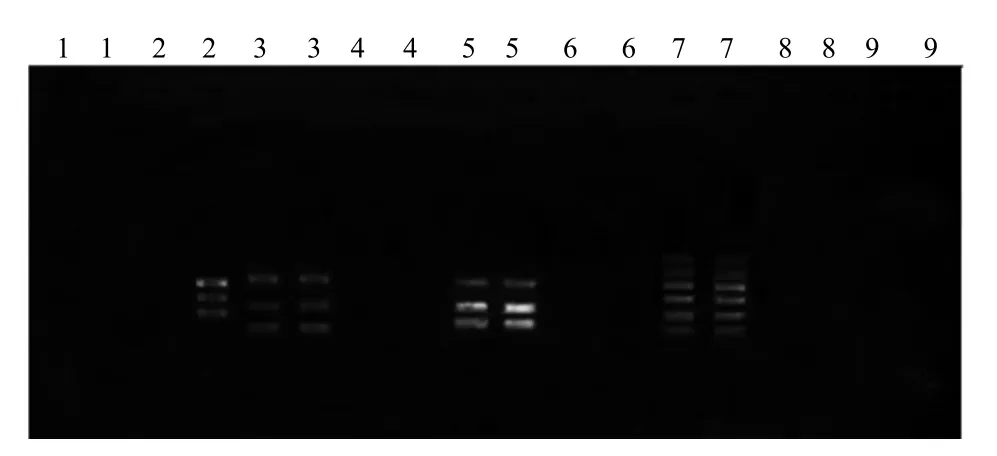
图5 ISSR–PCR优化体系电泳图谱Fig.5 Electrophoresis for the optimized ISSR–PCR reaction system
2.3 UBC873引物对99株内生真菌ISSR–PCR扩增结果的验证
以UBC873引物对99株内生真菌基因组DNA进行PCR扩增。按照形态学初步归类比对结果,将相似性较高菌株的ISSR–PCR产物邻接点样,扩增产物大小为200~2 000 bp(图6)。从图6可知:皱边石杉内生真菌资源间的 ISSR多态性水平较高,其中1号和2号、46号和52号、63号和64号、43号和44号、35号和42号这5对菌株菌丝体DNA的ISSR指纹图谱几乎一致,可初步推定这5对菌株中各有1个重复菌种,其他均为亲缘关系或远或近的不同菌种。由此可知,皱边石杉内生真菌资源遗传多样性非常丰富。
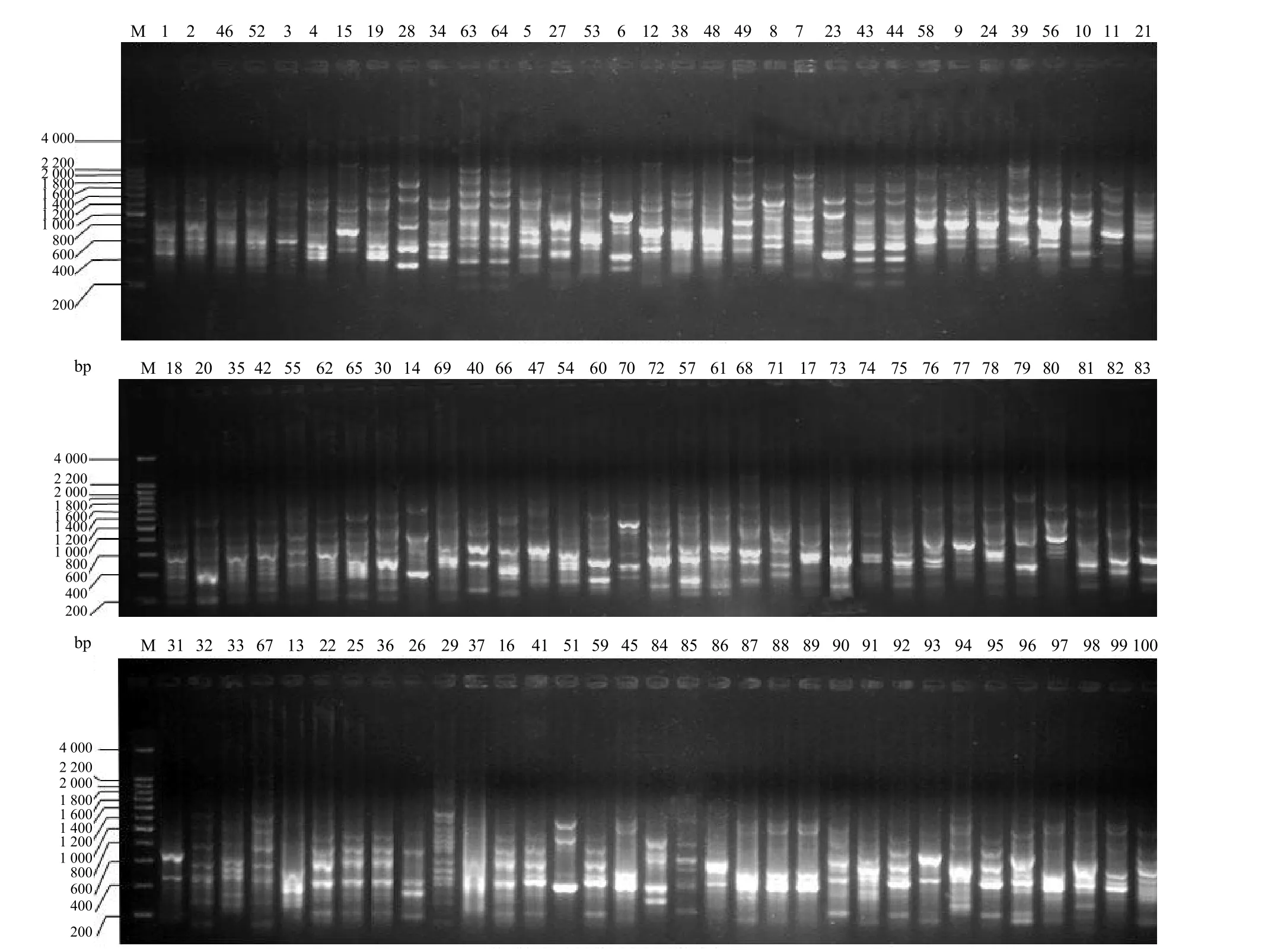
图6 引物UBC873对99株内生真菌的扩增结果Fig.6 Amplification results for 99 endophytic fungi strains of Huperzia crispata using primer UBC 873
3 结论与讨论
确定ISSR–PCR反应的适宜退火温度是决定试验成败的前提。引物退火温度不仅与引物序列有关,还与物种DNA的序列密切相关[12–13]。通常引物退火温度比引物的Tm值低5 ℃左右。本试验中,为快速确定100条ISSR引物的最适退火温度,根据其Tm值将引物分成10组,在各引物Tm值低5 ℃的温度上、下各浮动7.5 ℃,设定12个温度梯度,并将99个DNA模板随机混合,进行合适引物及其最佳退火温度筛选,确定了 UBC842、UBC848、UBC850、UBC856、UBC861、UBC864、UBC868、UBC873、UBC880及UBC887等10条稳定性好、多态性高的ISSR引物作为皱边石杉内生真菌ISSR分析的合适引物。
在建立皱边石杉内生真菌ISSR–PCR扩增优化体系的过程中,参照植物病原菌 ISSR扩增的反应体系[6,8,14]来确定ISSR基础反应体系,在此基础上进行模板DNA浓度、Mg2+浓度、Taq酶浓度、dNTPs浓度的单因素试验和正交试验,得到最优反应体系(25 μL):10×PCR Buffer(Mg2+浓度为 2.0 mmol/L)2.5 μL,dNTPs(10 mmol/L)0.6 μL,引物(10 pmol/μL)2.0 μL,Taq E(1U/μL)1.5 μL,DNA 模板(10 ng/μL)3 μL,无菌ddH2O 15.4 μL。以此优化的扩增体系,选用UBC873引物对99株内生真菌进行扩增验证,获得了良好的结果,可供后续皱边石杉内生真菌的遗传多样性及遗传图谱构建研究参考。
[1]Wang Y,Zeng Q G,Zhang Z B,et al.Isolation and characterization of endophytic(huperzine A–producing fungi from Huperzia serrata[J].J Ind Microbiol Biotechnol,2010,38(9):1267–1278.
[2]鞠錾,王峻,潘胜利.4种石杉科植物中产生石杉碱甲的内生真菌的分离及初步鉴定和HPLC测定石杉碱甲的含量[J].复旦学报:医学版,2009,36(4):445–449.
[3]范铁芳,史云峰,杨培迪,等.皱边石杉内生菌J060918产四草酸钾的发酵条件[J].湖南农业大学学报:自然科学版,2008,34(4):409–412.
[4]郑海燕,粟建光,戴志刚,等.利用 ISSR和 RAPD标记构建红麻种质资源分子身份证[J].中国农业科学,2010,43(17):3499–3510.
[5]王海飞,关建平,马钰,等.中国蚕豆种质资源ISSR标记遗传多样性分析[J].作物学报,2011,37(4):595–602.
[6]张培培,梁晨.番茄叶霉病菌 ISSR–PCR体系的建立[J].菌物研究,2010,8(2):107–114.
[7]Raina S N,Rani V,Kojima T,et al.RAPD and ISSR fingerprints as useful genetic markers for analysis of genetic diversity,varietal identification,and phylogenetic relationships in peanut(Arachis hypogaea)cultivars and wild species[J].Genome,2001,44(5):763–772.
[8]于红梅,林英任,陈莉,等.皮下盘菌属种内及种间遗传多样性的ISSR分子标记[J].微生物学杂志,2009,29(2):12–16.
[9]Curlevski N J,Chambers S M,Anderson I C,et al.Identical genotypes of an ericoid mycorrhiza-forming fungus occur in roots of Epacris pulchella(Ericaceae)and Leptospermum polygalifolium(Myrtaceae)in an Australian sclerophyll forest[J].FEMS Microbiol Ecol,2009,67(3):411–420.
[10]禹利君,史云峰,范铁芳,等.皱边石杉基因组总DNA保存期间的质量检测分析[J].生物技术通讯,2007,18(4):635–637.
[11]史云峰,禹利君,胥锦桦,等.皱边石杉内生真菌DNA快速有效提取的研究[J].中国农学通报,2012,28(6):183–188.
[12]Nazrul M I,Yin–Bing B.ISSR as new markers for identification of homokaryotic protoclones of Agaricus bisporus[J].Curr Microbiol,2010,60(2):92–98.
[13]孙立夫,裴克全,张艳华,等.法国蜜环菌 Armillaria gallica 菌株遗传多样性的 ISSR分析[J].菌物学报,2011,30(5):686–694.
[14]赵云福,刘翠,梁晨,等.白粉寄生孢ISSR–PCR体系的建立及遗传多样性的初步分析[J].菌物学报,2010,29(5):653–664.
